基于生物分子网络和分子对接研究槲皮素抗宫颈癌的机制
2020-03-17朱晓芹刘志强王博龙
朱晓芹,刘志强,王博龙*
1宜春学院化学与生物工程学院,宜春 336000;2鹤壁职业技术学院,鹤壁 458000
在全球范围内,宫颈癌的发病率仅次于乳腺癌,高居女性恶性肿瘤的第2位,是一种严重危害女性健康的疾病。临床上早期宫颈癌治疗以手术为主,但宫颈癌起病隐匿,不同地区的筛查手段及技术差异使得半数以上的患者就诊时已处于中晚期[1,2]。中晚期宫颈癌治疗以放化疗为主,手术为辅,然而宫颈癌是对放射线中等敏感的实体肿瘤,对于年轻女性患者,放疗还会损伤卵巢,导致卵巢早衰等一系列并发症。化疗药物不仅毒副作用大,而且部分毒副作用跟放疗副作用重叠,一般患者难以耐受。因此,仍需努力寻找高效低毒的抗宫颈癌药物。
槲皮素(quercetin)是一种广泛分布于蔬菜、水果及多种中草药的天然黄酮类化合物,具有抗炎、抗氧化、抗纤维化、抗菌及清除自由基等药理作用。大量流行病学证据表明,多食富含槲皮素的水果和蔬菜可以预防多种癌症的发生[3],而槲皮素本身抑制细胞增殖、诱导细胞凋亡、调节细胞周期的显著作用,也在多种癌株的体内外实验中得到证实。近年来,槲皮素在宫颈癌放化疗上的双重作用引起了越来越多的关注,但具体机制尚未完全明确。本研究借助生物分子网络系统整合的大量生物信息及数据,挖掘槲皮素抗宫颈癌靶点,进行GO(Gene Ontology)功能分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,筛选主要靶点与槲皮素进行分子对接,以期全面解析槲皮素抗宫颈癌的分子机制。
1 材料与方法
1.1 数据库与软件
(1)活性成分靶点数据库:中药系统药理学数据库与分析平台,TCMSP(http://ibts.hkbu.edu.hk/ LSP/ tcmsp.php);Swiss TargetPrediction(http://www.swisstargetsprediction.ch/);毒性与基因比较数据库CTD(http://ctdbase.org/)。(2)蛋白质数据库,UniProt(https://www.uniprot.org/);PDB(http://www.rcsb.org/)。(3)疾病靶点数据库:GeneCards(https://www.genecards.org/);DisGeNET(http://www.disgenet.org/);Open Targets Platform(https://www.targetsvalidation.org)。(4)蛋白质相互作用分析平台,STRING(https://string-db.org/)。(5)生信在线分析平台:OmicShare云平台(http://omicshare.com/);DAVID 6.8(https://david.ncifcrf.gov/)。(6)网络分析及作图软件Cytoscape 3.6.1;Venny 2.1.0(https://bioinfogpcnb.csic.es/tools/venny/index.html);ChemBioOffice 2014。(7)分子对接相关软件:分子三维结构处理软件PyMOL;AutoDuck Vina[4]及AutoDuck Tools。
1.2 槲皮素抗宫颈癌靶点筛选及其网络构建
将槲皮素输入TCMSP数据库检索其作用靶点;运用Swiss TargetPrediction服务器的药效团模型和基于配体分子相似性,预测槲皮素作用靶点;在CTD数据库中选取槲皮素匹配度高的前200个靶点,将以上三个来源的靶点合并去重后得到槲皮素作用靶点。分别在GeneCards、DisGeNET、Open Targets数据库中检索宫颈癌相关靶点,将每个数据库获得的靶点按照相关度打分,从高到低选取分值前200个靶点,合并去重后得到宫颈癌靶点。再将宫颈癌靶点与槲皮素靶点输入Venny 2.1.0软件,取交集部分作为槲皮素抗宫颈癌靶点,并导入 Cytoscape 3.6.1 软件构建槲皮素-抗宫颈癌靶点网络。
1.3 槲皮素抗宫颈癌靶点相互作用网络构建
将槲皮素抗宫颈癌靶点导入STRING平台构建蛋白互作网络(protein-protein interaction,PPI),设置蛋白种类为“Homo sapiens”,最低相互作用阈值“medium confidence=0.4”,其他参数保持默认值。将 PPI 网络导入Cytoscape 3.6.1软件,利用“Network Analysis”功能计算各网络节点的度值(Degree)、介数(Betweenness)及最短路径(Closeness)等拓扑参数,节点的Degree、Betweenness、Closeness越大,该节点在网络中的位置就越重要。选取Degree、Betweenness、Closeness同时在平均值之上的靶点作为槲皮素抗宫颈癌的主要靶点。
1.4 槲皮素抗宫颈癌靶点的GO功能富集分析和KEGG通路富集分析
将槲皮素抗宫颈癌靶点输入OmicShare和DAVID 6.8平台,分别进行槲皮素抗宫颈癌靶点的GO功能富集分析与KEGG通路富集分析,依据P-value<0.001和P-value<0.05筛选槲皮素抗宫颈癌靶点富集的生物功能及信号通路。
1.5 槲皮素抗宫颈癌主要靶点的分子对接
在PDB数据库搜索槲皮素抗宫颈癌前十个主要靶点的蛋白晶体复合物,借助PyMOL软件将靶蛋白与原配体分离,同时去除靶蛋白中的水分子、磷酸根以及多余的非活性配体,在AutoDuck Tools软件中对处理后靶蛋白进行加氢、加电荷等操作。将槲皮素的2D结构导入ChemBio3D软件,以mol2的格式保存其3D结构,将靶蛋白、原配体、槲皮素的3D结构统一设置成AutoDuck Tools软件可识别的pdbqt格式,以原配体所在位点为靶蛋白的活性口袋,分别进行靶蛋白与槲皮素、原配体的分子对接,对比分析原配体、槲皮素与各靶蛋白的亲和力。
2 结果
2.1 槲皮素抗宫颈癌靶点及其网络构建
分别从TCMSP、Swiss TargetPrediction、CTD数据库筛得靶点96、100、200个,合并去重后确定槲皮素靶点为311个;分别从GeneCards、DisGeNET、Open Targets 三个数据库各取前200个靶点,合并去重后确定宫颈癌靶点为460个,再将311个成分靶点与460个疾病靶点取交集,得到槲皮素抗宫颈癌靶点97个(图1)。将槲皮素及97个抗宫颈癌靶点导入 Cytoscape 3.6.1 软件,得到槲皮素-抗宫颈癌靶点网络(图2)。
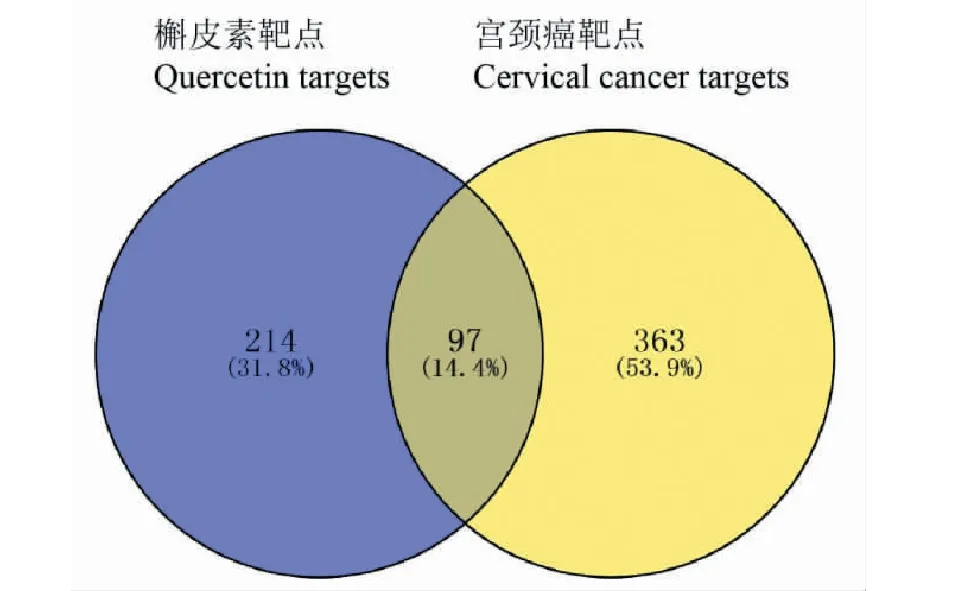
图1 槲皮素-抗宫颈癌靶点韦恩图Fig.1 Venn diagram of quercetin-anticervical cancer targets
2.2 槲皮素抗宫颈癌靶点的PPI网络
如图3所示,每个参与互作的靶点用一个圆圈表示,圆圈面积越大表示其Degree越大,圆圈周线越粗代表其Betweenness越大。PPI网络中共有97个节点,2 311条相互作用连线,平均Degree为47.65,平均Betweenness为5.31×10-3,平均Closeness为6.80×10-1,Degree、Betweenness、Closeness同时在平均值之上的靶点有29个(表1)。29个主要靶点包括调控转录及凋亡TP53、MYC、AKT1、CASP3、CASP8、CTNNB1、CYCS、EP300、ERBB2、MAPK1、MAPK3、SRC、STAT3;调控炎症反应IL6、TNF、PTGS2、IL1B、CXCL8 ;参与血管生成EGF、EGFR、VEGFA;调控细胞周期CCND1、CDKN2A、PTEN ;以及性激素受体AR、ESR1和其它。
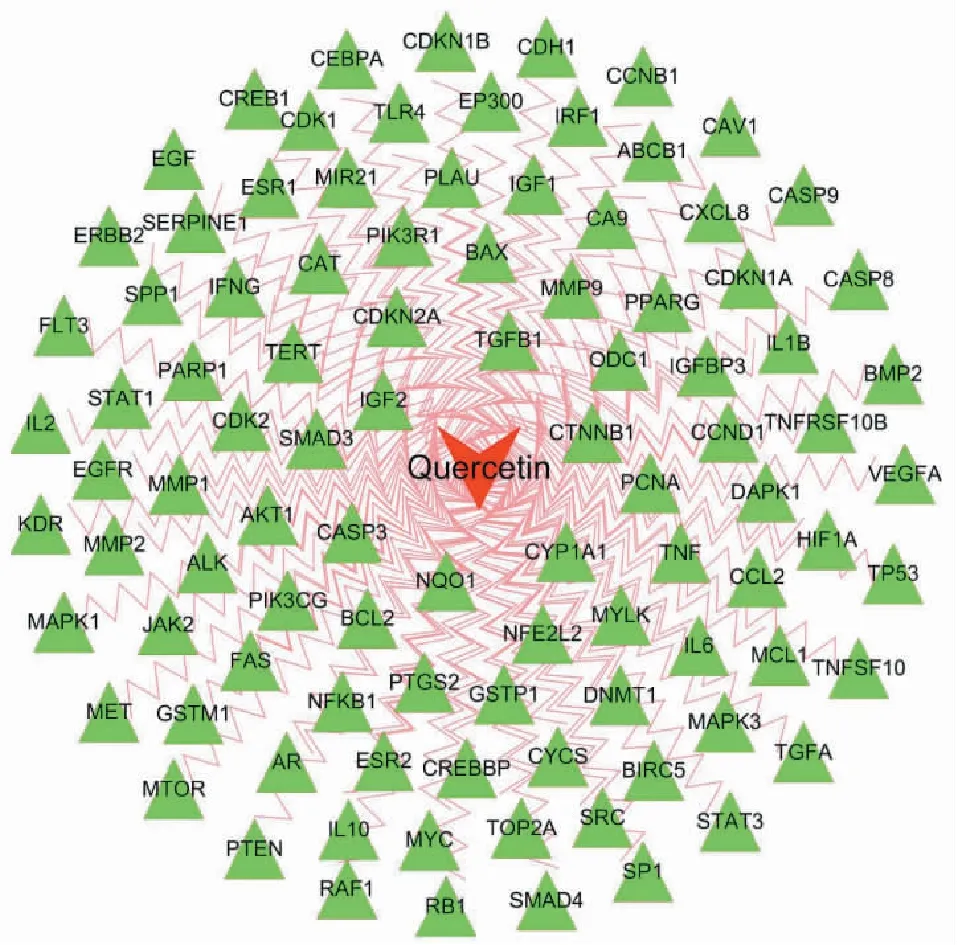
图2 槲皮素-抗宫颈癌靶点网络Fig.2 The network of quercetin-anticervical cancer targets注:箭头表示槲皮素,三角形表示宫颈癌靶点。Note:The arrow represents quercetin and the triangle represents the targets of cervical cancer.

表1 主要靶点及其拓扑参数

图3 蛋白互作网络Fig.3 The network of protein-protein interaction
2.3 槲皮素抗宫颈癌靶点的GO功能富集
依据P-value<0.001筛选出GO条目525个,其中生物过程(Biology Process)473个,分子功能(Molecular Function)30个,细胞组成(Cellular Componet)22个。如图4所示,生物过程主要涉及刺激反应、生物过程调节、细胞增殖、细胞代谢、生物粘附等;分子功能及细胞组成主要涉及抗氧化活性、催化活性、细胞膜、细胞器等。进一步富集发现GO条目主要聚集在细胞增殖、凋亡、死亡、代谢等方面(图5),说明槲皮素可能通过调控细胞增殖、凋亡、代谢等发挥抗宫颈癌作用。
2.4 槲皮素抗宫颈癌靶点的KEGG通路
依据P-value<0.05筛得槲皮素抗宫颈癌靶点KEGG通路22条(表2),图6为各通路富集气泡图,富集因子(Rich factor)是槲皮素富集在通路下的靶点与该通路所有蛋白的比值,比值越大表示富集度越大。P-value取值范围[0,1],颜色越红表示P-value越小,富集越明显。点的大小表示槲皮素富集在通路下的靶点个数,点越大表示富集靶点越多。由图可知,富集因子较大的通路包括与肿瘤细胞增殖、凋亡、转录密切相关的p53信号通路、FoxO信号通路、Apoptosis通路、TNF信号通路、mTOR信号通路;与肿瘤血管新生及微环境形成相关的HIF-1信号通路、VEGF信号通路。其中癌症通路富集的靶点最多,p53信号通路的富集因子最大。如图7所示,p53信号通路上富集的槲皮素抗宫颈癌靶点有细胞周期相关的p21、CyclinD、CyclinB、CDK2、Cdc2;细胞凋亡相关的Fas、Bax、CASP3、CASP8、CASP9、CytC、IGF及IGF-BP3等,说明它们与槲皮素调控细胞周期及细胞凋亡的作用密切相关。
2.5 槲皮素抗宫颈癌主要靶蛋白的分子对接
由表3可知,除4KZN靶蛋白外,其余9个靶蛋白与槲皮素结合能均<-5 kcal/mol,其中Myc原癌基因蛋白(图8)、RAC-α丝氨酸/苏氨酸蛋白激酶(图9)及信号转导及转录激活蛋白3(图10)与槲皮素的结合能最低,分别为-8.2、-7.9、-7.9 kcal/mol,说明上述靶蛋白与槲皮素亲和力最高,它们与槲皮素相互作用的氨基酸残基如表4所示。

图4 槲皮素抗宫颈癌靶点的GO功能分析Fig.4 Analysis of GO function of quercetin-anticervical cancer targets

图5 槲皮素抗宫颈癌靶点的GO功能富集Fig.5 GO enrichment of quercetin-anticervical cancer targets
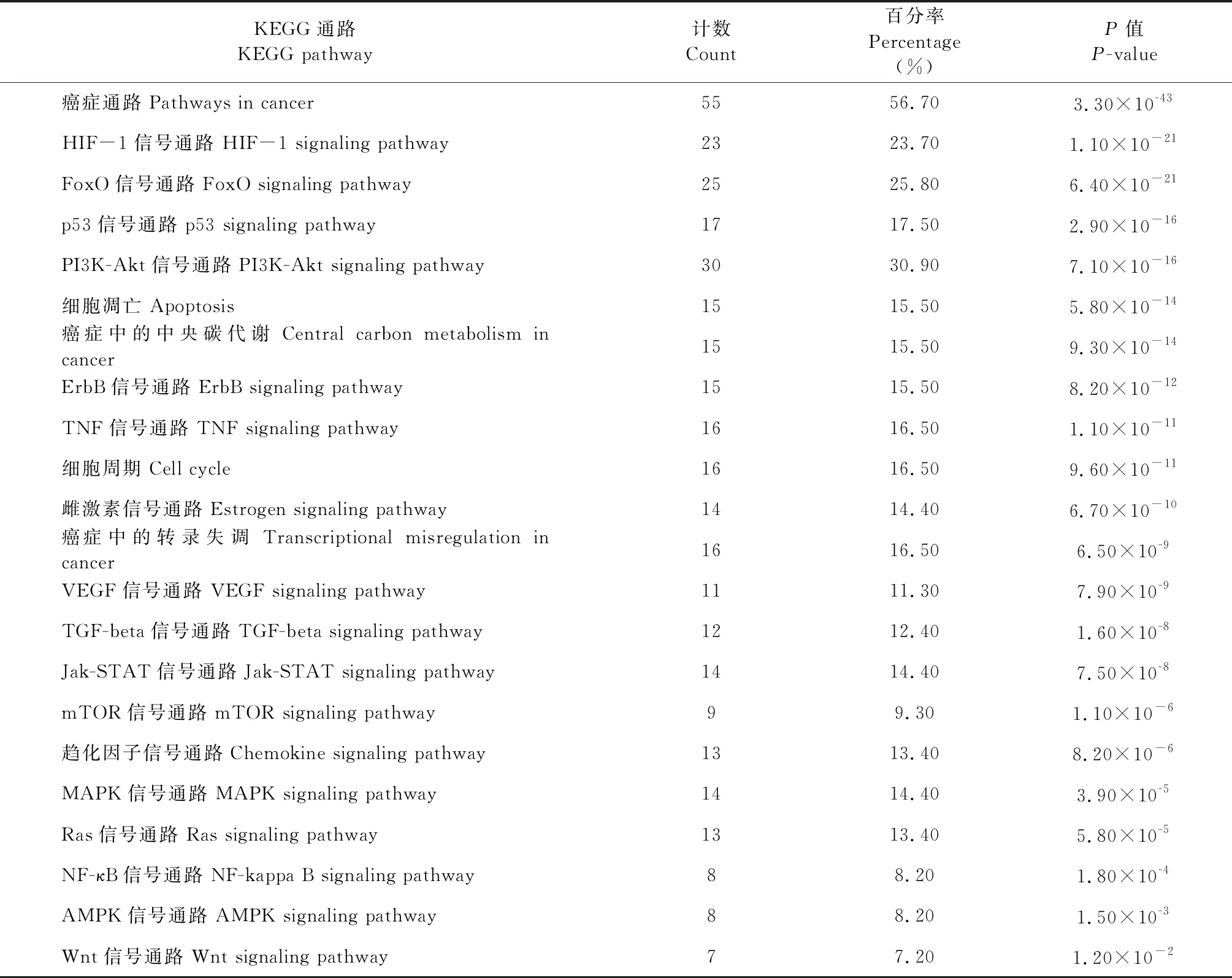
表2 KEGG信号通路信息
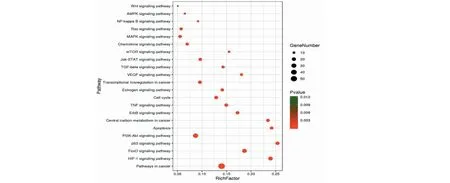
图6 槲皮素抗宫颈癌靶点的通路富集Fig.6 Pathways enrichment of quercetin-anticervical cancer targets

图7 p53信号通路分析Fig.7 The analysis of p53 signaling pathway注:★代表槲皮素在p53通路的靶点。Note :★represents targets of quercetin of enrichment in the p53 pathway.
3 讨论
天然产物是抗癌药物发掘的重要源泉,紫杉醇、长春碱、喜树碱、高三尖杉酯碱及人参皂苷Rg3等植物源性小分子已广泛应用于癌症临床治疗[5]。槲皮素是自然界广泛分布的天然黄酮类物质,多项研究[6,7]表明其抗癌活性明显,国外I和II期临床试验证实槲皮素能够抑制多种肿瘤进展[8]。国内研究主要集中在槲皮素抗宫颈癌方面,如Zhang等[9]发现槲皮素可上调Caspase-3、Caspase-9的表达,诱导宫颈癌细胞C33A凋亡,下调cyclin D1的表达,抑制宫颈癌细胞SiHa、C33A的活力和增殖。Zhu等[10]发现槲皮素通过上调Caspase-3,下调中期因子(Midkine,MK)的表达,显著抑制宫颈癌HeLa细胞增殖,并诱导其凋亡。上述研究大多侧重于细胞凋亡及细胞周期的个别蛋白,不足以系统揭示槲皮素抗宫颈癌的复杂机制。

表3 槲皮素与主要靶蛋白的分子对接

表4 靶蛋白氨基酸残基

图8 Myc原癌基因蛋白的分子对接模型Fig.8 The docking model of Myc proto-oncogene protein

图9 RAC-α丝氨酸/苏氨酸蛋白激酶的分子对接模型Fig.9 The docking model of RAC-alpha serine/threonine-protein kinase
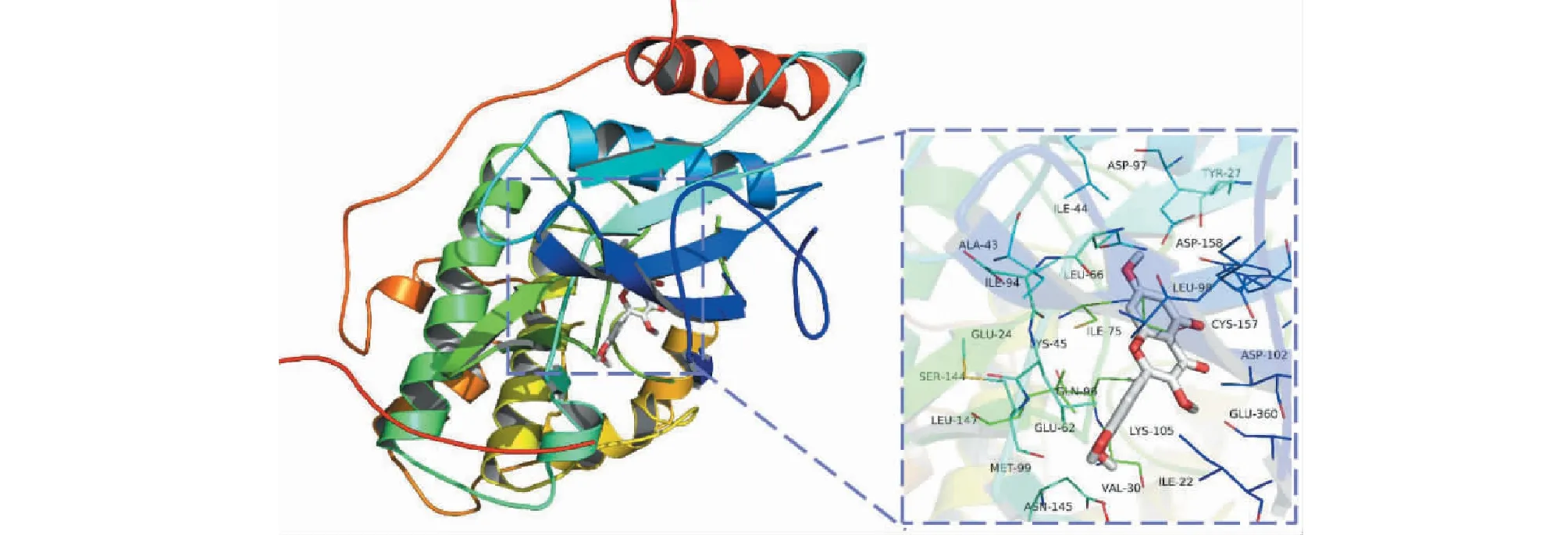
图10 信号转导及转录激活蛋白3的分子对接模型Fig.10 The docking model of signal transducer and activator of transcription 3
本研究检索多个化合物靶点数据库、疾病靶点数据库,挖掘出97个槲皮素抗宫颈癌靶点。借助蛋白互作筛出29个主要靶点,按照其功能可分为调控转录及凋亡的TP53、MYC、AKT1、CASP3、CASP8、CTNNB1、CYCS、EP300、ERBB2、MAPK1、MAPK3、SRC、STAT3;调控细胞周期CCND1、CDKN2A、PTEN ;参与血管生成的EGF、EGFR、VEGFA;调控炎症反应的IL6、TNF、PTGS2、IL1B、CXCL8 ;以及性激素受体AR、ESR1等,说明槲皮素抗宫颈癌机制除了诱导凋亡、阻滞周期外,还包括抗血管生成、调控炎症等其它机制。选取主要靶点中的前十个与槲皮素进行分子对接,结果发现其与MYC、STAT3及AKT1三个靶点的亲和力最高。MYC属于编码核蛋白的癌基因,其家族基因及产物可促进细胞增殖,永生化,去分化以及转化等,在多种肿瘤形成过程中处于重要地位。Cui等[11]发现调节C-Myc可诱导宫颈癌细胞G2/M期阻滞和细胞死亡,另有研究[12]证实槲皮素能抑制MYC基因结合位点的活性,阻止Myc向染色质稳定募集,使其不能促进多能干细胞形成以及驱动肿瘤发生。STAT3被认为在多种恶性肿瘤中发挥重要作用,靶向STAT3被认为是一种干预治疗途径,Chen等[13]实验证实槲皮素不仅从基因转录方面抑制STAT3 mRNA的表达,而且还能抑制Stat3蛋白激酶的活化,从而诱导宫颈癌细胞凋亡。AKT1是一种丝氨酸/苏氨酸蛋白激酶,活化的AKT1可以抑制细胞凋亡,促进细胞周期运行及细胞侵袭和转移,Liu等[14]发现环氧合酶-2抑制剂通过下调AKT1蛋白表达而抑制宫颈癌HeLa细胞增殖。但尚未见到槲皮素可否通过AKT1作用于宫颈癌的相关报道,本文分子对接为进一步探寻槲皮素抗宫颈癌机制提供了线索。
KEGG分析发现槲皮素靶点主要富集在p53信号通路、Apoptosis通路、PI3K-Akt信号通路、Jak-STAT 信号通路等。其中富集因子最大的p53信号通路作用广泛,涉及细胞周期、细胞凋亡、肿瘤血管生成及转移抑制、DNA的修复及损伤防御等,Vidya等[15]证实槲皮素通过p53依赖机制,诱导宫颈癌HeLa细胞G2/M期阻滞及线粒体凋亡,以剂量依赖的方式抑制HeLa细胞存活。Xiang等[16]发现槲皮素可下调Pi3k、p-Akt及Bcl-2表达,上调Bax表达,通过PI3K-Akt信号通路诱导宫颈癌HeLa细胞凋亡。Luo等[17]发现槲皮素纳米颗粒通过抑制JAK2诱导宫颈癌细胞凋亡和自噬,抑制STAT3/5和PI3K/Akt信号通路,调控细胞周期蛋白D1和mTOR,抑制宫颈癌细胞增殖。肿瘤微环境(tumor microenvironment,TME)是一个高度复杂的综合动态系统,由肿瘤细胞、基质细胞和细胞外基质组成,具有低氧、营养缺乏、酸中毒、慢性炎症、免疫抑制,以及多种细胞因子产生等生物学特征,在抗癌药物耐药以及肿瘤复发、转移等方面具有重要作用。乏氧诱导因子(hypoxia- inducible factors,HIFs)、血管内皮生长因子(vascular epithelial growth factor,VEGF)等共同参与了肿瘤微环境形成及肿瘤血管生成。本研究发现槲皮素靶点还能显著富集在的HIF-1信号通路和VEGF信号通路上,实验[18]证实槲皮素可以靶向VEGFR-2,调控AKT/mTOR等下游信号通路,抑制肿瘤生长和血管形成。Hu等[19]则发现磷酸槲皮素可显著抑制活化成纤维细胞中wnt16的表达,诱导TME重构,发挥协同抗癌作用。
总之,本研究借助生物信息学相关技术与方法,系统研究了槲皮素抗宫颈癌靶点、生物过程、信号通路等,全面揭示了槲皮素多靶点、多通路、多机制抗宫颈癌的药理学作用。
