磁性硅酸钙复合除磷材料的制备及吸附机理
2020-03-16董怡然吕锡武彭丽红付志强
董怡然,吕锡武,彭丽红,付志强
(东南大学能源与环境学院,江苏南京 210096)
目前,由于大量含磷的农业非点源污染、食品加工等产生的工业废水和部分城市生活废水等流入水体,导致河流、湖泊中藻类大量生长,使得水体透明度、溶解氧降低,鱼类大量死亡,水体发臭,破坏生态系统,因此废水中磷的去除显得尤为重要[1]。目前,除磷的方法主要有化学沉淀法[2]、生物法[3-4]、结晶法[5-6]、吸附法[7]等。其中,化学沉淀法具有费用高、产物难处理的缺点;生物法效果不稳定[8],且条件控制要求较为严格;结晶法更适用于与含磷浓度较高的废水[9];而吸附法一方面适宜低浓度含磷废水中磷的去除,另一方面具有操作简单、吸附容量高、运行费用低等特点而受到广泛关注。对于吸附法,吸附材料是决定除磷性能高效低耗的关键因素,其中磁性纳米材料[10]和水化硅酸钙(CSH)[11]2类材料已成为当下研究热点。
纳米材料具有较大的比表面积、较高的活性与催化效率以及较多的表面活性位点等特点[12],而磁性纳米材料吸附活性高,比表面积大,具有独特的磁效应,吸附饱和后在外磁场的作用下能够迅速地实现固液分离[13]。但是,由于纳米颗粒粒径小,表面自由能大,在水中极易团聚形成更大的颗粒,减少了比表面积,影响吸附效果。具有多孔结构的水化硅酸钙材料在水中通过释放钙离子和氢氧根离子,在局部能够形成有利于磷酸钙结晶的环境,从而去除水中的磷[14]。但是,在应用过程中,部分形成的晶体较小,沉淀性能差,容易随水流走,未达到除磷的目的。因此,为了充分利用2种材料的优势及克服两者的不足,本文提出了一种高效稳定、具有快速磁分离特性的新型磁性硅酸钙复合材料(Fe3O4@CSH)。
1 材料与方法
1.1 试剂及材料
CaO含量高达98%以上的钙质原料,直径为10 μm、颗粒状的白炭黑(SiO2)作为硅质原料,Fe3O4纳米材料作为磁性材料。
以KH2PO4配置2 000 mg P/L的缓冲磷溶液,通过稀释100倍缓冲磷溶液获得20 mg P/L的模拟城镇污水厂厌氧池上清液废水。
1.2 试验设备
试验主要设备为WHF-0.25 L型强磁力搅拌静密封水热合成反应釜、分析天平、磁力搅拌器、分光光度计、烘箱、pH计、磁滞回线测试仪、电子扫描显微镜、X射线衍射仪和比表面积及孔径测试系统。
1.3 试验方法
1.3.1 影响因素试验设计
(1)Ca/Si摩尔比对Fe3O4@CSH制备的影响
将Fe3O4纳米材料、白炭黑和CaO按Fe3O4/SiO2摩尔比为1∶5和不同Ca/Si摩尔比(设为1.4、1.8、2.2、2.6∶1)进行配料,以固液质量比1∶30配制混合浆料。混匀后倒入反应釜中,在300 r/min的搅拌速率下逐渐升温至170 ℃,以90 r/min恒温恒速反应7 h进行水热合成反应。反应完成后自然冷却至室温,取出浆料进行磁分离,在70 ℃下真空干燥,即得到粉末状Fe3O4@CSH。取0.06 g投入100 mL浓度为20 mg P/L的磷溶液,在25 ℃、150 r/min的条件下恒温恒速反应24 h,磁分离后测上清液中磷的浓度。
(2)反应温度对Fe3O4@CSH制备的影响
反应温度设为130、150、170、190 ℃。
(3)反应时间对Fe3O4@CSH制备的影响
反应时间设为3、5、7、9 h。
(4)搅拌速率对Fe3O4@CSH制备的影响
搅拌速率设为30、90、150、210 r/min。
(5)多因素试验
根据正交表的设计方法,采用L16正交方法安排试验,正交试验因素水平如表1所示。利用极差法分析,确定合成材料过程中各因素对磷去除率的影响。

表1 正交试验因素水平表Tab.1 Factor Levels of Orthogonal Tests
1.3.2 磁分离特性试验
将吸附后的混合溶液(含吸附材料)装在20 mL的玻璃瓶中,利用外部磁场进行磁分离,考察最佳制备条件下合成的Fe3O4@CSH样品的磁分离特性;同时,对合成材料进行磁滞回线测试分析。
1.3.3 最优条件下制备的Fe3O4@CSH对不同浓度磷的吸附性能分析
取8个250 mL具塞锥形瓶,分别加入0.06 g的Fe3O4@CSH,加入100 mL不同浓度的磷溶液(20~55 mg/L),在25 ℃、150 r/min的条件下恒温恒速反应24 h,磁分离后测上清液中磷的浓度。
1.3.4 形貌表征及结构分析
取吸附前后的材料,利用扫描电镜(SEM)、比表面积及孔径测试系统和X射线衍射仪(XRD)进行形貌和结构分析。
1.4 分析方法
磷的去除率计算如式(1)。
(1)
其中:η——Fe3O4@CSH对磷酸根去除百分率;
C——处理前磷的浓度,mg/L;
Ce——处理后磷的浓度,mg/L。
单位吸附量计算如式(2)。
(2)
其中:M——Fe3O4@CSH的单位吸附量,mg/g;
V——溶液体积,L;
m——投加吸附材料的质量,g。
2 结果与讨论
2.1 不同制备条件对Fe3O4@CSH除磷性能的影响
2.1.1 Ca/Si摩尔比对制备的Fe3O4@CSH除磷性能的影响
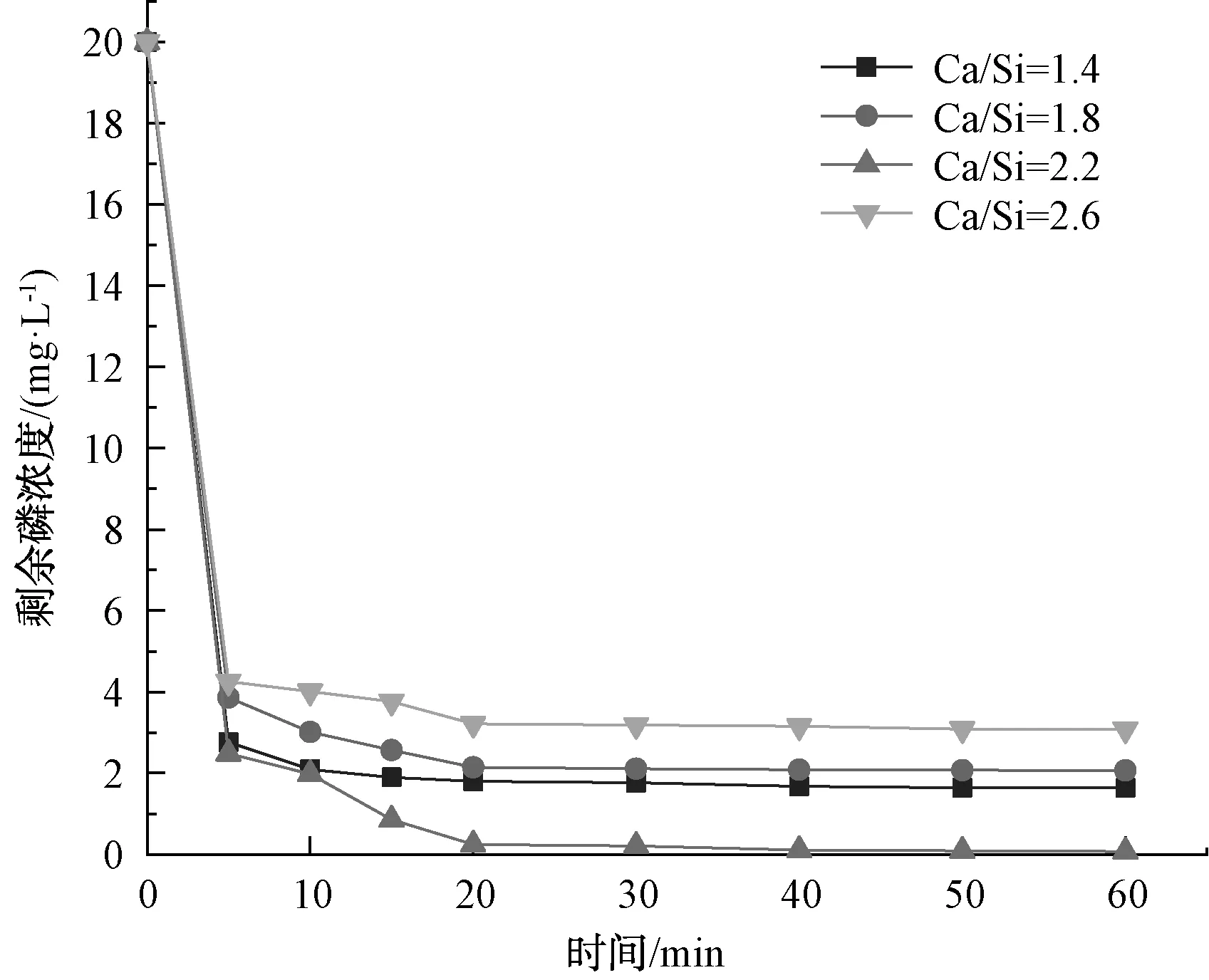
图1 Ca/Si摩尔比对制备的Fe3O4@CSH除磷性能的影响Fig.1 Effect of Ca/Si Molar Ratio on Phosphorus Removal Performance of Fe3O4@CSH Prepared
由图1可知,在0~5 min时,Fe3O4@CSH对磷的吸附速度最快,10~20 min时有少量的吸附,20 min后基本趋于稳定。随着钙硅比从1.4∶1逐渐增大至2.6∶1,除磷率分别为91.84%、89.67%、99.64%及84.62%,吸附容量分别为30.61、29.89、33.21、28.21 mg/g。由此可知,不同钙硅比条件下制得的Fe3O4@CSH除磷性能不同,这是由于不同钙硅比条件下合成的材料比表面积、孔结构及可溶性钙含量存在差别。He[15]研究表明,当Ca/Si在1∶1~1.7∶1时,随着钙硅比的增大,合成的材料从片状结构向长网状纤维变化,结构变得稀疏,增大了比表面积。当Ca/Si摩尔比为2.2∶1时,合成的材料除磷效果最佳。
2.1.2 反应温度对Fe3O4@CSH制备的影响
由图2可知,随着温度从130 ℃逐渐增大至190 ℃,除磷率分别为93.09%、96.88%、99.76%及98.62%,吸附容量分别为31.03、32.29、33.25、32.87 mg/g。由此可知,不同温度下制得的Fe3O4@CSH除磷性能不同,这是由于低温条件下生成的CSH中可能含有大量的雪硅钙石,而雪硅钙石的结构密度较大,最终合成的Fe3O4@CSH除磷效果较差。当温度升高至190 ℃时,CSH晶相生长完整,结构紧密,溶钙能力差,导致除磷效果降低。雷永胜等[16]研究发现,随着温度的提高,生成的产物结晶度逐渐增加,晶体尺寸变大,孔隙增大,增加了产物的比表面积,当反应温度升高时,结构变得紧密。在本试验中,反应温度为170 ℃时,合成的材料除磷效果最佳。
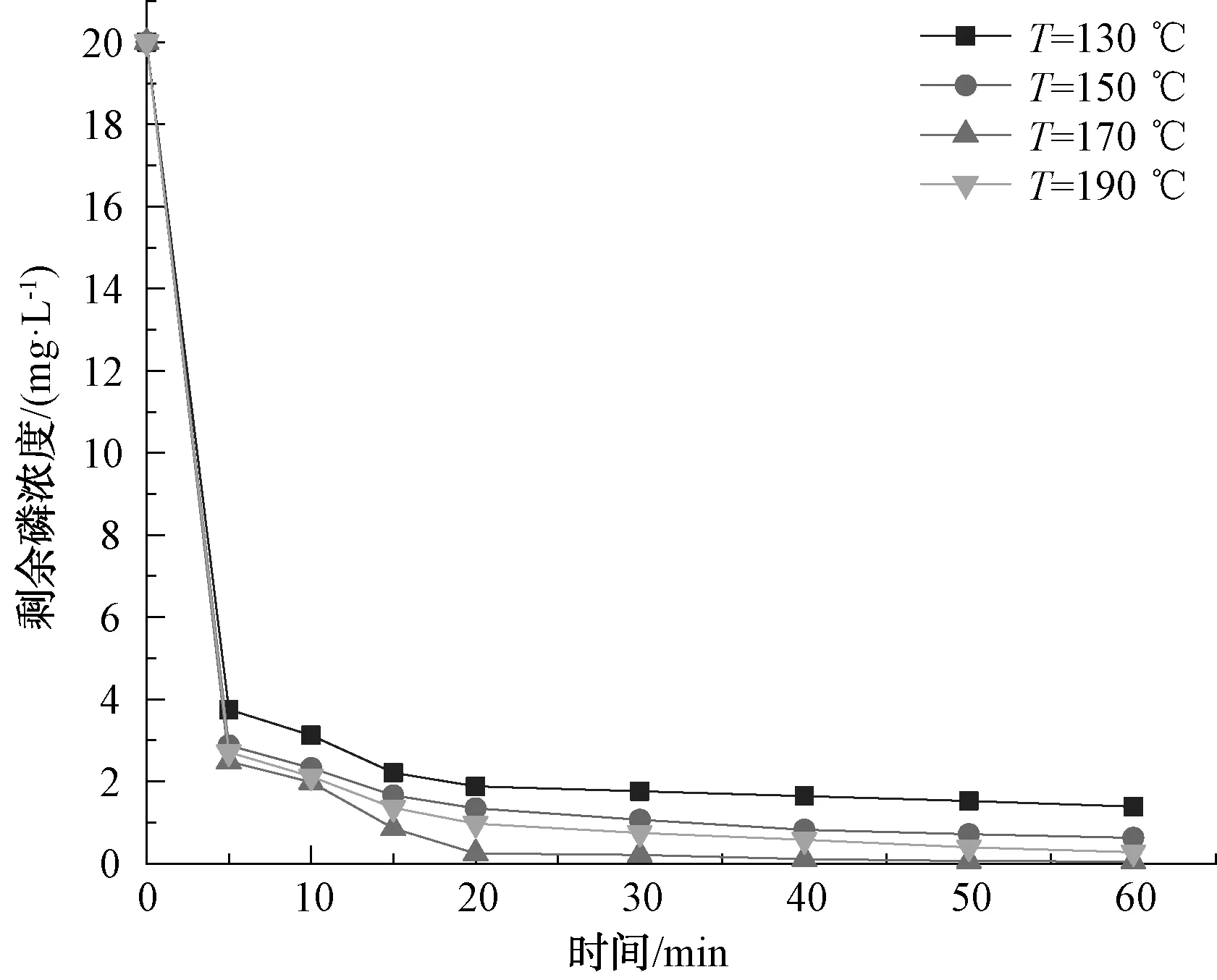
图2 反应温度对制备的Fe3O4@CSH除磷性能的影响Fig.2 Effect of Reaction Temperature on Phosphorus Removal Performance of Fe3O4@CSH Prepared
2.1.3 反应时间对Fe3O4@CSH制备的影响
由图3可知,随着反应时间从3 h逐渐增大至9 h,除磷率分别为93.39%、96.84%、99.67%及90.34%,吸附容量分别为31.13、32.28、33.22、30.11 mg/g。由此可知,不同反应时间下制得的Fe3O4@CSH除磷性能不同,这是由于反应时间较短时,氧化钙和白炭黑反应不够充分,最终合成的材料中仍含有CaO,因此溶钙能力强,除磷效果较好。当反应时间增加至7 h时,合成的材料具有一定多孔结构,比表面积增大,除磷效果逐渐增强。当反应时间达到9 h时,合成材料中CSH部分晶相结构越发紧密,溶钙能力变差,除磷效果降低[17]。因此,当反应时间为7 h时,合成的材料除磷效果最佳。

图3 反应时间对制备的Fe3O4@CSH除磷性能的影响Fig.3 Effect of Reaction Time on Phosphorus Removal Performance of Fe3O4@CSH Prepared
2.1.4 搅拌速率对Fe3O4@CSH制备的影响

图4 搅拌速率对制备的Fe3O4@CSH除磷性能的影响Fig.4 Effect of Stirring Rate on Phosphorus Removal Performance of Fe3O4@CSH Prepared
由图4可知,随着搅拌速度从30 r/min逐渐增大至210 r/min,除磷率分别为96.75%、99.74%、94.05%及93.35%,吸附容量分别为32.25、33.25、31.35、31.12 mg/g。由此可知,不同搅拌速率下制得的Fe3O4@CSH除磷性能不同,这是由于当搅拌速度较低时,合成的材料呈絮片形,不易生成球形颗粒,除磷效果较好。随着搅拌速度的增大,一方面溶液呈涡流状,所生成的剪切力越大,形成的球形颗粒体积越小,结构越紧密,另一方面溶液易形成局部过饱和度较高,生成更多晶体,所以除磷效果呈现先增加后降低的趋势,与袁俊生等[18]的研究结果相似。因此,当搅拌速度为90 r/min时,合成的材料除磷效果最佳。
2.1.5 多因素试验
根据表2中极差R能够发现,影响合成材料吸附磷的效果的主次顺序为:Ca/Si摩尔比>反应温度>反应时间>搅拌速率,即Ca/Si摩尔比为主要影响因素。通过K值能够得出最佳制备条件组合:Ca/Si摩尔比为2.2∶1、反应温度为170 ℃、反应时间为7 h、搅拌速率为90 r/min。该试验结果与单因素影响试验所得结果相同。

表2 磷去除率的正交试验结果Tab.2 Orthogonal Test Results of Phosphorus Removal Rate
注:K为某一因素各水平磷去除率的平均值,极差R为某一因素K的最大值与最小值之差
2.2 磁分离特性试验
在外磁场的作用下,1 min内能够实现固液分离。图5为Fe3O4@CSH的磁滞回线图,由图5可知,Fe3O4和Fe3O4@CSH均表现出顺磁性,Fe3O4的饱和磁化强度为82.6 emu/g。当在Fe3O4磁核外面包覆CSH时,合成材料较Fe3O4磁性含量降低,合成材料的饱和磁化强度降为15.2 emu/g。虽然合成材料的饱和磁化强度降低,但仍具有较强的磁性,易于分离[19]。
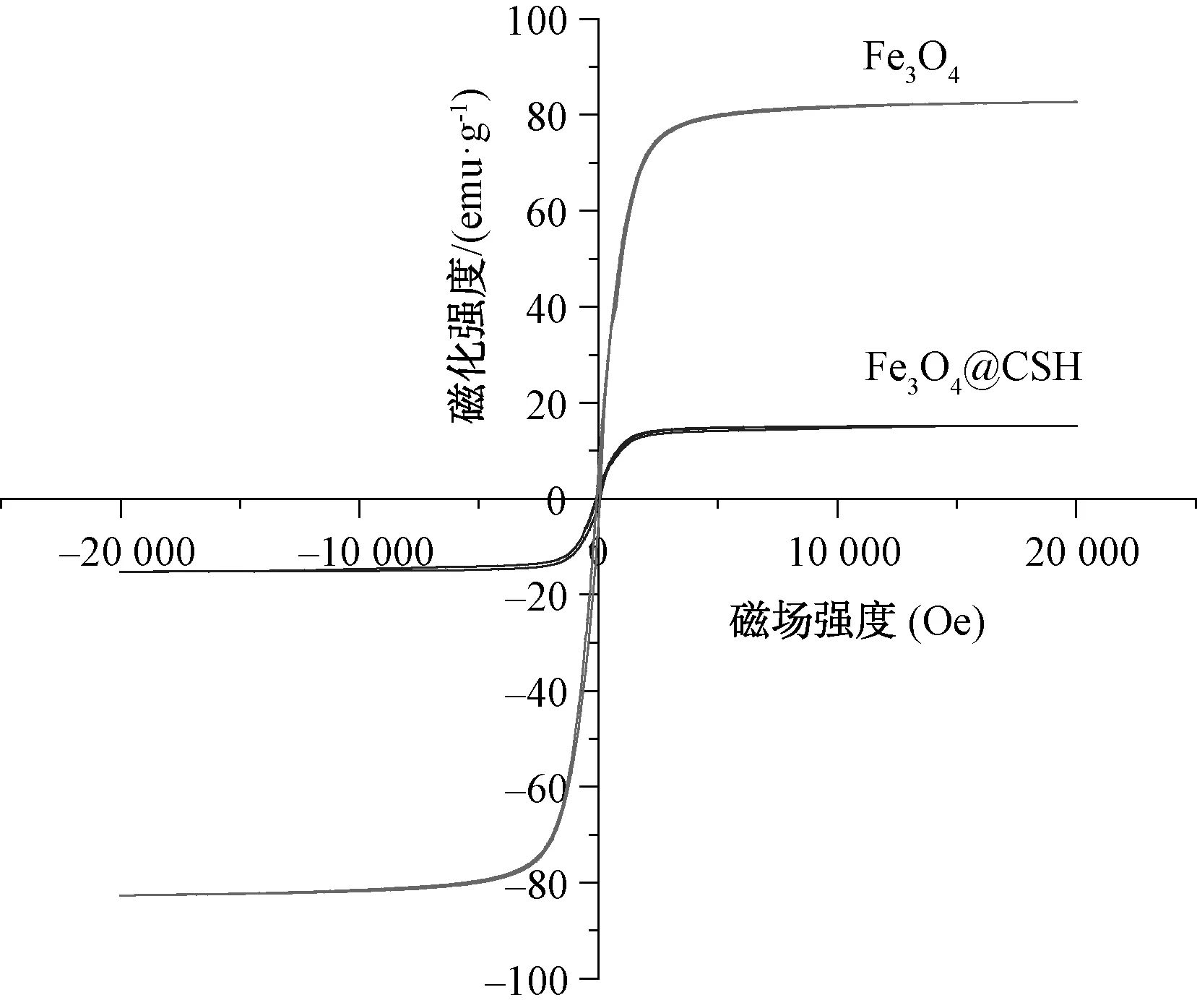
图5 磁分离特性曲线Fig.5 Magnetic Separation Characteristic Curve
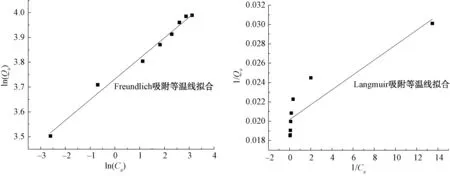
图7 Fe3O4@CSH吸附水中磷等温吸附曲线Fig.7 Isothermal Adsorption Curve of Phosphorus in Water by Fe3O4@CSH
2.3 最优条件下制备的Fe3O4@CSH对不同浓度磷的吸附性能分析
用最优条件下制备的Fe3O4@CSH对不同浓度的含磷溶液进行吸附试验,投加吸附材料为0.06 g,吸附时间为24 h,结果如图6所示。结果表明,在一定投加量下,随着初始磷浓度的增加,平衡浓度增加幅度提高,吸附量增加幅度降低。这是由于在低浓度下吸附剂具有较多活性位点,能够大量吸附磷,随着浓度的增加,吸附剂逐渐饱和,同时也没有投加新的吸附剂,因而产生上述现象。
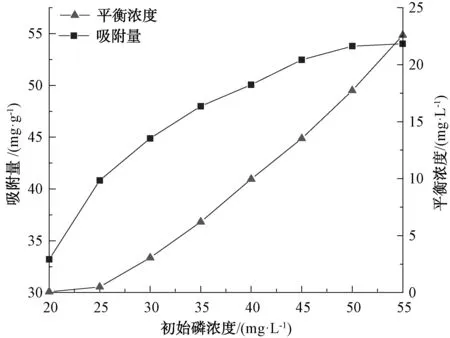
图6 不同初始磷浓度下Fe3O4@CSH吸附量 及磷的平衡浓度Fig.6 Adsorption Capacity of Fe3O4@CSH and Equilibrium Concentration of Phosphorus under Different Initial Phosphorus Concentrations
对不同浓度磷的吸附试验结果采用Freundlich吸附等温线和Langmuir吸附等温线拟合(图7),其线型方程分别如式(3)和式(4)。
(3)
(4)
由图7及表3可知,Freundlich等温线拟合的相关性比Langmuir等温线更好,这说明该材料的吸附并不仅仅是单层吸附,其吸附过程由多种机理组成,为多层吸附。利用Langmuir等温式估算得最大吸附量为49.5 mg/g,其值大于其他磁性复合材料,例如Fe3O4@SiO2(12.90 mg/g)[20],其主要原因为CSH相比SiO2具有更大的比表面积。李艳等[21]研究发现,磁性纳米Fe3O4对磷的吸附量为5.19 mg/g,由此可见,磁性纳米Fe3O4对磷也有一定吸附作用,但其主要起到的作用还是快速分离。根据Freundlich等温式特征值1/n<0.1,KF较大,表明该吸附材料易于吸附水中的磷。

表3 Fe3O4@CSH吸附水中磷等温拟合直线Tab.3 Isothermal Fitting Line of Phosphorus Adsorption in Water by Fe3O4@CSH

图9 Fe3O4纳米材料及合成材料吸附前后的XRD图Fig.9 XRD Diagrams of Fe3O4 Nanomaterials and Synthetic Materials before and after Adsorption
2.4 形貌表征及结构分析
图8为Fe3O4纳米材料及合成材料吸附前后的SEM图。由图8(a)可知, Fe3O4纳米材料约为200 nm,呈球形,粒径大小较为接近,但是颗粒的团聚现象比较明显,分散性不足。由图8(b)可知,制备后的Fe3O4@CSH颗粒粒径明显增大,约为400 nm,这也表明了硅质材料和钙质材料成功包覆Fe3O4纳米材料。通过对Fe3O4@CSH进行微全孔分析,发现材料的比表面积较CSH有所下降,由77.1 m2/g降至66.8 m2/g,这是由于合成材料粒径变大以及仍旧呈现的团聚现象,使其比表面积有所下降,但降幅不大,对磷的吸附效果显著。在实际的生物除磷系统中,制备的Fe3O4@CSH主要以粉末的形式分散于含磷废水,为防止由于材料颗粒较小而被水流冲走,进而堵塞反应器管道,需要根据实际情况设计磁分离器和反应器的构型。图8(c)为吸附后材料的电镜图,原材料已被无定形絮状物裹覆。

图8 Fe3O4纳米材料及合成材料吸附前后的SEM图 (a) Fe3O4纳米材料; (b) 吸附前;(c)吸附后Fig.8 SEM Diagrams of Fe3O4 Nanomaterials and Synthetic Materials before and after Adsorption (a) Fe3O4 Nanomaterials; (b) before Adsorption;(c) after Adsorption
图9为Fe3O4纳米材料及合成材料吸附前后的XRD图。由图9(a)可知,其中2θ角35.2°(220)、41.5°(311)、50.6°(400)、63.1°(422)、67.4°(511)以及74.3°(440)这些主要衍射峰所在的位置及大小与标准卡片(PDF#76-0956)较为吻合,杂峰少表明Fe3O4纳米材料纯度较高。由图9(b)可知,Fe3O4的特征峰仍旧存在,但特征峰减弱,说明Fe3O4纳米材料表明确实覆盖了钙质材料和硅质材料,使其结晶度降低。此外,还出现了Ca(OH)2、CaCO3、SiO2这几种物质的特征峰,证明硅质材料和钙质材料已包裹Fe3O4纳米材料。吸附后Ca(OH)2特征峰大为减弱,而其余峰变化不大,可能是Ca(OH)2为吸附磷提供了Ca2+和OH-,该材料具有较好的溶钙供碱能力。吸附后材料XRD图谱没有显示含磷相关物质的特征峰,再次证明了吸附后材料表面是无定形物质,根据文献报道[22],其主要成分可能为CaHPO4。除磷后的Fe3O4@CSH中磷含量较高,可以考虑两种可能的处理途径:一是采用气水反冲洗或酸冲洗的方法对其进行洗脱再生;二是将表面附有CaHPO4的Fe3O4@CSH直接用作磷铁矿,进而用作工业中磷化肥的生产原料。具体采取哪种方法还需要进一步的评估论证。
3 结论
(1)在Ca/Si摩尔比为2.2∶1、反应温度为170 ℃、搅拌速率为90 r/min的条件下,恒温反应7 h进行水热合成,此时合成的材料吸附磷的效果最好。在磷的初始浓度为20 mg/L时,磷的去除率能够达到90%以上,吸附容量可达30 mg/g以上。
(2)新型磁性硅酸钙复合材料具有顺磁性,其饱和磁化强度为15.2 emu/g,具有较强的磁性,易于分离。
(3)对新型磁性硅酸钙复合材料的磷吸附进行吸附等温线拟合,结果表明Freundlich等温模型具有较好的相关性,该材料吸附水中的磷是易于发生的多层吸附。
(4)根据SEM和XRD分析,Fe3O4@CSH材料呈球形态,结晶性较好,具有较大的比表面积,该材料有良好的溶钙供碱能力。
(5)Fe3O4@CSH同时具备了磁性纳米材料独特的磁效应以及CSH的吸附量大的特点,能够很好地克服传统吸附材料不易分离、吸附容量小的问题,为吸附剂材料的选取初步探索了一条新的道路。但Fe3O4@CSH除磷材料的再生利用及在实际污水处理工程中的应用还需进一步的探讨研究。
