紫外消毒剂量计算及其对水质指标的影响
2020-03-16孙志民
周 娜,孙志民,卢 静
(1.中北大学环境与安全工程学院,山西太原 030000;2.广州市市政工程设计研究总院有限公司,广东广州 510060)
如今,全球很多国家对供水系统安全问题给予了高度关注[1]。尤其是近些年我国城镇化建设速度显著加快,人们对于饮用水的消耗增加,这就需要对消毒技术进行不断的优化和完善,以适应当前的社会形势。常用的消毒技术有很多种,包括氯气消毒、臭氧消毒等。紫外线技术作为一种物理消毒技术不会对最终水体带来二次污染,因此,在当前的水处理领域受到重视。相关学者也基于紫外线消毒属性,对其消毒工艺的应用模式展开研究,同时分析该项技术对控制水质微生物的重要作用。对紫外线灭活水中的病原微生物已进行了多次研究,但是关于紫外线消毒管网生物安全性的研究尚处于起步阶段。紫外线消毒管网生物安全性同样不可忽视,供水管网中的有毒病原体如果不能得到很好的控制和处理,同样会给整个城市的供水系统带来巨大的危害。在供水管网中进行紫外线消毒饮用水处理存在一个关键问题,即在运营管网内部并不能产生持续的消毒作用,这必然会对管网水质安全性带来不利影响,需要进行深入探究[2]。
为了能够保证管网水质的安全性,需要显著增强饮用水生物稳定水平,而提升该稳定性的关键就是要对给水管网中的相关有机营养物含量给予控制[3]。对该生物稳定性进行标价的指标分别为AOC与BDOC,前者对应的是可同化有机碳(assimilable organic carbon,AOC),后者为生物可降解溶解性有机碳(biodegradable dissolved organic carbon,BDOC)。通过相应的水处理工艺对这两个指标浓度进行控制,就能很好地减少微生物在相应管网中的再生能力,进而有效地增强相应微生物的控制效果[4]。在这两项指标中,构成BDOC的有机物分子量相对较大,而构成AOC的有机分子量较小,一般小于1 000[5-6],容易被生物所利用。在本次研究中,对于管网而言,衡量其营养物质的指标使用的是AOC和TOC[7]。
在饮用水管网通道中,微生物的再生长与AOC指标关系密切[8],海内外很多学者也就此进行了深入分析。Camper等[9]在研究中指出,紫外线若是所处消毒计量范围在正常区间,就不会对水物理化学属性进行改变,水体中可生物降解有机体浓度就不会增长。目前,有关紫外线对AOC影响的研究也对该结论进行了验证。Kashinkunti等[10]的研究表明,研究剂量在0~50 mJ/cm2时,其中的AOC浓度指标并不会产生明显的改变。Miettinen等[11]在研究中指出,若是剂量控制在15~50 mJ/cm2时,相应的AOC浓度降低较少。多年来,人们对饮用水管网水中微生物的生长与管网水中AOC的关系进行了多次研究。但是,由于试验条件具有差异性,且紫外线剂量的确定方法缺乏相应标准,使得相关研究人员很难得到准确结论。
本次试验通过利用软件模拟和试验相结合的手段,详细探究了紫外消毒技术对管网水中AOC、TOC的影响。此次试验首先创建相应的紫外消毒CFD模型,然后借助流体力学数值模拟技术,对此模型的UV剂量进行计算;基于确定的UV剂量开展饮用水UV消毒试验,研究UV饮用水消毒前后主要水质指标的变化,探讨其对不同UV剂量的响应以确定最佳方案,评估饮用水安全风险。
1 紫外线剂量计算
1.1 UV消毒模型的建立

图1 UV消毒反应器Fig.1 UV Disinfection Reactor
本研究采用304不锈钢自制腔体式UV消毒反应器装置,具体实物如图1(a)所示。为了对该反应装置内部流场信息进行更为准确的展现,需创建相应的三维模型,并对其进行数值模拟研究。对几何外形进行准确描述可以显著提升计算精度,这也是当前极为重要的一个前提要件。然而,具体结构往往有着复杂的几何外形,对其进行准确描述,有着较高的困难度。为此,在确保计算结果的前提下,需在网格细分环节注意相应网格尺度存在的较大不同。另外,研究还对其中的一些实体结构进行了简化。此外,几何实体简化水平和数值模拟计算所需时间有着紧密关联,对实体处理若是越简单,那么相应的计算量就会越小。
1.2 模型边界条件
对下面的边界条件进行相应设置。
(1)速度进口边界(velocity-inlet):对于进液口,可将其用速度输入来进行定义,即相应液体按照具体速度沿着与管径轴向具有平行关系的方向置入管道,此时的流速为1~2 m/s。
(2)模型内的灯管设置如表1所示,试验设定4组灯管的边界条件,分别为适当UV剂量(adequate dose,AT)、中等UV剂量(medium dose,MTA和MTB)、高剂量(high dose,HT)。

表 1 UV反应器模型的灯管设置Tab.1 Setup of UV Lamp in UV Disinfection Reactor Model
(3)自由出流边界(outflow):主要展现在模拟前难以知晓的出口速度,包括相应的压力。该出口流动需要满足发展条件,且在此区域除了相应压力还涉及到相应的参量梯度,需将其设为0。
(4)固壁边界条件(wall):将管道上各种管壁设定为静止无滑移条件(no-slip wall),此时和它进行接触的流体在相对速度上要维持零值,同时还需确保和周边不会产生能量与物质方面的交换。
1.3 网格划分及湍流模型
本文将紫外线消毒反应器模型总网格数划分约为210万个(图2)。湍流模型采用k-ε模型,假定流体流动是充分发展的完全湍流运动。

图2 模型网格Fig.2 Model Mesh of UV Disinfection Reactor Model
1.4 UV剂量的计算
该消毒装置的消毒效果与UV剂量有着显著的关联性[12]。对于剂量的定义和计算,美国环保总局(USEPA)在2006年成功推出了相应的紫外设计手册(USEPA),其中使用紫外线强度,对应单位为(mW/cm2)和需要处理的流体或者离子在该环境下的曝光时间的乘积,就是所谓的UV剂量,该时间使用s表示,如式(1)。
D=I×t
(1)
其中:D——紫外线剂量,mJ/cm2或mW·s/cm2;
I——紫外线光强,mW/cm2。
在这个连续体的反应装置中,微生物将会伴随水流进行动态运动,且反应装置的光强分布本身具有非均匀性。同时,不同微生物运动路径亦有明显差异,对应水力停留用时存在着差异,所接收到的紫外线剂量也会存在着差异。若是获取微生物所接受的总剂量,就需要假定各种微生物都是通过一定数量微生物团构成,借助CFD对不同微生物团的灭活效率进行模拟计算,进而获取反应装置的总灭活效率,同时得出该反应装置的有效平均剂量,如式(2)。
(2)
微生物灭活率与UV剂量存在以下关系,如式(3)。
F=A×lg(N/N0)+B
(3)
其中:F——UV剂量,mJ/cm2或mW·s/cm2;
A,B——消毒动力学参数,通过平行光试验测得。
若是反应装置出口区域每个微生物微团都会接受相应的UV剂量,即可计算它的灭活率,具体叠加如式(4)。
(4)
其中:Fi——出口区域每个微团微生物收取到的紫外剂量,mJ/cm2;T——微团总数。
该反应装置的有效平均剂量计算如式(5)。
UV剂量=-A×log[(N/N0)total]+B
(5)
根据有效剂量计算式(2)和式(3),得到反应器AT、MTA、MTB和HT条件下的UV平均剂量(图3和图4),运算结果汇总如表2所示。
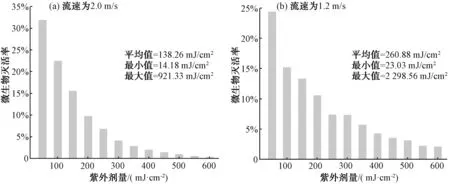
图3 3支40 W灯管,流速为2.0 m/s和1.2 m/s条件下,模型的UV平均剂量Fig.3 Average UV Dose of Three 40 W Lamps Model at Influent Flow Rate of 2.0 m/s and 1.2 m/s

图4 3支120 W灯管,流速为1.5 m/s和1.0 m/s条件下,模型的UV平均剂量Fig.4 Average UV Dose of Three 120 W Lamps Model at Influent Flow Rate of 1.5 m/s and 1.0 m/s
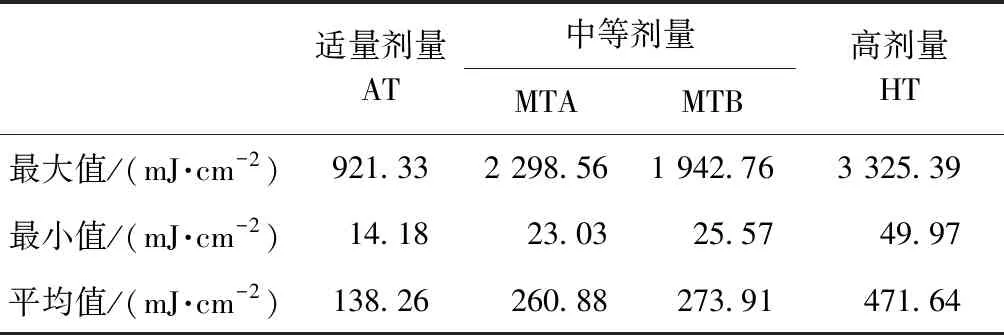
表2 UV剂量统计结果Tab.2 Results of UV Dose
2 水样的采集与检测
2.1 水处理工艺流程
本试验水样取自广州市某水厂原水。本试验以该水厂的原水作为水源,采用常规处理(混凝、沉淀、砂滤)+ UV消毒,主要工艺流程如图 5所示。

图5 水处理工艺流程Fig.5 Process Flow Chart of Water Treatment Plant
2.2 水样采集和培养流程
UV消毒试验用水取自砂滤出水,水质如表3所示。本试验用水取自UV消毒出水。分别采集适当UV剂量(AT)、中等剂量1(MTA)、中等剂量2(MTB)和高剂量(HT)这4个UV消毒条件的出水水样。取样装入经消毒无菌处理的棕色玻璃瓶,并将防菌膜盖密封并固定在瓶口,防止空气中的微生物干扰UV消毒出水。具体采集和培养流程如图6所示,采集砂滤出水作为未经UV消毒处理的原始样本C0,经UV消毒处理的样本则作为T0。样本T0置于19 ℃遮光恒温培养箱中,以培养24 h(1 d)作为样本T1,以培养48 h(2 d)作为样本T2。样本信息汇总如表4所示。

表3 砂滤出水水质参数Tab.3 Parameters of Sand Filter Effluent

图6 UV消毒出水样本培养流程Fig.6 Samples Culture Process of UV Disinfection Effluent
2.3 水样预处理
为了对水样中相关AOC、DOM和TOC等指标浓度进行检测,需将水样通过截留孔为0.45 μm的过滤膜,并对其进行相应过滤[13-14],将其中的非溶解性有机物进行滤除。当水样采集到相应实验室后对其进行过滤,并最大限度地确保水样不会变质。该过滤膜为0.45 μm醋酸纤维滤膜,其直径为50 mm,借助砂芯过滤装置以及相应的真空隔膜泵对其进行抽滤。随后,可将水样配置在四氟乙烯瓶体中,将其置于4 ℃冰箱中,延缓其水质变化。在水样处理后,进行后续检测分析。
表4样本信息汇总表
Tab.4 Summary of Samples Information

2.4 水样检测
2.4.1 三维荧光光谱(3D-EEM)测定
为了分析水样中DOM,试验采用三维荧光光谱(3D-EEM)对其变化特征进行相应分析。相应试验测量设备选用三维荧光分光光度计,型号为F97 pro(上海)。在具体分析过程中,设置激发/发射波长为200~600 nm,激发带宽为10 nm,扫描速度为6 000 nm/min,激发和发射波长分辨率分别设为10 nm和1 nm,PTM电压值设为500 V。借助该测量设备检测到的光谱数据以及Matlab 2012b系统编绘形影的光谱等高线图,测得的三维荧光光谱矩阵完全可以借助该系统进行分析。将检测到的数据减去空白水样拉曼峰数值,并将该峰对数据带来的偏差进行减弱。最后,借助N-way Toolbo工具对水样中三维荧光数据展开PARAFAC模型分析。
2.4.2 AOC含量测定
本节采用先后接种法[15-16]对AOC指标进行检测,该菌种由广东省微生物所提供,在6 ℃冰箱环境中,使用LLA斜面进行纯种保存。
(1)接种液的准备
在此斜面分别选P17以及NOX菌种,配置一环置入到50 mL的乙酸钠溶液中,浓度为2 mg乙酸碳/L。接着,在25 ℃培养暗箱中培养,直至平台期。随后,将菌种去除并进行平板计算,得到相应的接种液浓度。最后,按照该浓度对需要加入至水样中的接种液体积进行计算,如式(6),该接种浓度为10 000 CFU/mL,而相应的接种液在6 ℃环境中进行保存。

(6)
(2)待测水样的预处理
将相关水样采集到50 mL取样瓶中,水中的余氯可以使用适量硫代硫酸钠进行中和。将水样置于恒温水浴锅中进行巴氏消毒,用时0.5 h,温度在60~70 ℃后测定。
(3)水样的接种与培养
当水样在常温态时,可对水样展开接种,而P17与NOX菌种接种浓度为10 000 CFU/mL,对应的接种液体积需要按照式(6)进行处理。在25 ℃相应生化培养箱中,可将冷却接种的水样加以静置培养,菌落处于平板后进行完全生长,到了稳定期即可展开平板计数,通常所需时间为3 d。
(4)细菌的平板计数
提取1 mL均匀的培养液,注入9 mL灭菌水中,存储于试管,并将其稀释成5个梯度,10-3~10-5这3个梯度的稀释液进行平板涂布,之后将平板置于25 ℃生化培养箱中培养计数。
(5)测定精度的控制
测试环节涉及到的相关操作环境有着显著差异,为此产率系数与空白对照数值就会存在着不同,进而使测试结果产生显著改变。因此,需开展产率系数与空白对照的试验,对该产率系数等要素带来的试验误差进行明确。基于100 μg乙酸碳/L的乙酸钠溶液和无碳水按待测水样方法进行测试。
(6)产率系数与 AOC
产率系数与AOC的计算如式(7)~式(11)。

(7)

(8)
(9)
(10)
水样总AOC(μg乙酸碳/L)=AOC-P17+AOC-NOX
(11)
2.4.3 TOC含量测定
TOC含量的测定均参照国家检测标准(GB/T 5750—2006),水样预处理后,采用总有机碳分析仪(岛津公司)进行测定[17]。
3 结果分析
3.1 不同UV剂量下样品AOC的变化

图7 不同UV剂量下UV消毒出水的AOC浓度变化Fig.7 Concentration of AOC in UV Disinfection Effluent under Different UV Dose
如图7所示,样本AT的AOC浓度均值为87.8 μg/L,较样本f-0的AOC浓度(约100 μg/L)下降13%,可能是适当UV剂量(AT)的UV紫外光能量将较小部分的小分子有机物氧化,但不能将大分子有机物进行破碎分解。比较检测4种不同UV剂量下UV消毒反应器出水的即时AOC浓度,即图7中AT-0(138.26 mJ/cm2),MTA-0(260.88 mJ/cm2),MTB-0(273.91 mJ/cm2)和HT-0(471.61 mJ/cm2),出水AOC浓度随UV剂量的增加而增大。研究[17-18]指出,在具体常规剂量下,紫外线对有机物结构有着较小的影响,不会带来水体中AOC浓度的显著改变,但在高UV剂量条件下,水体中含-COOH键等有机物质在紫外线催化下,会形成相应的羟基自由基[13],然后和水体中相关有机物进行反应,进而使AOC浓度开始有了显著改变。
3.2 不同UV剂量下样品TOC的变化
另一方面,样本AT-0、MTA-0和MTB-0的TOC浓度均值接近于f-0的TOC浓度(约180 μg/L)(图8),代表适当剂量和中等剂量的UV光能(138.26~273.91 mJ/cm2),MTB(273.91 mJ/cm2)的UV剂量未能有效降解水中的TOC。样本HT的TOC浓度均值约为134 μg/L,较样本f-0的TOC浓度减少了约25%,代表高UV剂量(471.61 mJ/cm2)可分解水中的有机物。
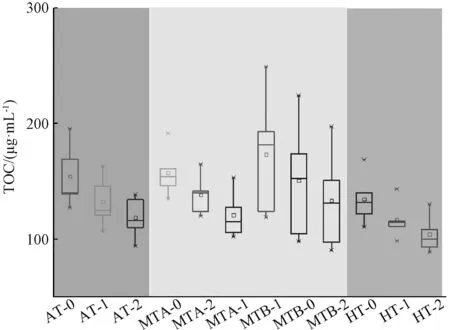
图8 不同UV剂量下UV消毒出水的TOC浓度变化Fig.8 Concentration of TOC in UV Disinfection Effluent under Different UV Dose
结合AOC浓度和TOC浓度变化(图7和图8),样本AT-0、MTA-0、MTB-0和HT-0中AOC均值与TOC均值的比例分别为57.3%、70.9%、58.2%和90.4%,代表高UV剂量在降低TOC浓度的同时,将大分子有机物分解为小分子有机物,从而增大了AOC占TOC的相对比例。中高强度的UV剂量会增加水中的AOC浓度,可将水中大分子有机物进行分解,进而可被微生物利用。
3.3 不同UV剂量下样品三维荧光图谱的变化

图9 滤池出水(f-0)的三维荧光图谱Fig.9 3D-EEM of Sand Filter Effluent (f-0)
根据样本的三维荧光图谱(图9和图10)定性分析样本的有机物种类。样本f-0中存在类腐殖荧光(A区,激发波长Ex为350~440 nm,发射波长Em为370~510 nm)、富里酸荧光(B区,激发波长Ex为310~360 nm,发射波长Em为370~450 nm)、类蛋白荧光(C区,激发波长Ex为240~270 nm;发射波长Em为300~350 nm)和富里酸荧光(D区,激发波长Ex为240~270 nm;发射波长Em为370~440 nm)等指纹特征。经138.26 mJ/cm2UV辐照后,样本AT-0的类腐殖荧光(A区)和富里酸荧光(B区)指纹明显减少。随着将UV提升至中等UV剂量(260.88~273.91 mJ/cm2),类腐殖荧光(A区)和富里酸荧光(B区)指纹继续减少的同时,样本MTA-0和MTB-0的类蛋白荧光(C区)和富里酸荧光(D区)指纹较AT-0亦开始减少。其中,在相近的UV剂量条件下,MTB的类蛋白荧光(C区)和富里酸荧光(D区)指纹少于MTA,代表类蛋白荧光(C区)和富里酸荧光(D区)指纹对高功率短停留时间(MTB)更敏感。将UV提升至高UV剂量(471.68 mJ/cm2),相较于MTB-0,HT-0中的类蛋白荧光(C区)指纹开始减少,但富里酸荧光(B区和D区)指纹反而有所增加,代表类蛋白有机物对高功率长停留时间更敏感,但与此同时,大分子有机物在此条件下被分解为分子量相对小的富里酸有机物。
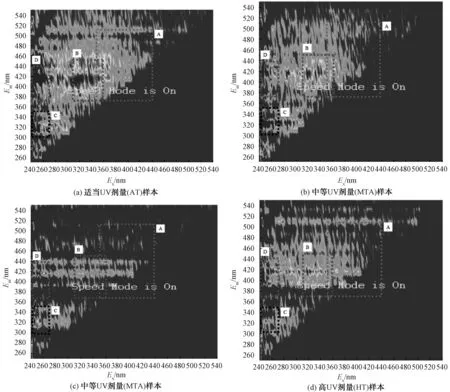
图10 不同UV剂量处理后样本的三维荧光图谱Fig.10 3D-EEM of Treated with Different UV Doses
4 结论
本文通过建立基于计算流体力学数值模拟技术CFD模拟的紫外消毒反应器模,求解紫外消毒反应器在不同灯管设置和不同进水流速下的UV平均剂量,探究不同紫外辐射剂量条件下出水水质的变化情况,结论如下。
(1)紫外消毒反应器模型中光强分布不均匀,灯管之间的区域紫外线强度比较高,最高紫外剂量区域在灯管壁四周,最低紫外剂量区域出现在反应器壁附近。4种试验条件下(AT、MTA、MTB和HT)的UV光强基本一致,其原因可能在于反应器单位体积内的液体所接受的UV光强已达到光饱和的状态。低压UV灯辐射之下达到一定光强后,更换高功率的UV灯不能提高液体媒介所接受的UV光强。
(2)基于UV光强采用Fluent软件通过UDF文件将光强分布导入模型中,计算得AT条件下UV平均剂量为138.26 mJ/cm2、MTA条件下UV平均剂量为260.88 mJ/cm2、MTB条件下UV平均剂量为273.91 mJ/cm2、HT条件下UV平均剂量为471.64 mJ/cm2。
(3)高UV剂量(471.61 mJ/cm2)可分解水中的有机物,降低出水TOC;高UV剂量在降低TOC浓度的同时,可将大分子有机物分解为小分子有机物,从而增大AOC占TOC的相对比例。
(4)UV出水AOC浓度随UV剂量增加[由适量(138.26 mJ/cm2),中等(260.88 mJ/cm2),高剂量(471.64 mJ/cm2)]的趋势走向是增大的。若是紫外线计量在常规下,它对有机物结构带来较小的影响,不会使水体中AOC浓度产生明显改变。但在高UV剂量条件下,水体中相关物质在紫外线催化之下就会形成羟基自由基,进而和水体中有机物进行反应,使得AOC浓度相应增加。
(5)三维荧光光谱图显示,类腐殖质类有机物和类蛋白质类有机物对UV辐射附着较为敏感, 增加UV剂量可降低该种大分子量的有机物;当将UV提升至高UV剂量(471.68 mJ/cm2),大分子有机物在此条件下被分解为分子量相对小的富里酸有机物,富里酸荧光(B区和D区)指纹有所增加。
(6)当UV剂量达471.68 mJ/cm2时,在同等强度的UV光强下,较长的停留时间令更多的大分子量有机物分解为分子量相对小且可被微生物吸收利用的富里酸有机物,从而增加了饮用水水质的微生物风险。因此,建议生活饮用水UV消毒,应采用剂量MTB 为273.91 mJ/cm2、短停留时间的方式,降低饮用水水质的微生物风险。
本文紫外消毒技术成本低,对用氯消毒污水(5 万t/d),需建有一个130 m×3 m的接触渠。采用UV消毒只需20 m×3 m的面积;且同等效果下,氯消毒会产生副产物,而紫外消毒不会产生副产物。因此,本技术在原有的技术水平上进行提升,可操作性强,为我国饮用水消毒技术的研究和发展提供了一定的理论意义和技术支持。
