和厚朴酚对2型糖尿病模型大鼠心肌缺血再灌注后心功能紊乱的影响及机制
2020-03-16孙加凤张雯雯符善姜
孙加凤,张 丽,裴 翔,张雯雯,符善姜,彭 兴
(三亚中心医院1.内分泌科,3.心血管内科,海南 三亚 572000;2.新疆医科大学第二附属医院内分泌科,新疆 乌鲁木齐 830001)
心肌缺血再灌注(myocardial ischemia reper⁃fusion,MI/R)损伤是一种常见的临床问题,尽管目前医疗手段已飞速发展和迅速推广,MI/R损伤引发的心肌损伤仍导致急性心肌梗死患者1年的临床死亡率接近10%[1]。研究表明,糖尿病患者通常死于与糖尿病相关的并发症,2型糖尿病(type 2 diabetes mellitus,DM)患者容易并发心血管疾病,约有超过60%的糖尿病患者死于心血管疾病[2]。糖尿病是心肌缺血的独立危险因素。许多流行病学数据和实验室研究表明,糖尿病显著加重了MI/R损伤[3]。因此探寻改善DM患者MI/R损伤的方法具有重要意义。
和厚朴酚(honokiol)是中药厚朴的新木脂素类成分。厚朴是一种传统中药,用于治疗各组血管疾病,包括缺血、心脏病和卒中[4]。已有研究表明,和厚朴酚通过减少氧化应激和炎症因子的释放对MI/R损伤具有保护作用[5],对DM KK/Upj-AY小鼠具有降血糖作用,及改善血脂紊乱导致的胰岛素抵抗的作用,且不诱导小鼠体质量增加[6]。然而目前还没有关于和厚朴酚对DM MI/R研究的报道,其作用机制尚不清楚。本文旨在探究和厚朴酚对大鼠DM MI/R后心功能紊乱、细胞凋亡及氧化应激的影响。
1 材料与方法
1.1 动物
50只SD大鼠,雄性,6周龄,体质量170~190 g,购自广东省医学动物实验中心,许可证号:SCXK(粤)2018-0002。置温控21~23℃和光控(200 lux,12 h光暗循环)的动物设施中常规饲养7 d。
1.2 药物、试剂和主要仪器
和厚朴酚(H4914,纯度≥98%)购自美国Sigma-Aldrich公司;苏木素-伊红染液(D006-1-1)、肌酸激酶同工酶MB(creatine kinase MB,CK-MB)检测试剂盒(E006-1-1)、肌红蛋白(myohemoglobin,Mb)检测试剂盒(H150)、总超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(A001-3-2)、丙二醛(malondialdehyde,MDA)检测试剂盒(A003-1-2)和谷胱甘肽(glutathione,GSH)检测试剂盒(A005-1-2)购自南京建成生物工程研究所;肌钙蛋白(cardiac troponin I,cTnI)检测试剂盒(ml001932)购自上海酶联生物科技有限公司;TUNEL细胞凋亡检测试剂盒(C1091)购自上海碧云天生物技术研究所;兔抗大鼠胱天蛋白酶3(ab13847)、兔抗大鼠活化的胱天蛋白酶3(ab2302)、兔抗大鼠Bax(ab53154)、兔抗大鼠Bcl-2(ab196495)、兔抗大c-Myc(ab39688)和兔抗大鼠β肌动蛋白(ab8227)单克隆抗体购自英国Abcam公司。彩色多普勒超声仪KR-S80购自德国西门子股份公司;DM2500荧光显微镜购自德国徕卡公司;Nano-Drop分光光度计和Multiskan™FC酶标仪购自赛默飞世尔科技公司;FluorChem HD2凝胶成像系统购自美国Proteinsimple公司。
1.3 实验分组和处理
将大鼠随机分为5组:正常对照组、DM MI/R模型组、DM MI/R+和厚朴酚(2.5,5.0和10.0 mg·kg-1)组,每组10只。除正常对照组外,其余各组参照祁秀茹等[7]方法建立DM MI/R模型。饲喂高糖高脂饲料联合ip给予链脲佐菌素30 mg·kg-1诱导建立DM大鼠模型。以血糖超过并稳定在>14 mmol·L-1为DM大鼠模型建立成功。在DM大鼠模型基础上,将大鼠用3.5%水合氯醛(0.35 mg·kg-1,ip)麻醉,仰卧位固定,四肢连接心电图电极,气管插管后连接小动物呼吸机。于大鼠左侧胸前第三、四肋间打开胸腔,暴露心脏,除正常对照组外,其余4组均结扎左心耳下缘2 mm处,观察大鼠心尖部颜色及心电图变化,当大鼠心脏呈青紫色、心尖部明显苍白、心电图显示ST段明显抬高且T波高耸说明结扎准确,心肌缺血模型制备成功。解除结扎,恢复心脏血供再灌注120 min,心脏表面颜色由青紫色逐渐恢复红色,心电图显示ST段逐渐压低且T波逐渐恢复则表明大鼠心肌缺血后成功恢复,并再灌注。造模中死亡大鼠通过随机原则补齐动物数并重新造模。DM MI/R+和厚朴酚组造模成功后ip给予和厚朴酚2.5,5.0和10.0 mg·kg-1,正常对照组和模型组ip给予等量生理盐水,每日1次,连续14 d。
1.4 超声心动图检测大鼠心功能
末次给药12 h后,ip给予10%水合氯醛(350 mg·kg-1)麻醉大鼠,左侧卧位,采用彩色多普勒超声仪检测大鼠心率(heart rate,HR)、左室短轴缩短率(fraction shortening,FS)、平均动脉压(mean arterial pressure,MAP)和左室射血分数(left ventricular ejection fraction,LVEF)。
1.5 ELISA检测大鼠血清中cTnl,Mb和CK-MB水平
末次给药12 h后,眼眶静脉丛采血,1 800×g离心10 min收集血清,-80℃保存。按照ELISA试剂盒说明书检测大鼠血清中cTnl,Mb和CK-MB水平。
1.6 试剂盒法检测大鼠血清中SOD,GSH和MDA含量
按照试剂盒说明书,采用酶标仪测定SOD含量,采用可见分光光度计测定MDA和GSH含量。
1.7 HE染色检测大鼠心肌组织病理损伤
处死大鼠后取心肌组织,PBS清洗后用4%多聚甲醛固定24 h,30%,50%和70%乙醇脱水,石蜡包埋切片,切片厚度2 μm。经HE染色后在荧光显微镜下观测组织病理变化。
1.8 TUNEL染色检测大鼠心肌细胞凋亡率
大鼠心肌组织切片用二甲苯浸洗2次脱蜡,每次5 min,梯度乙醇脱水。用蛋白酶K工作液在37℃封闭20 min,PBS清洗2次。在每个切片样本上滴加50 μL TUNEL反应液,37℃闭光反应60 min。用4,6-联脒-2-苯基吲哚(4′,6-diamidino-2-phenyl⁃indole,DAPI)复染10 min后荧光显微镜下观察。正常细胞颜色为蓝色,而心肌TUNEL阳性凋亡细胞为棕褐色。每只大鼠随机选取5张心肌组织切片进行计数,并计算细胞凋亡率。细胞凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.9 Western印迹法检测大鼠心肌组织胱天蛋白酶3、Bax、Bcl-2和c-Myc蛋白表达水平
处死各组大鼠后,取出心脏,用生理盐水洗净,剪取结扎处下方左冠状动脉前降支血流供应区心肌组织,匀浆提取蛋白,用BCA试剂盒测定蛋白质浓度。提取等量的蛋白质样品,在100℃条件下变性5 min。然后使用SDS-PAGE凝胶电泳法分离并转移至PVDF膜,室温封闭1 h,在4℃条件下分别加入抗胱天蛋白酶 3、Bax、Bcl-2、c-Myc抗体(1∶1000)并孵育过夜,清洗,然后在4℃下加入辣根过氧化物酶标记的二抗(1∶5000),孵育2 h,最后加入发光液,曝光处理。采用Image J软件分析,以β肌动蛋白为内参,用目标蛋白与内参蛋白积分吸光度值的比值表示目标蛋白的相对表达水平。
1.10 统计学分析
2 结果
2.1 和厚朴酚对DM MI/R模型大鼠HR,FS,MAP和LVEF的影响
全数字彩色多普勒超声诊断仪检测结果显示(图1),与正常对照组相比较,DM MI/R组HR,FS,MAP和LVEF显著降低(P<0.05);与DM MI/R组相比较,DM MI/R+和厚朴酚5.0和10.0 mg·kg-1组HR,FS,MAP和LVEF均显著升高(P<0.05)。
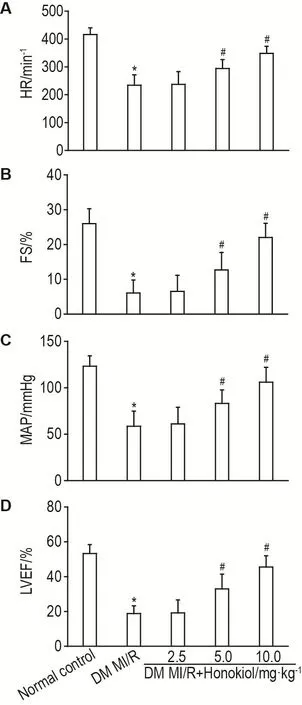
Fig.1 Effect of honokiol on heart rate(HR,A),fraction shortening(FS,B),mean arterial pressure(MAP,C)and left ventricular ejection fraction(LVEF,D)in myocar⁃dial ischemia reperfusion with type 2 diabetes mellitus(DM MI/R)model rats.The rat model of type 2 diabetes mellitus(DM)was induced by high sugar and high fat feed combined with ip streptozotocin 30 mg·kg-1and was considered estab⁃lished when blood glucose exceeded and became stabilized above 14 mmol·L-1.MI/R model was established by intermittently ligating the lower margin of left atrial appendage.Rats were randomly divided into control group,DM MI/R group,DM MI/R+honokiol(2.5,5.0 and 10.0 mg·kg-1)groups.Rats were ip honokiol 2.5,5.0 and 10.0 mg·kg-1(in drug group)or saline(in control and DM MI/R group)once a day for 14 d.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with DM MI/R group.1 mmHg=0.133 kPa.
2.2 和厚朴酚对DM MI/R模型大鼠血清cTnl,Mb和CK-MB水平的影响
ELISA检测结果(图2)显示,与正常对照组比较,DM MI/R组cTnl,Mb和CK-MB水平显著升高(P<0.05);与DM MI/R组比较,DM MI/R+和厚朴酚5.0和10.0 mg·kg-1组cTnl,Mb和CK-MB水平显著降低(P<0.05)。
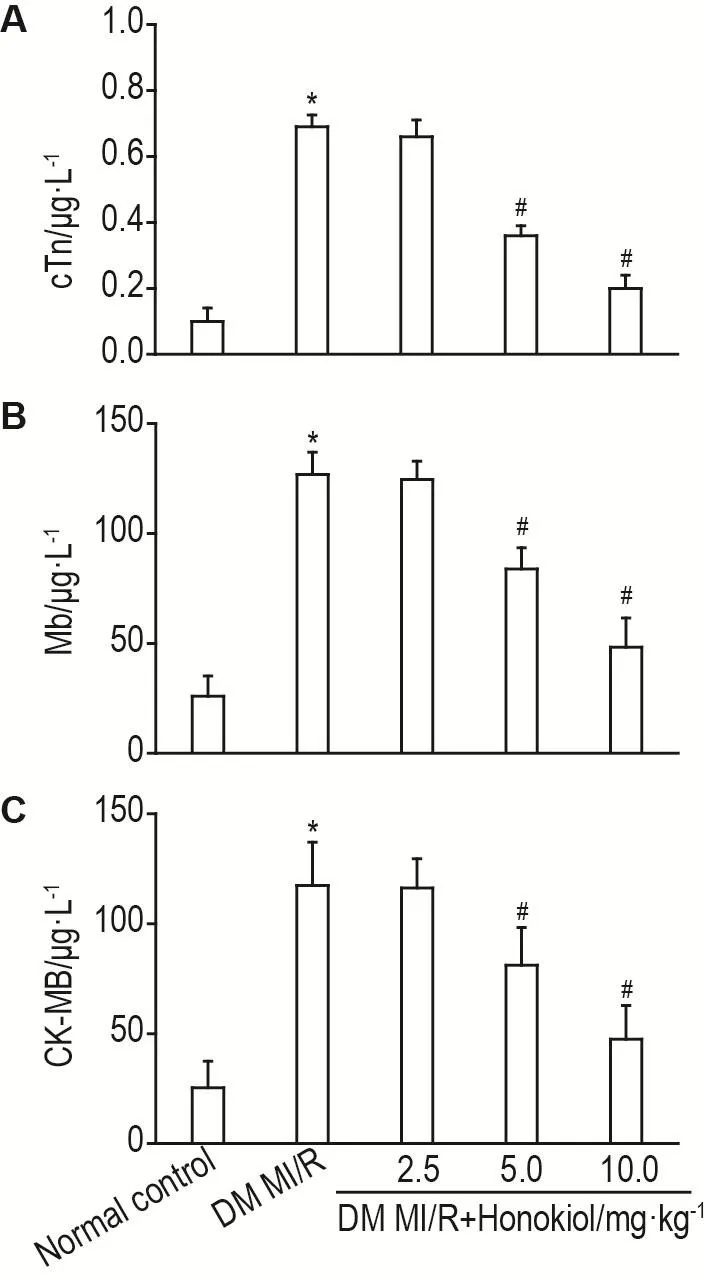
Fig.2 Effect of honokiol on cardiac troponin I(cTnI,A),myohemoglobin (Mb,B) and creatine kinase MB(CK-MB,C)level in DM MI/R model rats.See Fig.1 for the rat treatment.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with DM MI/R group.
2.3 和厚朴酚对DMMI/R模型大鼠血清中SOD活性,GSH和MDA水平的影响
如图3所示,与正常对照组比较,DM MI/R组SOD活性和GSH水平显著降低(P<0.05),MDA水平显著升高(P<0.05);与DM MI/R组相比较,DM MI/R+和厚朴酚5.0和10.0 mg·kg-1组SOD活性和GSH水平显著升高(P<0.05),MDA水平显著降低(P<0.05)。
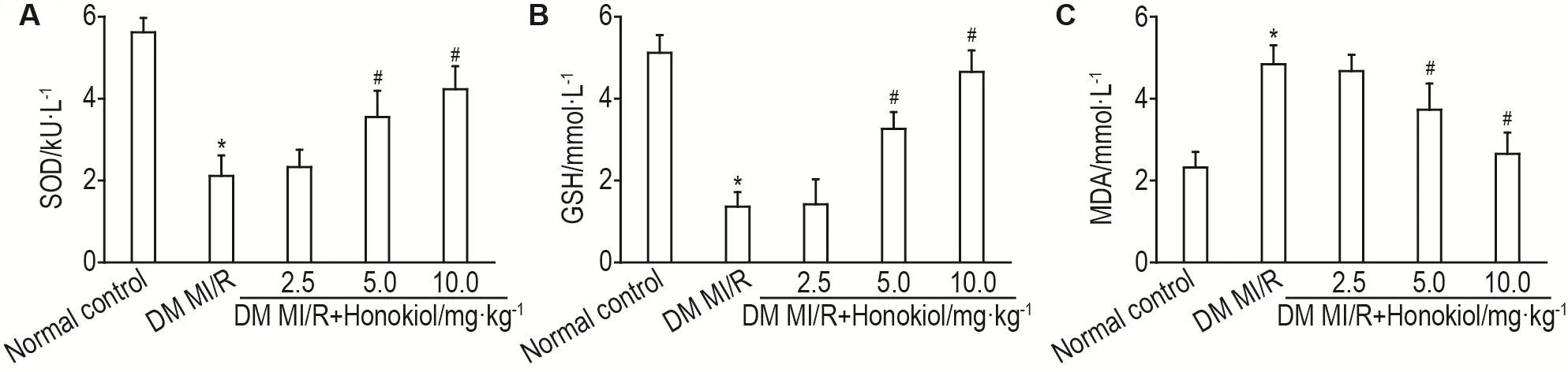
Fig.3 Effect of honokiol on superoxide dismutase(SOD,A),glutathione(GSH,B)and malondialdehyde(MDA,C)in DM MI/R model rats.See Fig.1 for the rat treatment.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with DM MI/R group.
2.4 和厚朴酚对DM MI/R模型大鼠心肌病理损伤和细胞凋亡的影响
HE染色结(图4)所示,正常对照组心肌纤维排列规整,未见变性,炎症细胞浸润。DM MI/R组心肌纤维排列紊乱、坏死、断裂,炎症细胞浸润。DM MI/R+和厚朴酚5.0和10.0 mg·kg-1组较DM MI/R组病理损伤程度明显改善,心肌纤维排列较规整,少量炎症细胞浸润。通过TUNEL染色检测各组大鼠心肌细胞凋亡结果如图3B和3C所示,与对照组相比较,DM MI/R组细胞凋亡率显著升高(P<0.05);与DM MI/R组相比较,DM MI/R+和厚朴酚5.0和10.0 mg·kg-1组细胞凋亡率显著降低(P<0.05)。
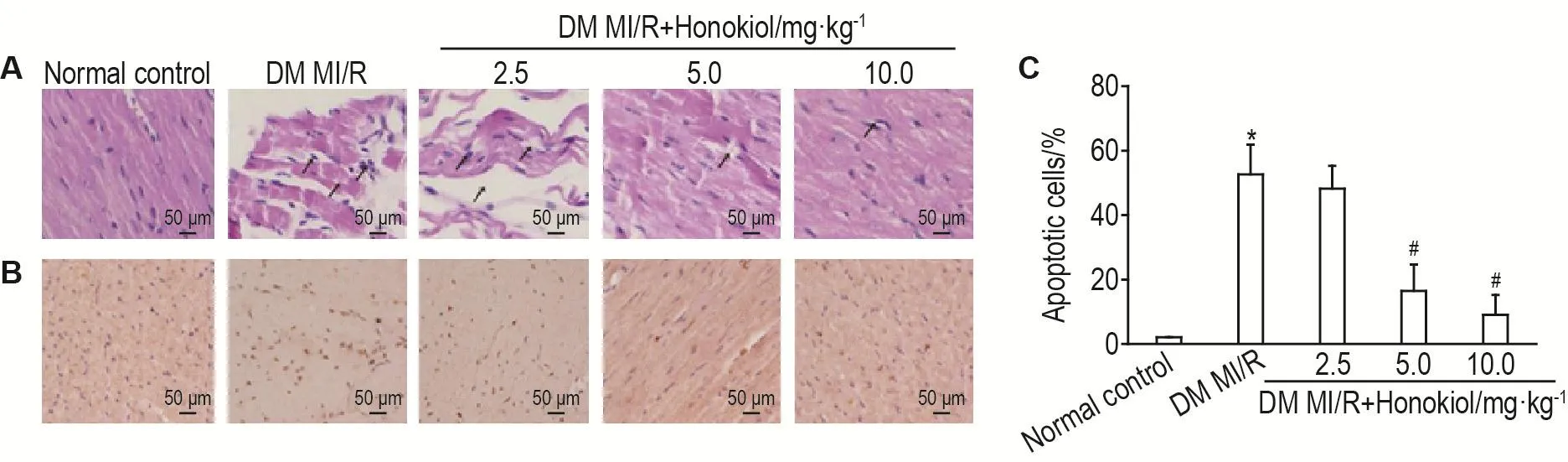
Fig.4 Effect of honokiol on pathological injury and apoptosis inhibition of myocardial cells in DM MI/R model rats by HE staining(A)and TUNEL staining(B).See Fig.1 for the rat treatment.C was the semi-quantitative result of B.The arrows show the locations of serious myocardial injury.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with DM MI/R group.
2.5 和厚朴酚对DM MI/R模型大鼠心肌组织中胱天蛋白酶3、Bax、Bcl-2和c-Myc蛋白水平的影响
如图5所示,与正常对照组相比较,DM MI/R组活化的胱天蛋白酶3/胱天蛋白酶3和Bax/Bcl-2的比值均显著升高(P<0.05),c-Myc蛋白水平显著降低(P<0.05);与DM MI/R组相比较,DM MI/R+和厚朴酚5.0和10.0 mg·kg-1组活化的胱天蛋白酶3/胱天蛋白酶3和Bax/Bcl-2的比值显著降低(P<0.05),c-Myc蛋白水平显著升高(P<0.05)。
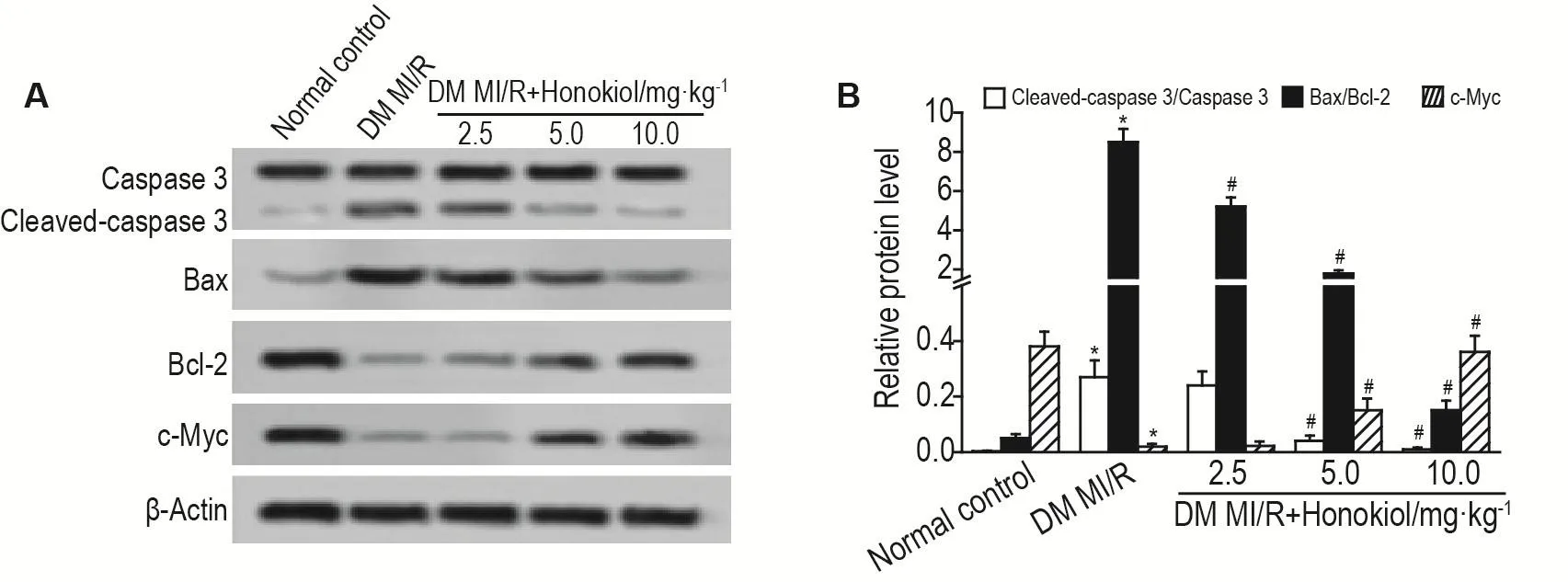
Fig.5 Effect of honokiol on protein expressions of caspase 3,cleaved-caspase 3,Bax,Bcl-2 and c-Myc in DM MI/R model rats by Western blotting.See Fig.1 for the rat treatment.B was the semi-quantitative result of A.±s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with DM MI/R group.
3 讨论
随着中国社会老龄化的逐步加快,糖尿病患者逐年增多,严重威胁人们的健康。缺血心脏病等心血管并发症是导致糖尿病患者死亡的主要因素[18]。而糖尿病患者治疗一般长期服用药物,容易产生耐药性,因此找到能减轻并改善DM MI/R的药物尤为重要。相关研究表明,和厚朴酚对DM模型大鼠有抗氧化、降糖降脂、抑制肝CYP2E1酶活性等作用,具有较明显的抗糖尿病疗效[19],通过抗心肌梗死作用降低急性心肌梗死大鼠的心肌梗死面积[10]。
心肌缺血时心肌细胞发生变性、坏死溶解,再灌注损伤增加心肌细胞膜通透性,血液中心肌损伤标志物水平升高,心肌细胞损伤程度与CK-MB,Mb和cTnI水平相关[11]。CK-MB是诊断急性心肌损伤最常用和最有价值的生化指标之一,心肌中CK-MB反映心肌缺血范围的大小,血清CK-MB含量越高,心肌损伤程度越重[12-14]。本研究发现,和厚朴酚具有降低DM MI/R模型大鼠cTnl,Mb和CK-MB水平及改善心肌组织病理损伤的作用。提示和厚朴酚具有改善DM MI/R大鼠心肌损伤的作用。
心肌细胞凋亡在DM MI/R中起着重要作用,抑制心肌细胞凋亡可减轻DM MI/R心肌损伤[15]。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax能形成Bcl-2/Bax异二聚体[16]。胱天蛋白酶家族是细胞凋亡的介导者以及执行者,胱天蛋白酶3处于凋亡有序级联反应的下游,是家族中的最重要的凋亡执行者之一,是多种凋亡刺激信号传递的汇聚点[17]。当胱天蛋白酶凋亡级联切割激活胱天蛋白酶3酶原后,活化的胱天蛋白酶3发挥调控作用,引起细胞凋亡。WANG等[5]研究发现,异丙酚通过上调Bcl-2表达,下调Bax和胱天蛋白酶3的表达及抑制细胞凋亡缓解DM大鼠MI/R损伤。c-Myc是一种具有转录因子功能的原癌基因,参与细胞中多种癌症相关基因的转录,可促进细胞增殖或诱导细胞凋亡。本研究结果与上述研究结果一致,和厚朴酚通过降低活化的胱天蛋白酶3/胱天蛋白酶3和Bax/Bcl-2的比值,升高c-Myc蛋白表达水平,改善DM MI/R模型大鼠心肌损伤。
氧化应激是由于机体内的氧化系统与抗氧化水平失衡,氧自由基生成过多无法被清除,导致机体过度氧化,从而造成组织功能损害[18]。MDA是脂质过氧化反应的终产物,其水平高低可反映氧化应激程度,GSH和SOD是体内最重要的抗氧化酶,可清除细胞中ROS,具有保护细胞免受氧化损伤的作用[19]。朱为勇等[20]研究发现,和厚朴酚通过增加SOD,CAT和GSH水平,降低MDA水平,抑制氧化应激,减轻氧化低密度脂蛋白诱导的内皮细胞损伤。翟蒙恩等[21]研究发现,通过降低MDA含量及增强SOD和GSH-Px活性抑制脓毒症诱发的心肌氧化应激,最终减轻脓毒症心肌损伤。本研究发现,和厚朴酚具有升高DM MI/R模型大鼠SOD活性和GSH水平、降低MDA水平的作用,提示和厚朴酚通过抑制氧化应激减轻DM MI/R模型大鼠心肌损伤。
综上所述,本研究发现和厚朴酚通过降低cTnl,Mb和CK-MB水平改善心肌病理损伤,降低活化的胱天蛋白酶3/胱天蛋白酶3和Bax/Bcl-2的比值,升高c-Myc蛋白水平,抑制心肌细胞凋亡,升高SOD活性和GSH水平,降低MDA水平,以改善氧化应激。本研究为临床应用和厚朴酚治疗DM MI/R提供实验依据。
