盐酸去氢骆驼蓬碱对人神经母细胞瘤SH-SY5Y细胞凋亡及自噬的影响
2020-03-16西仁阿依西热甫雷秀英伊力亚斯艾萨木塔力甫艾买提冯学召
西仁阿依·西热甫,雷秀英,张 瑜,伊力亚斯·艾萨,木塔力甫·艾买提,5,陈 倩,冯学召,李 飞,4,米 娜
(新疆医科大学1.药学院,2.第一附属医院临床医学研究院,3.基础医学院,5.中心实验室,新疆乌鲁木齐 830011;4.中国药科大学国家重点实验室,江苏 南京 210009)
神经母细胞瘤是儿童常见的颅外实体瘤,属于胚胎性恶性肿瘤,在全世界儿童实体肿瘤发病率中位居第二,仅次于中枢神经系统肿瘤,占所有儿童恶性肿瘤总发病率的8%~10%[1-2]。神经母细胞瘤是一种复杂的疾病,从转移扩散到自发消退,其临床过程不尽相同,1岁以上患儿出现转移性病灶的几率较高,而1岁以下患儿却往往呈现肿瘤自发消退的趋势[3-4]。该病治愈率在低风险患儿中>90%,而在高风险者中则<50%,呈现极大差异[5]。
盐酸去氢骆驼蓬碱(harmine hydrochloride,HMH)是自然界中丰富存在的β-咔啉类生物碱类去氢骆驼蓬碱(harmine,HM)的盐酸盐。研究表明,HM具有明显的抗肿瘤活性,包括在体外实验中,抑制胃癌细胞的增殖、迁移和侵袭[6],抑制黑素瘤细胞血管的形成[7],阻滞结肠癌细胞周期[8],促进胃癌细胞凋亡[6,9]等;以及在体内实验中抑制多种肿瘤的生长,如黑素瘤[7]、肺癌[10]、乳腺癌[11]和肝癌[12]等。研究表明,HM能通过血脑屏障,在神经系统富集[13]。到目前为止,HM对人神经母细胞瘤生存的影响及其相关机制研究报道较少。因此,本文研究了HMH对人神经母细胞瘤SH-SY5Y细胞的影响,并初步探讨了其作用机制。
1 材料与方法
1.1 药品、试剂和主要仪器
HMH(批号:H0002,纯度>98%),上海梯希爱化成工业发展有限公司,使用前用DMSO配成40 mmol·L-1的母液,-20℃保存。DMEM高糖培养基、PBS磷酸盐缓冲液和青-链霉素,美国Hyclone公司;胎牛血清,以色列BI公司;DMSO、MTT、兔抗人胱天蛋白酶3、活化的胱天蛋白酶3、自噬相关蛋白微管相关蛋白轻链3B(microtubuler-associated protein light chain 3B,LC3B)、P62和β肌动蛋白单克隆抗体,及3-甲基腺嘌呤(3-methyladenine,3-MA)、碘化丙啶(propidium iodide,PI)和Hoechst-33342,美国Sigma公司;兔抗人Bax、Bcl-2、哺乳动物雷帕霉素靶蛋白(mammalian target of Rapa⁃mycin,mTOR)和磷酸化mTOR(p-mTOR)单克隆抗体,英国Abcam公司;兔抗人蛋白激酶B(pro⁃tein kinase B,Akt)和p-Akt单克隆抗体,美国CST公司;HRP标记的山羊抗兔IgG抗体,美国Southern Biotech公司。
超净化工作台、CO2孵育箱和酶标仪,美国Thermo公司;倒置光学显微镜,宁波舜宇仪器公司;电子天平,北京赛多利斯仪器系统有限公司;激光共聚焦显微镜,日本Nikon公司;小型垂直电泳槽,美国Bio-Rad公司。
1.2 细胞和细胞培养
人神经母细胞瘤SH-SY5Y细胞购自中国科学院细胞库。细胞于含10%胎牛血清、1%青链霉素和1%谷氨酰胺的DMEM高糖培养液中,在5% CO237℃的孵育箱中培养。每天倒置光学显微镜下观察细胞状态,待细胞长至80%~90%融合度进行传代。
1.3 MTT法检测SH-SY5Y细胞存活率
取对数生长期的SH-SY5Y细胞消化、计数并稀释成5×107L-1的单细胞悬液,每孔200 μL,接种至96孔板培养24 h。细胞分药物组和细胞对照组,每组6个复孔。药物组加入含HMH 10,20,40,80和 160 μmol·L-1的细胞培养液,细胞对照组加入等量DMSO(体积分数≤0.1%)。培养24 h后,每孔加入5 g·L-1的MTT溶液20 μL,置孵育箱继续培养4 h,弃上清,每孔加入DMSO 150 μL,用酶标仪在490 nm处测定吸光度(A490nm)值。细胞存活率(%)=(药物组A490nm/细胞对照组A490nm)×100%。
1.4 克隆形成实验检测SH-SY5Y细胞增殖
取对数生长期的SH-SY5Y细胞消化、计数并稀释成5×104L-1的单细胞悬液,每孔1 mL接种至12孔板,培养至贴壁。细胞分药物组和细胞对照组,药物组加入含HMH 2和4 μmol·L-1的细胞培养液,细胞对照组加入等量DMSO(体积分数≤0.1%)培养14 d,细胞长至在日光灯下肉眼可观察到白色细胞团时,PBS洗1次,4%多聚甲醛固定,0.05%结晶紫染色,观察紫色细胞克隆团的大小及数量,并采集图像。克隆形成率(%)=形成克隆数目/接种细胞数目×100%。
1.5 Hoechst33342/PI染色法检测SH-SY5Y细胞凋亡
取对数生长期的SH-SY5Y细胞消化、计数并稀释成2×108L-1的单细胞悬液,每孔500 μL接种至4孔玻底培养皿培养24 h。细胞分组给药同1.3,培养24 h后,加入Hoechst33342染色液和PI染色液,置孵育箱37℃孵育30 min,PBS洗涤,加500 μL完全培养液,用激光共聚焦显微镜观察细胞凋亡情况,并采集图像。
1.6 Western印迹法检测Bax、Bcl-2、胱天蛋白酶3、活化的胱天蛋白酶3、LC3B-Ⅱ、P62蛋白水平及Akt和mTOR蛋白磷酸化水平
取对数生长期的SH-SY5Y细胞消化、计数并稀释成2×108L-1的单细胞悬液,每孔2 mL接种至6孔板培养24 h。在检测Bax、Bcl-2、胱天蛋白酶3、活化的胱天蛋白酶3、LC3B-Ⅱ和P62蛋白水平时,细胞分组给药同1.3;在检测联用自噬抑制剂3-MA后LC3B-Ⅱ蛋白水平时,细胞分为药物组、模型加药物组和细胞对照组,药物组加入含HMH 40 μmol·L-1的细胞培养液、模型加药物组加入含HMH40μmol·L-1和3-MA 5 mmol·L-1的细胞培养液,细胞对照组加入等量DMSO(体积分数≤0.1%);在检测Akt和mTOR磷酸化水平时,细胞分药物组和细胞对照组,药物组加入HMH 40 μmol·L-1的细胞培养液,细胞对照组加入等量DMSO(体积分数≤0.1%)。培养24 h后收集细胞,用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液裂解细胞,BCA法检测蛋白浓度,SDS-PAGE电泳分离总蛋白,半干转法转膜,5%脱脂奶粉封闭1 h,PBST洗5 min×3次,加入一抗〔Bax(1∶1000)、Bcl-2(1∶2000)、胱天蛋白酶3(1∶2000)、活化的胱天蛋白酶3(1∶2000)、LC3B(1∶5000)、P62(1∶5000)、Ak(t1∶5000)、p-Akt(1∶5000)、mTOR(1∶5000)、p-mTOR(1∶5000)和β肌动蛋白(1∶5000)〕,4℃孵育过夜。PBST洗10 min×3次,加入二抗(1∶5000),常温孵育1 h。PBST洗10 min×4次,显影,扫描,采用Image J软件对蛋白条带进行积分吸光度(integrated absor⁃bance,IA)值分析。以目标蛋白与内参蛋白条带IA值的比值表示目标蛋白的相对表达水平;以磷酸化蛋白与总蛋白条带IA值的比值表示蛋白磷酸化水平。
1.7 统计学分析
各组实验均独立重复至少3次。采用SPSS 21.0统计软件及Graphpad Prism 6.0软件进行统计分析和制图,结果数据用±s表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 HMH对SH-SY5Y细胞存活率的影响
与细胞对照组相比,不同浓度的HMH作用24 h后,在 20~160 μmol·L-1浓度范围内对人神经母细胞瘤SH-SY5Y细胞存活均有显著抑制作用(P<0.01)(表1)。
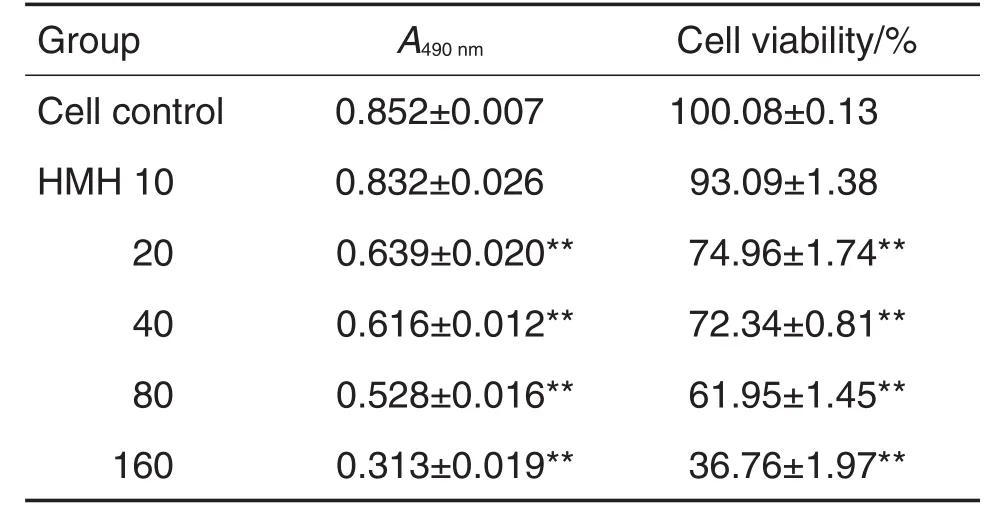
Tab.1 Effect of harmine hydrochloride(HMH)on via⁃bility of SH-SY5Y cells by MTT assay
2.2 HMH对SH-SY5Y细胞克隆形成的影响
与细胞对照组相比,HMH 2 和 4 μmol·L-1组SH-SY5Y细胞克隆形成率显著降低(P<0.01),分别为(75±5)%和(31±3)%(图1)。

Fig.1 Effect of HMH on cloning formation of SH-SY5Y cells.The SH-SH5Y cells were treated with HMH 2 and 4 μmol·L-1 for 14 d.B was the qualitive result of A.x±s,n=3.**P<0.01,compared with cell control group.
2.3 HMH对SH-SY5Y细胞凋亡的影响
细胞对照组蓝色细胞核色泽均匀,饱满,呈淡蓝色,红色荧光微弱。当HMH 10~160 μmol·L-1作用24 h后,随着药物浓度的增加蓝色荧光增强,细胞核皱缩、分叶,形成凋亡小体,边缘不清晰,最终碎裂,而红色荧光也随药物浓度的增加逐渐增强,死亡细胞增多(图2)。
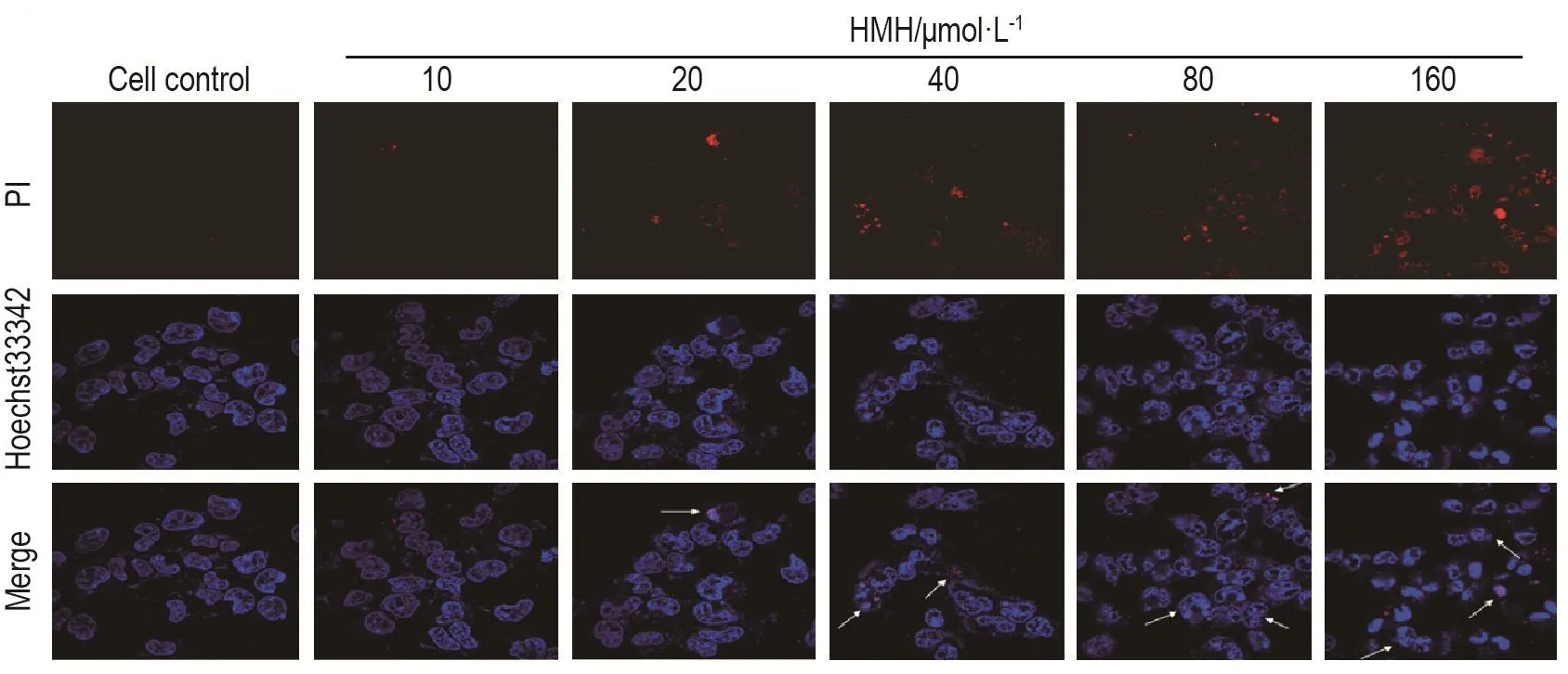
Fig.2 Effect of HMH on SH-SY5Y cells apoptosis by Hoechst33342/PI staining(×600).See Tab.1 for the cell treatment.The arrows show the chromatin condensation,nuclear fragmentation,cell shrinkage and necrosis.
2.4 HMH对Bax、Bcl-2、胱天蛋白酶3和活化的胱天蛋白酶3蛋白表达的影响
与细胞对照组相比,HMH作用于SH-SY5Y细胞24 h后,在20~160 μmol·L-1浓度范围内,SH-SY5Y细胞凋亡标志蛋白Bax/Bcl-2的比值显著增加(P<0.05),在40~160 μmol·L-1浓度范围内,活化胱天蛋白酶3/胱天蛋白酶3的比值显著增加(P<0.05)(图3)。
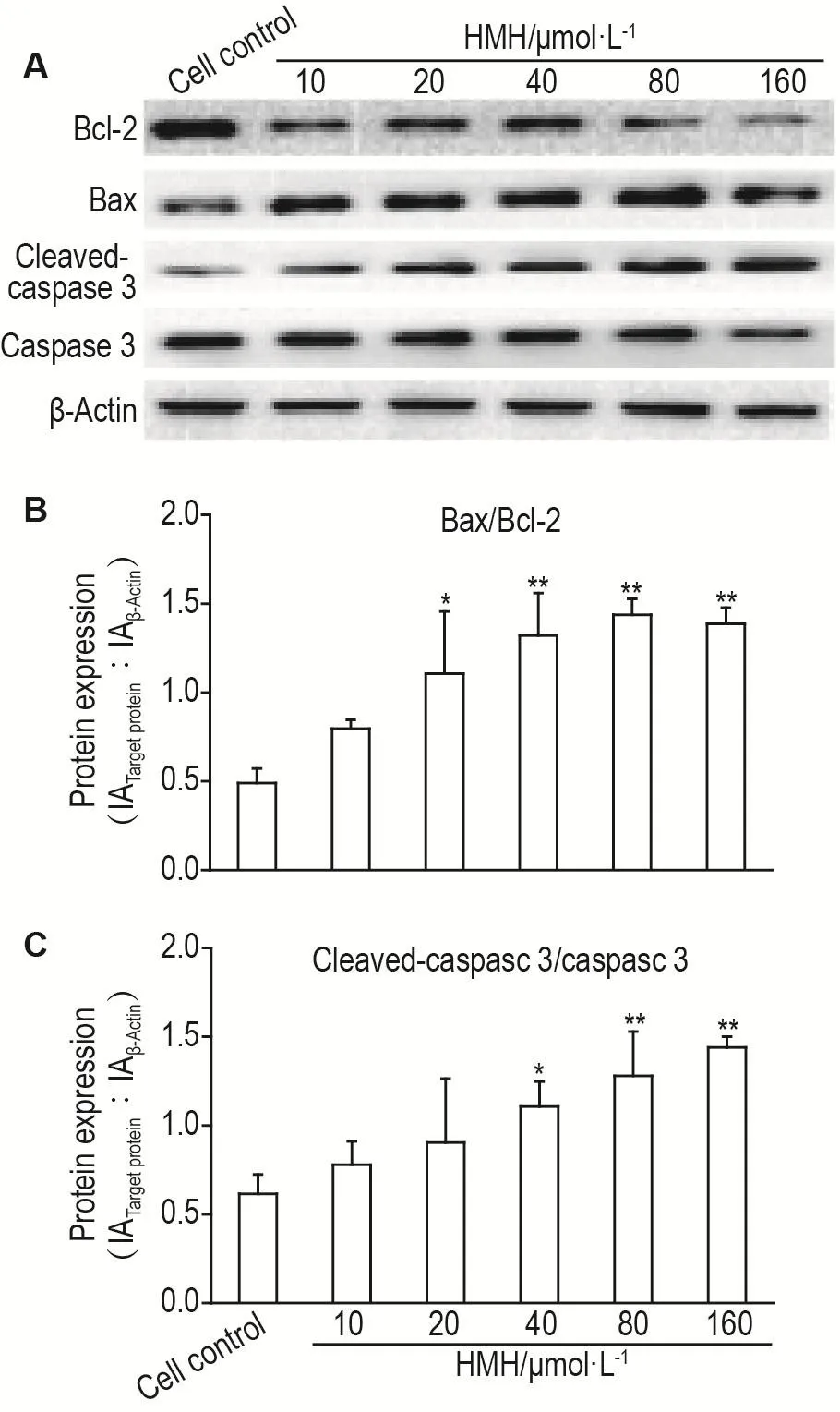
Fig.3 Effect of HMH on protein expressions of Bax,Bcl-2,caspase 3 and cleaved-caspase 3 in SH-SY5Y cells by Western blotting.See Tab.1 for the cell treatment.B and C were the semi-qualitive results of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.5 HMH对LC3B-Ⅱ和P62表达的影响
与细胞对照组相比,不同浓度的HMH作用于SH-SY5Y细胞24 h后,在 20~160 μmol·L-1浓度范围内,SH-SY5Y细胞自噬标志蛋白P62的相对表达水平显著减少(P<0.01),LC3B-Ⅱ的相对表达水平显著增加(P<0.01)(图4)。
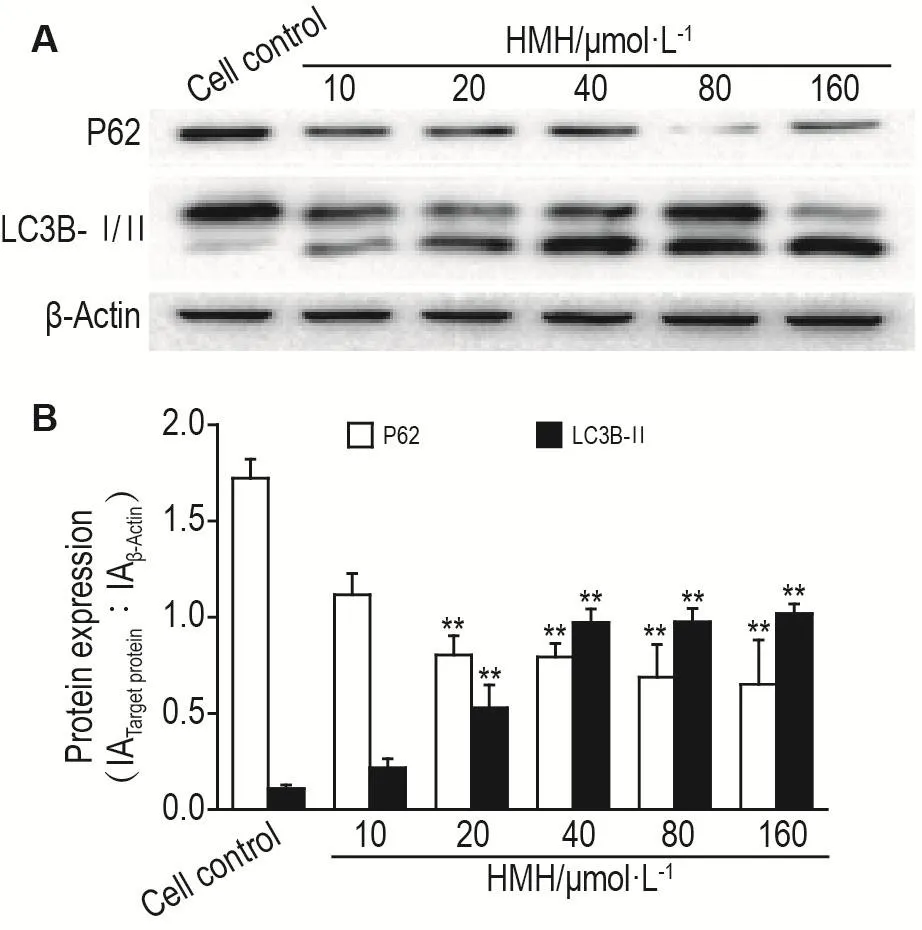
Fig.4 Effect of HMH on protein expressions of microtu⁃buler-associated protein light chain 3B-Ⅱ(LC3B-Ⅱ)and P62 in SH-SY5Y cells by Western blotting.See Tab.1 for the cell treatment.B was the semi-qualitive result of A.±s,n=3.**P<0.01,compared with cell control group.
2.6 HMH单用或与3-MA联用对自噬相关蛋白LC3B-Ⅱ表达的影响
药物作用于SH-SY5Y细胞4 h后,与细胞对照组相比,HMH 40 μmol·L-1单独处理组及同时给予HMH 40 μmol·L-1和自噬抑制剂 3-MA 5 mmol·L-1组细胞LC3B-Ⅱ蛋白相对表达水平均无显著变化。而药物作用24 h后,与细胞对照组相比,HMH 40 μmol·L-1单独处理组 SH-SY5Y 细胞 LC3B-Ⅱ蛋白相对表达水平显著增加(P<0.01);与HMH 40 μmol·L-1单独处理组相比,同时给予 HMH 40 μmol·L-1和3-MA 5 mmol·L-1组细胞LC3B-Ⅱ蛋白相对表达水平显著减少(P<0.05)(图5)。
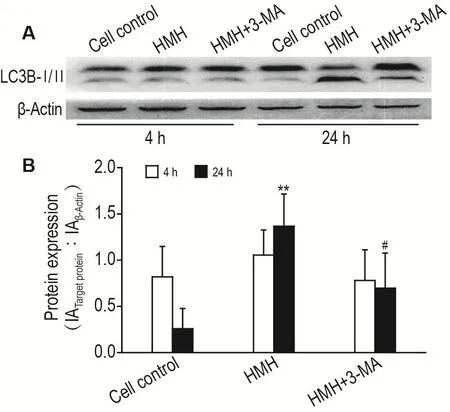
Fig.5 Effect of HMH on LC3B-Ⅱprotein expression in SH-SY5Y cells by Western blotting.The SH-SY5Y cells were treated with HMH 40 μmol·L-1or HMH 40 μmol·L-1+3-MA 5 mmol·L-1for 4 or 24 h,respectively.B was the semiqualitive result of A.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,compared with HMH group.
2.7 HMH对Akt和mTOR蛋白磷酸化水平的影响
与细胞对照组相比,HMH 40 μmol·L-1作用于SH-SY5Y细胞24 h后,Akt蛋白的表达水平无显著变化,mTOR蛋白的表达水平有所增加但没有显著性差异,p-Akt和p-mTOR蛋白的表达水平减少,p-Akt/Akt和p-mTOR/mTOR比值显著降低(P<0.05)(图6)。
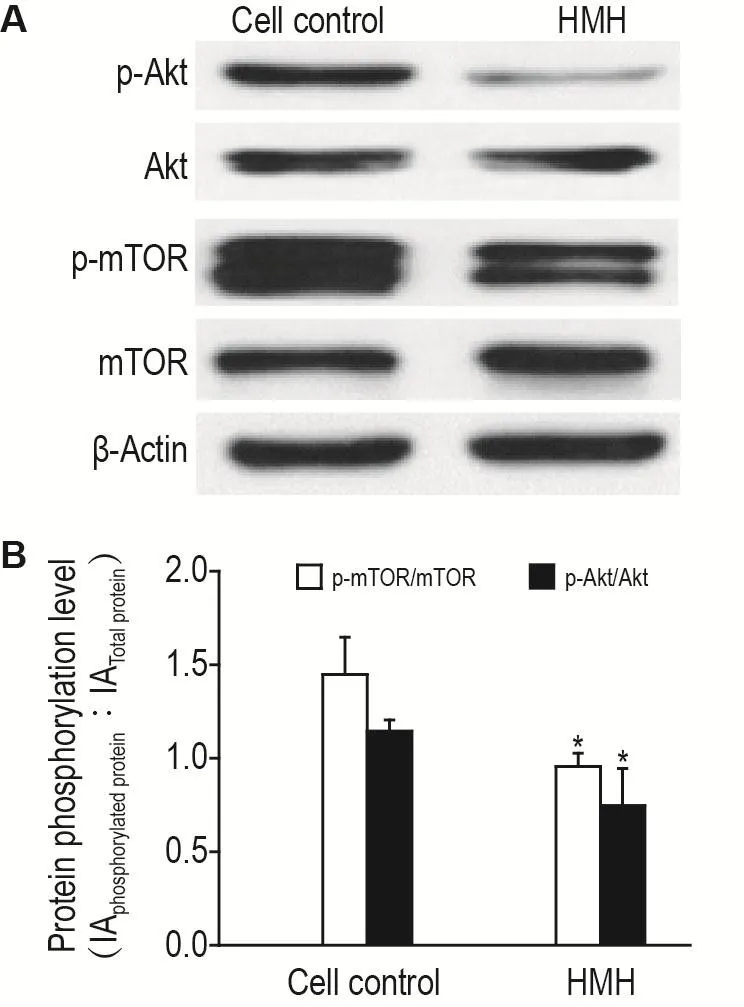
Fig.6 Effect of HMH on phosphorylation levels of protein kinase B(Akt)and mammalian target of Rapamycin(mTOR)in SH-SY5Y cells by Western blotting.The SH-SY5Y cells were treated with HMH 40 μmol·L-1for 24 h.B was the semi-qualitive results of A.±s,n=3.*P<0.05,compared with cell control group.
3 讨论
MTT实验及克隆形成实验结果显示,HMH在低浓度时即表现出显著的SH-SY5Y细胞增殖抑制作用,且随着药物浓度的增加,细胞存活率降低。Hoechst33342/PI染色结果显示,HMH 20 μmol·L-1时细胞核开始皱缩,分叶,随着药物浓度的增加,细胞核内形成凋亡小体,细胞核碎裂,死亡细胞逐渐增多。
凋亡途径始终是抗肿瘤药物起作用的最佳途径[14-15]。凋亡途径分内源性凋亡和外源性凋亡,内源性凋亡途径又称线粒体凋亡途径[16]。本研究检测了内源性凋亡途径关键蛋白Bax和Bcl-2,发现Bax蛋白的表达量随药物浓度的增加而增加,Bcl-2蛋白的表达水平随药物浓度的增加而减少,Bax/Bcl-2的比值增加。此外,胱天蛋白酶家族是参与细胞凋亡的关键家族,分为启动子蛋白(如胱天蛋白酶8和9)和执行子蛋白(如胱天蛋白酶3,6和7)。其中胱天蛋白酶3的剪切是凋亡发生的标志性过程,同时它也是Bax和Bcl-2的下游蛋白[17]。本研究检测发现,活化的胱天蛋白酶3/胱天蛋白酶3的比值增加,说明HMH能够启动内源性凋亡途径。
自噬在肿瘤的发生和发展过程中是一把“双刃剑”。自噬能抑制肿瘤细胞的发育,过度自噬可导致肿瘤细胞自噬性死亡,相反,自噬也可以提高肿瘤细胞对应激的耐受性,维持肿瘤细胞的存活[18-19]。本研究检测了自噬标志性蛋白LC3B-Ⅱ和P62的表达。LC3B蛋白有2种形式LC3B-Ⅰ与LC3B-Ⅱ,当自噬发生时LC3B-Ⅰ转化为LC3B-Ⅱ,参与自噬体的形成[20]。本研究的结果显示,LC3B-Ⅱ相对表达水平随药物浓度的增加而增加,P62蛋白的相对表达水平随药物浓度的增加而减少,说明HMH能够诱导SH-SY5Y细胞自噬。联合应用自噬抑制剂3-MA 4 h后,HMH单独给药组LC3B-Ⅰ至LC3B-Ⅱ的转化不明显;而联合应用3-MA 24 h后,HMH单独给药组LC3B-Ⅰ至LC3B-Ⅱ的转化明显,且联合应用3-MA组LC3B-Ⅱ相对表达水平减少,说明HMH诱导SH-SY5Y细胞自噬具有时间依赖性。然而,这种自噬对肿瘤细胞具有保护作用还是协同细胞凋亡发挥对SH-SY5Y细胞的抑制作用尚不明确,还需进一步研究。
Akt为PI3K/Akt/mTOR信号通路的中枢蛋白,参与细胞增殖、迁移、凋亡和自噬等多种生物过程[21]。Akt在多种肿瘤细胞中被异常激活,参与肿瘤的发生与发展[22]。mTOR为Akt的下游蛋白,是参与细胞自噬过程的重要负调控因子[23]。有研究表明,HM能通过抑制Akt/mTOR信号通路发挥抗胃癌作用[9]。本研究发现,HMH可抑制Akt/mTOR的磷酸化水平,说明HMH通过负调控Akt/mTOR通路诱导SH-SY5Y细胞凋亡与自噬。
综上所述,HMH能通过启动肿瘤细胞内源性凋亡途径抑制人神经母细胞瘤SH-SY5Y细胞增殖,同时诱导细胞自噬。该作用通过抑制Akt/mTOR信号通路实现。
