运用乙醇渗漉法优化三叶鱼藤中鱼藤酮提取工艺
——基于响应面法
2020-03-14黄丹慜苟志辉
郭 霞, 黄丹慜, 苟志辉, 田 蜜
(海南省林业科学研究所, 海口 571100)
三叶鱼藤(Derristrifoliata)属豆科(Leguminosae)鱼藤属(Derris)多年生藤本植物[1-2],产于热带和亚热带地区,在我国海南、广西、广州、台湾等红树林生长地广泛分布.该植物富含黄酮类物质,尤其以鱼藤酮最为特殊[3-4].该物质有毒,民间最早用作杀鱼剂[5].后来发现鱼藤酮的杀虫活性,在农业生产中得到实际应用[6-8].近来,在医药方面研究发现,鱼藤酮对帕金森病有一定的预防和治疗作用[9-10].目前有大量文献和专利报道提取鱼藤属中的鱼藤酮.使用的溶剂有甲醇、乙醇、丙酮、正丁醇、苯、氯仿等[11-12].其中丙酮和氯仿为管制溶剂,苯的毒性较大,这些溶剂危险性较高,环境风险较大,越来越不适合实验室和工业生产使用.甲醇沸点低、正丁醇沸点太高,为此,本研究选择乙醇为提取溶剂.提取方法有加热提取法[12]、微波提取法[13]、超临界CO2萃取法[14-17]等.2016年9月18日,海南对东寨港国家级自然保护区管理局三叶鱼藤种群进行招标防控;2016年10月26日,海南日报以“鱼藤疯长,红树林告急”为题,报道了儋州新英湾红树林生态系统受三叶鱼藤的威胁,需要引起足够重视,导致三叶鱼藤成为有害生物[18].因此,为了变废为宝,充分挖掘三叶鱼藤的价值,提取其中鱼藤酮活性物质.本实验采用渗漉法常温提取,避免浪费热能,安全系数较高.同时选择乙醇浓度和提取时间,采用响应面法优化提取鱼藤酮,为工业生产服务.
1 材料与方法
1.1 供试材料
三叶鱼藤(DerristrifoliateLour.)根茎采自海口东寨港国家级自然保护区(110°34′E,19°51′N),海南东寨港国家级自然保护区位于海南省东北部,属热带季风区海洋性气候,土壤有机质含量丰富,pH值在3.5~7.5之间.采样区内平均海拔为2 m,主要为海莲、桐花树、角果木、秋茄等植物群落.三叶鱼藤根茎采摘之后切成1 cm片段,晾干、粉碎,过60目筛,备用.
1.2 单因素试验
采用室温(25 ℃)渗漉法提取[19],溶剂选择乙醇,浓度为50%、60%、70%、80%、90%、100%,提取时间为1 d、2 d、3 d、4 d、5 d、6 d,过滤,溶液进行减压浓缩,真空减压干燥,得到粗提物样品,备用.
1.3 鱼藤酮含量测定
以鱼藤酮标准样品(Sigma公司,含量99%)为参照(图1),采用美国Agilent 6890N公司的高效液相色谱(HPLC)进行检测[20].检测条件:C18色谱柱,色谱柱:250 mm×4.0 mm不锈钢柱, 流动相V(乙腈)∶V(水)=60∶40,柱温30 ℃,流速为1.0 mL·min-1,检测波长为294 nm,进样量10 μL.根据鱼藤酮标样的吸收峰面积和样品鱼藤酮吸收峰面积,参照黄继光等方法[11],计算三叶鱼藤中鱼藤酮的含量.
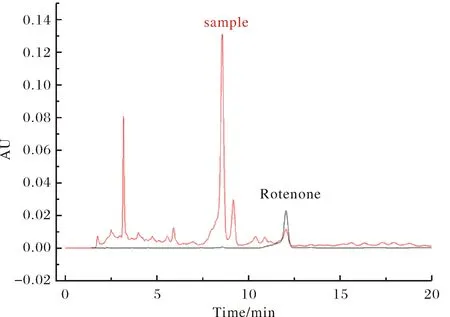
图1 鱼藤酮标样和三叶鱼藤的HPLC图谱Fig.1 HPLC spectrum of rotenone standard sample and Derris trifoliate
1.4 响应面试验设计
采用双因素,五水平的中心旋转复合设计方法[21].选取因素分别为乙醇浓度和提取时间,根据单因素试验确定双因素的水平,轴距为±1.414.利用Design-Expert 8.0.6软件,经多元线性回归分析建立经验二阶多项式模型.
1.5 数据分析
响应曲面数据由Design-Expert 8.0.6软件分析,所有统计分析采用SAS 9.0软件进行统计分析,进行ANOVA方差分析(p< 0.05).
2 结果与分析
2.1 单因素试验结果
分别选择乙醇浓度(时间固定为4 d)与提取时间(乙醇浓度固定为80%)优化三叶鱼藤中鱼藤酮的提取结果如图2所示.
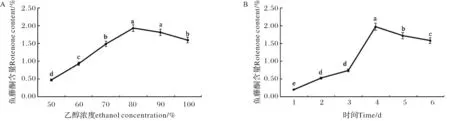
A) 乙醇浓度; B)提取时间A) Ethanol concentration (Time=4 d); B) Extraction time (Ethanol concentration=80%)图2 单因素优化鱼藤酮含量 Fig.2 Optimization of rotenone content by single factor
2.1.1 乙醇浓度的影响 固定提取时间为4 d,当乙醇浓度增加,三叶鱼藤中鱼藤酮的含量快速增加,随后缓慢降低,结果如图2A所示.当乙醇浓度为80%时,鱼藤酮的含量达到最高,为1.93%;原因是:当乙醇浓度增加时,鱼藤酮的溶解性增加;当溶解达到饱和后,乙醇浓度的增加,杂质被进一步提取,从而导致鱼藤酮含量降低.综合考虑,70%、80%和90%三个浓度被挑选出进行响应面试验设计.
2.1.2 提取时间的影响 固定乙醇浓度为80%,随着提取时间的延长,鱼藤酮含量不断增加;当提取时间为4 d时,鱼藤酮含量达到最大值,1.97%;随后含量下降.由于时间延长,三叶鱼藤中的其他成分也被提取,导致鱼藤酮总含量下降.综合考虑,3 d、4 d和5 d三个时间被挑选出进行响应面试验设计.
2.2 模型的建立
根据上述试验筛选的结果,选择乙醇浓度为70%、80%、90%,提取时间为3 d、4 d、5 d;每个因素轴距为±1.414,模型设计见表1.由表1可知,当乙醇浓度为80%,提取时间为4 d时(编号1),鱼藤酮的含量最高,为2.01%.
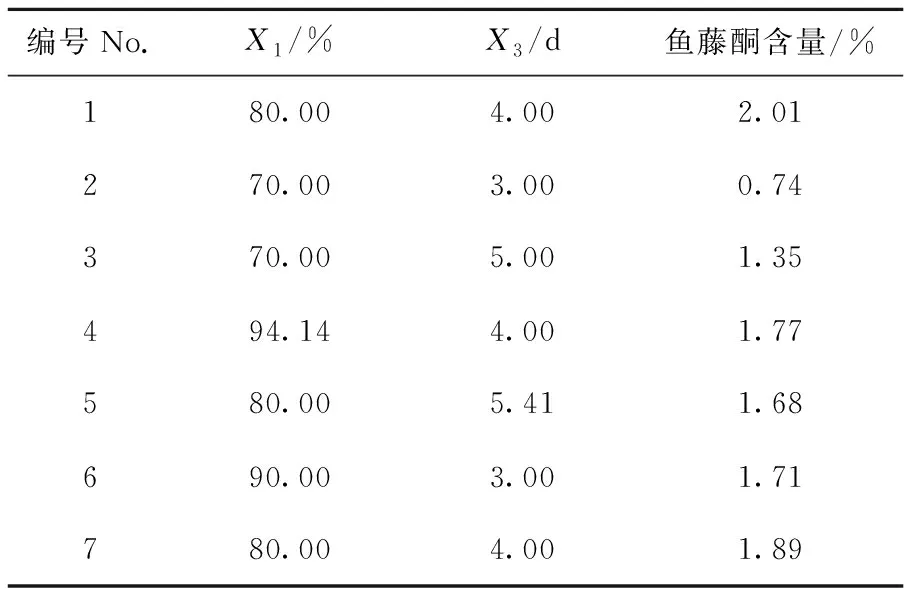
表1 双因素的中心复合旋转设计及考察指标值
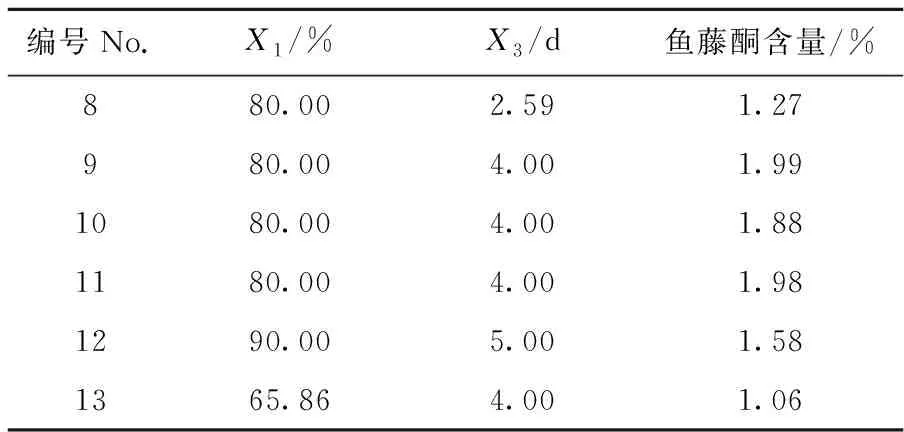
续表1
注:X1=乙醇浓度(Ethanol concentration)/%;X2=提取时间(Extraction Time)/d.
通过Design-Expert 8.0.6软件计算,方差分析结果见表2.由表2可知,模型的p值< 0.0001,表明该二次模型极显著.同时,乙醇浓度、提取时间两个因素及其组合的p值都小于0.05,表明因素自身及因素之间达到显著水平.失拟项值为0.210 7(>0.05),说明所得方程与实际拟合中非正常误差所占比例小,多项式方差具有较好的回归关系.
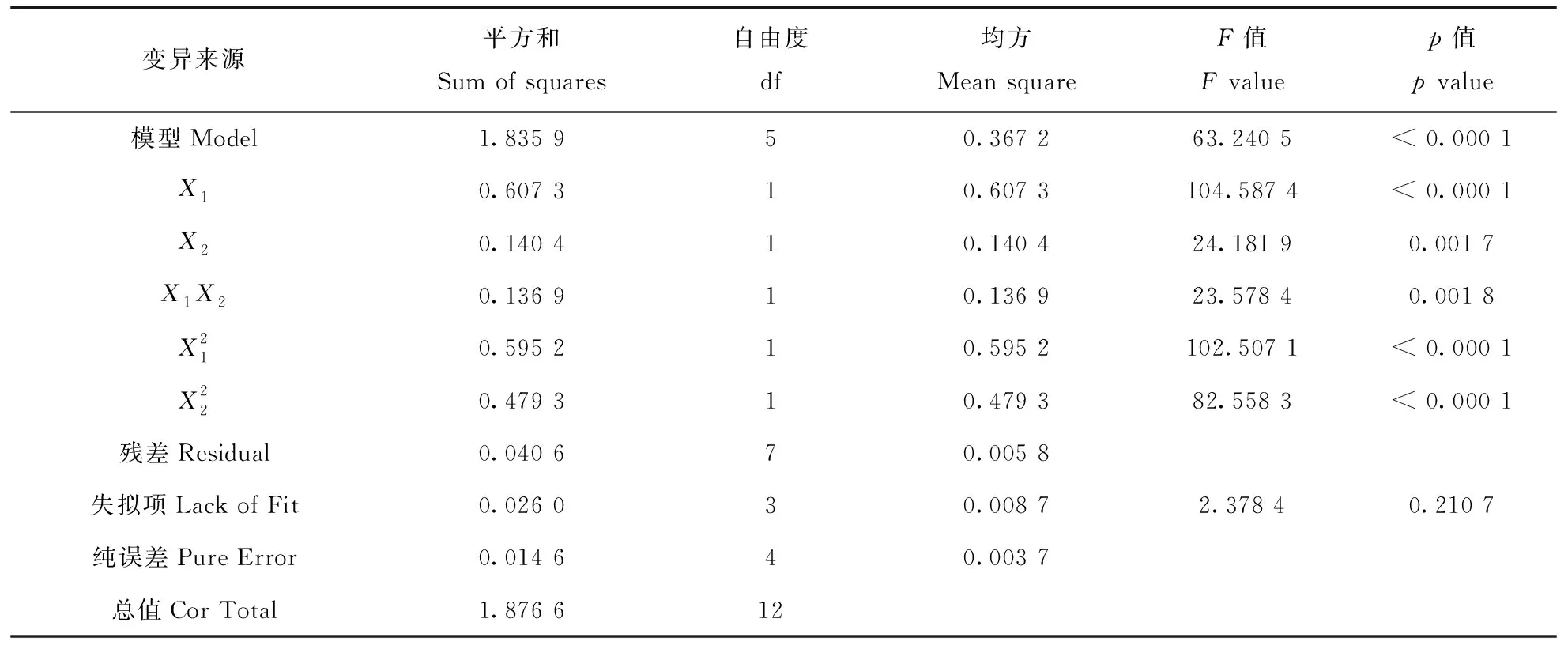
表2 二次模型响应面的方差分析结果
注:X1=乙醇浓度(Ethanol concentration)/%;X2=提取时间(Extraction Time)/d.
对上述试验结果进行回归分析,得到鱼藤酮的二阶多项式模型,结果见表3.由表3可知,模型方程相关系数显著,而失拟项概率不显著(>0.05),表明拟合形成的经验二阶多项式模型可用于响应面分析.

表3 鱼藤酮含量的二阶多项式模型
注:X1=乙醇浓度(Ethanol concentration)/%;X2=提取时间(Extraction Time)/d.
2.3 响应面分析
根据表3拟合的二阶多项式模型,利用响应面构建的软件分析,模拟出乙醇浓度、提取时间与鱼藤酮含量的响应曲面如图3所示.由图3可知,随乙醇浓度、提取时间的增加,鱼藤酮含量先增加,达到顶点后缓慢降低.形成的三维图形有明显的弧面,表明乙醇浓度和提取时间对鱼藤酮含量有显著影响.响应面底面的等高线反映了各因素之间的相关性.由图3可知,曲面的等高线在底面形成明显的椭圆形圆心,表明两个因素之间有很好的相关性.
2.4 最优条件的验证
根据中心旋转复合设计方法优化出最佳提取条件见表4.当乙醇浓度为84%,提取时间为4.1 d时,鱼藤酮的预测最佳值为2.02%;为此,在此条件下,进行试验提取鱼藤酮,通过色谱分析,得到鱼藤酮的含量为1.97%.与试验值相比较,相对误差为2.48%(小于5%),由此表明得到的二阶多项式模型可行.
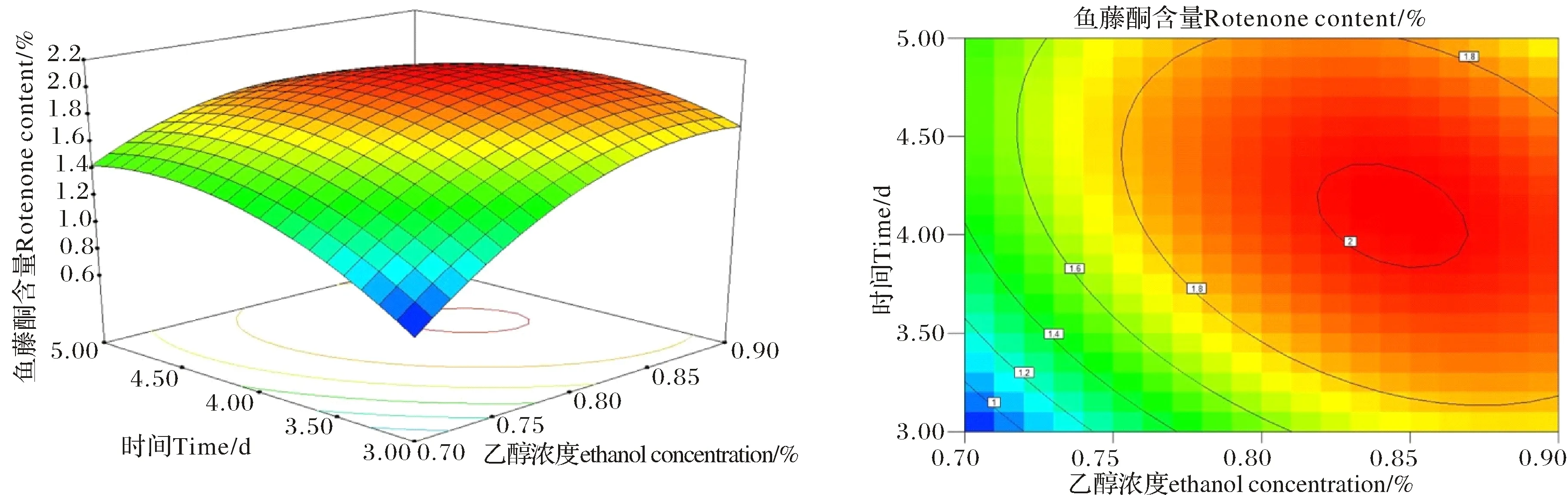
图3 鱼藤酮含量的响应曲面.Fig.3 Response surface of rotenone content

考察指标evaluation indices乙醇浓度EtOH/%提取时间Time/d预测值Predicted value/%试验值Experimental value/%相对误差Relative error/%鱼藤酮含量/%844.12.021.972.48
3 结论与讨论
提取后的溶液进行减压浓缩,为了避免高温造成物质变化,本实验减压浓缩的温度控制在45 ℃以下,真空度为0.1个大气压.得到的浸膏为墨绿色,颜色较深,会干扰液相色谱检测的准确性.为此,本实验采用前处理方法,统一使用活性炭脱色处理,然后进行检测.乙腈为溶剂测试鱼藤酮标样时,扣除了乙腈溶剂峰.乙醇浓度大小对三叶鱼藤中活性物质的提取有较大关系,浓度过大,三叶鱼藤中杂质将进一步被提取出来,浓度过小,鱼藤酮提取不充分,因此,根据优化以及HPLC检测,确定其提取最佳浓度.提取时间对鱼藤酮含量也有类似结果,时间过长,各种物质被提取出来,鱼藤酮含量降低;提取时间较短,鱼藤酮提取不充分等.
由此,根据二阶多项式模型,得出最佳乙醇浓度为84%,提取时间为4.1 d.在此条件下验证值为1.97%,如若提取时间延长,将有更多的杂质进入,导致鱼藤酮含量下降,进一步纯化鱼藤酮难度加大;如若提取时间较短,将浪费三叶鱼藤材料.因此该结果为实验室优化提取三叶鱼藤中的活性成分提供了较好的理论依据.
