美洲大蠊提取物YS-F对人非小细胞肺癌细胞A549增殖及凋亡的影响
2020-03-13倪连丽闫爽肖怀巫秀美何苗李玥
倪连丽 闫爽 肖怀 巫秀美 何苗 李玥
摘 要 目的:探討美洲大蠊提取物对人非小细胞肺癌细胞A549增殖、凋亡的影响及其可能机制。方法:将美洲大蠊干燥虫体以90%乙醇冷浸提取后,经聚酰胺柱色谱以水-甲醇梯度洗脱,得20%、30%、40%、50%、60%、70%、80%、90%甲醇洗脱部位(YS-A~H)。采用MTT法筛选活性部位,并检测不同剂量活性部位作用后的细胞增殖抑制率;采用流式细胞术检测不同剂量活性部位作用后的细胞凋亡、细胞周期和线粒体膜电位变化情况。结果:YS-A~H的半数抑制浓度分别为(95.25±8.42)、(129.93±7.24)、(221.28±12.68)、(275.39±14.87)、(276.76±16.32)、(31.90±5.34)、(163.15±6.97)、(122.81±8.36)μg/mL,以YS-F的活性最强。经YS-F 3、9、27、81 μg/mL作用24、48、72 h后,各时间点的细胞增殖抑制率均显著升高,且药物作用48、72 h时的细胞增殖抑制率显著高于同组24 h,作用72 h时的细胞增殖抑制率均显著高于同组48 h(P<0.01)。除YS-F 3 μg/mL作用24 h、YS-F 9 μg/mL作用72 h对坏死晚期细胞百分比,YS-F 3 μg/mL作用24 h对G2/M期细胞比例以及YS-F 3 μg/mL作用48 h对细胞线粒体膜电位降低率均无显著影响(P>0.05)外,其余各剂量组各时间点凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞百分比以及Sub-G0/G1期、S期细胞比例均显著升高,G0/G1期、G2/M期细胞比例均显著降低(P<0.01);且药物作用48、72 h时各剂量组凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞百分比(除YS-F 9 μg/mL作用72 h时的坏死晚期细胞百分比外)以及Sub-G0/G1期、G2/M期(除48 h YS-F 3、9 μg/mL组外)细胞比例均显著高于同组24 h,而G0/G1期、S期、G2/M期(除48 h YS-F 9 μg/mL组外)细胞比例均显著低于同组24 h(P<0.01);药物作用72 h时各剂量组凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞百分比(除YS-F 27 μg/mL作用72 h时的凋亡晚期和坏死早期细胞百分比以及YS-F 3、9 μg/mL作用72 h时的坏死晚期细胞百分比显著降低外)以及S期(除72 h YS-F 3 μg/mL组外)、Sub-G0/G1期细胞比例均显著高于同组48 h,而G0/G1期、G2/M期细胞比例均显著低于同组48 h(P<0.01)。经YS-F 9、27、81 μg/mL作用48 h后,细胞线粒体膜电位降低率均显著升高,且YS-F 27、81 μg/mL组显著高于YS-F 9 μg/mL组,YS-F 81 μg/mL组显著高于YS-F 27 μg/mL组。结论:YS-F可通过阻滞细胞从S期向G2/M期转化、降低线粒体膜电位等途径来抑制A549细胞的增殖并促进其凋亡,且这种作用具有时间或剂量依赖性。
关键词 美洲大蠊;非小细胞肺癌;A549细胞;增殖;凋亡;细胞周期;线粒体膜电位
ABSTRACT OBJECTIVE: To investigate the effects of Periplaneta americana extract on the proliferation and apoptosis of human non-small cell lung cancer A549 cells as well as its possible mechanism. METHODS: The dry bodies of P. americana were soaked with 90% ethanol and eluted with gradient water-methanol by polyamide column chromatography. The 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% methanol elution sites (YS-A-H) were obtained. MTT method was used to screen the active site, and the inhibition rate of different doses of active site was detected. Flow cytometry was adopted to detect cell apoptosis, cell cycle and mitochondrial membrane potential of cells after treated with different doses of active site. RESULTS: Half inhibition concentrations of YS-A-H were (95.25±8.42), (129.93±7.24), (221.28±12.68), (275.39±14.87), (276.76±16.32), (31.90±5.34), (163.15±6.97), (122.81±8.36) μg/mL, respectively. YS-F had the strongest activity. After treated with 3, 9, 27, 81 μg/mL YS-F for 24, 48, 72 h, cell proliferation inhibitory rate was increased significantly at different time points; after treated for 48, 72 h, that was significantly higher than same group after treated for 24 h; after 72 h treatment, that was significantly higher than same group after 48 h treatment (P<0.01). There was no significant effect of 24 h treatment of 3 μg/mL YS-F and 72 h treatment of 9 μg/mL YS-F on the percentage of cells in the late stage of necrosis, 24 h treatment of 3 μg/mL YS-F on the percentage of cells in G2/M phase and 48 h treatment of 3 μg/mL YS-F on the reduction rate of mitochondrial membrane potential (P>0.05). The percentage of cells in the early stage of apoptosis, the late stage of apoptosis and the early stage of necrosis, the late stage of necrosis, as well as the percentage of cells in the Sub-G0/G1 and S phase at each time point were significantly increased in other different doses groups, while the percentage of cells in G0/G1 and G2/M phase was decreased significantly (P<0.01). In each dose group, the percentage of cells in the early stage of apoptosis, the late stage of apoptosis and the early stage of necrosis, the late stage of necrosis (except for the percentage of cells in the late stage of necrosis treated with YS-F 9 μg/mL for 72 h) and the percentage of cells in Sub-G0/G1 phase, G2/M phase (except for YS-F 27, 81 μg/mL for 48 h) after treated for 48, 72 h were significantly higher than same group after 24 h of treatment; the percentage of cells in G0/G1 phase, S phase and G2/M phase (except for YS-F 9 μg/mL for 48 h) after treated for 48, 72 h were significantly lower than same group after 24 h of treatment (P<0.01); the percentage of cells in the early stage of apoptosis, the late stage of apoptosis and the early stage of necrosis, the late stage of necrosis (except for the percentage of cells in the late stage of apoptosis and early stage of necrosis when treated with YS-F 27 μg/mL for 72 h, the percentage of cells in the late stage of necrosis when treated with YS-F 3,9 μg/mL for 72 h were decreased significantly) and the percentage of cells in S phase (except for YS-F 3 μg/mL for 72 h) and Sub-G0/G1 phase after treated for 72 h were significantly higher than same group after 48 h of treatment, while the percentage of cells in G0/G1 and G2/M phase were significantly lower than same group after 48 h of treatment (P<0.01). After treated with YS-F 9, 27, 81 μg/mL for 48 h, the reduction rate of cell mitochondrial membrane potential was increased significantly; YS-F 27, 81 μg/mL groups were significantly higher than YS-F 9 μg/mL group, and YS-F 81 μg/mL group was significantly higher than YS-F 27 μg/mL group. CONCLUSIONS: YS-F can inhibit the proliferation and promote the apoptosis of A549 cells by preventing cell transformation from S phase to G2/M phase, and reducing mitochondrial membrane potential, in time-dependent or dose-dependent manner.
KEYWORDS Periplaneta americana; Non-small cell lung cancer cell; A549 cells; Proliferation; Apoptosis; Cell cycle; Mitochondrial membrane potential
美洲大蠊(Periplaneta americana L.)属昆虫纲蜚蠊科昆虫[1],最早记载于《神农本草经》,“主血瘀症坚,寒热,破积聚,喉咽闭,内寒无子”[2]。现代药理研究表明,美洲大蠊具有抗肿瘤、抑菌、修复受损组织等作用[3-5];其提取物对呼吸系统肿瘤细胞具有明显的抑制作用[6]。张丹等[7]报道,美洲大蠊多肽提取物可通过上调人肝癌细胞SMMC-7721中促凋亡蛋白Bax的表达、下调抗凋亡蛋白Bcl-2的表达,从而发挥促进肝癌细胞凋亡的作用;CHEN PP等[8]研究发现,由美洲大蠊提取物制得的康复新液可通过激活内质网应激和自噬来促进胃癌细胞的凋亡。本课题组参考上述文献,以美洲大蠊干燥虫体乙醇提取物为对象,经不同体积分数的甲醇梯度洗脱、冷冻干燥后,制得各相应洗脱部位(以下简称“YS”);在筛选活性部位的基础上,考察其对人非小细胞肺癌A549细胞增殖、细胞周期、线粒体凋亡等的影响,以期为美洲大蠊的进一步开发利用提供实验依据。
1 材料
1.1 仪器
SW-CJ-2FD型洁净工作台(苏州安泰空气技术有限公司);SERIESⅡ型CO2培养箱(美国Thermo Fisher Scientific公司);CKX41SF型倒置相差显微镜(日本Olympus公司);SN255939型酶标仪(美国BioTek公司);FACS Calibur型流式细胞仪(美国BD公司)。
1.2 药材
美洲大蠊药材购自大理市金贝小区中药材市场(批号:150301),经大理大学昆虫生物医药研究院杨自忠教授鉴定为美洲大蠊(P. americana L.)的干燥虫体。
1.3 试剂
RPMI 1640培养基(批号:1915379)、胎牛血清(FBS,批号:1828728)均购自美国Gibco公司;胰蛋白酶[密理博(中国)有限公司,批号:2046777];MTT试剂(批号:ST316)、二甲基亚砜(DMSO,细胞级,批号:RNBF1095)均购自美国Sigma公司;青-链霉素双抗(美国Amersco公司,批号:20180330);膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(Annexin Ⅴ-FITC/PI)双染色法细胞凋亡检测试剂盒(批号:6033840)、PI染色法细胞周期检测试剂盒(批号:6209516)、JC-1染色法细胞线粒体膜电位检测试剂盒(批号:6113545)均购自美国BD公司;聚酰胺(30~60目,中国医药集团上海化学试剂公司,批号:20120316);其余试剂均为分析纯,水为纯化水。
1.4 细胞
人非小细胞肺癌细胞A549(批号:KCB200434YJ)购自中国科学院典型培养物保藏委员会昆明细胞库。
2 方法
2.1 YS的制备
美洲大蠊干燥虫体经粉碎后,用8倍量(g/mL)90%乙醇冷浸提取3次,每次7 d,合并提取液,滤过,滤液浓缩至流浸膏,以石油醚脱脂,得脱脂流浸膏。取上述脱脂流浸膏适量,经聚酰胺柱色谱,依次以水和20%、30%、40%、50%、60%、70%、80%、90%甲醇洗脱,定量收集流分并合并同一体积分数的甲醇洗脱部位,经浓缩后冷冻干燥,依次得YS-A~H等8个洗脱部位,得率分别为9.926 4%、0.125 0%、0.097 8%、0.118 0%、0.100 7%、0.234 2%、0.137 2%、0.043 7%。
2.2 细胞培养
A549细胞经复苏后,接种于含10%FBS、100 U/mL青-链霉素双抗的RPMI 1640培养基(以下简称“完全培养基”)中,于37 ℃、5%CO2条件下培养(培养条件下同)。
2.3 细胞增殖抑制率检测及活性部位筛选
采用MTT法检测。取对数生长期A549细胞,经胰蛋白酶消化后,用完全培养基重悬,以5 000个/孔接种于96孔板中,培养24 h后,将细胞随机分为阴性对照组(有细胞组不含药,下同)和美洲大蠊提取物YS-A~H不同剂量组(均为3、9、27、81 μg/mL,以各洗脱部位质量计,剂量设置参考文献[9]),并设置不含细胞或药物的空白对照组,每组设5个复孔。空白对照组和阴性对照组均加入完全培养基100 μL,各给药组加入含相应药物的完全培养基100 μL。培养48 h后,弃去上清液,每孔加入5 mg/mL MTT溶液20 μL,继续孵育4 h;随后加入DMSO 150 μL,使用酶标仪于490 nm波长处检测各孔的光密度(OD)值,并计算各部位的半数抑制浓度(IC50)。根据上述结果,选取抑制作用最强(即IC50值最小)的洗脱部位为活性部位,同法考察其作用24、48、72 h时的细胞抑制率。抑制率(%)=(阴性对照组平均OD值-试验组平均OD值)/(阴性对照组平均OD值-空白对照组平均OD值)×100%。上述试验重复3次(下同)。
2.4 细胞凋亡情况检测
采用流式细胞术检测。取经胰蛋白酶消化的A549细胞,以1×106个/孔接种于6孔板中,培养24 h后,将细胞随机分为阴性对照组和“2.3”項下筛选的美洲大蠊提取物活性部位不同剂量组(3、9、27、81 μg/mL,剂量设置参考“2.3”项),每组设3个复孔。阴性对照组加入完全培养基2 mL,各给药组加入含相应药物的完全培养基2 mL。分别于培养的24、48、72 h时,收集细胞,按Annexin Ⅴ-FITC/PI双染色法细胞凋亡检测试剂盒说明书进行染色,采用流式细胞仪检测各组凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞占细胞总数的百分比(以下简称“细胞百分比”)。
2.5 细胞周期检测
采用流式细胞术检测。取经胰蛋白酶消化的A549细胞,以1×106个/孔细胞接种于6孔板中,培养24 h后,按“2.4”项下方法分组、给药,每组设3个复孔。分别于培养的24、48、72 h时,收集细胞,按PI染色法细胞周期检测试剂盒进行染色,采用流式细胞仪检测各组细胞周期,记录各周期细胞比例。
2.6 细胞线粒体膜电位变化情况检测
采用流式细胞术检测。取经胰蛋白酶消化的A549细胞,以1×106个/孔细胞接种于6孔板中,培养24 h后,按“2.4”项下方法分组、给药,每组设3个复孔。于培养48 h(培养时间根据前期研究确定,此时细胞密度最佳且形态较为一致)时,收集细胞,按JC-1染色法细胞线粒体膜电位检测试剂盒说明书进行操作,使用流式细胞仪检测各组细胞线粒体膜电位的变化情况,并计算线粒体膜电位降低的细胞占细胞总数的百分比(即降低率)。
2.7 统计学方法
采用SPSS 23.0软件对数据进行统计分析,采用Graphpad Prism 5.0软件作图。计量资料均以x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
3 结果
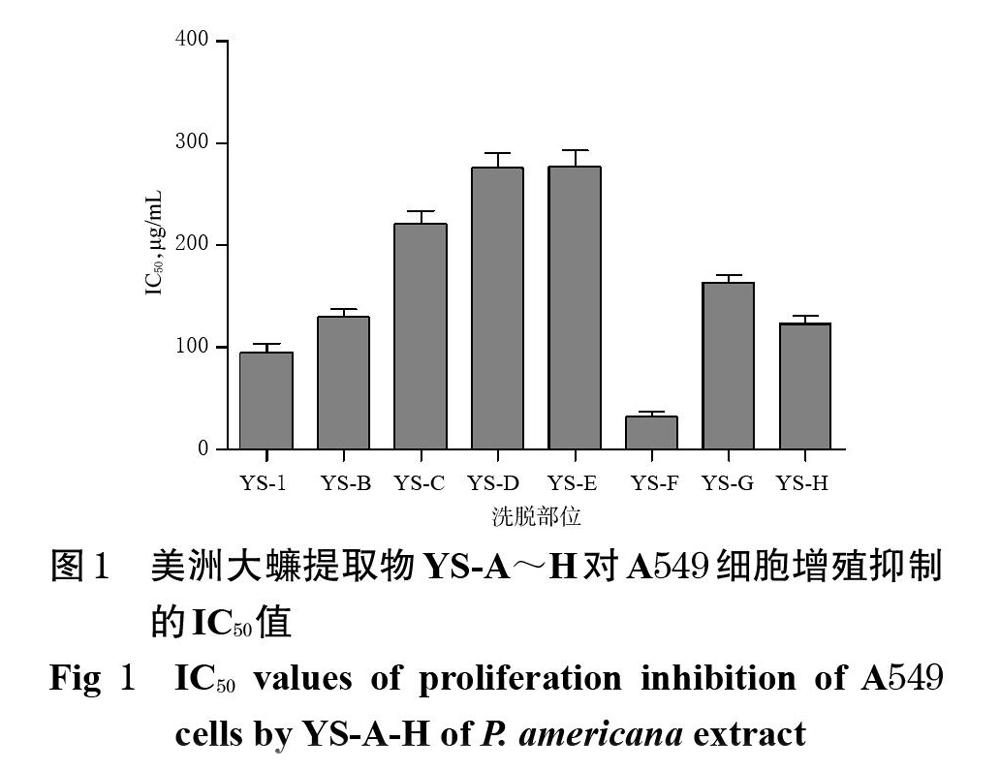
3.1 美洲大蠊提取物YS-A~H对A549细胞增殖的影响及活性部位的筛选结果
美洲大蠊提取物YS-A~H的IC50值分别为(95.25±8.42)、(129.93±7.24)、(221.28±12.68)、(275.39±14.87)、(276.76±16.32)、(31.90±5.34)、(163.15±6.97)、(122.81±8.36)μg/mL,详见图1。其中,YS-F的抑制作用最强,故以其作为活性部位进行后续试验。
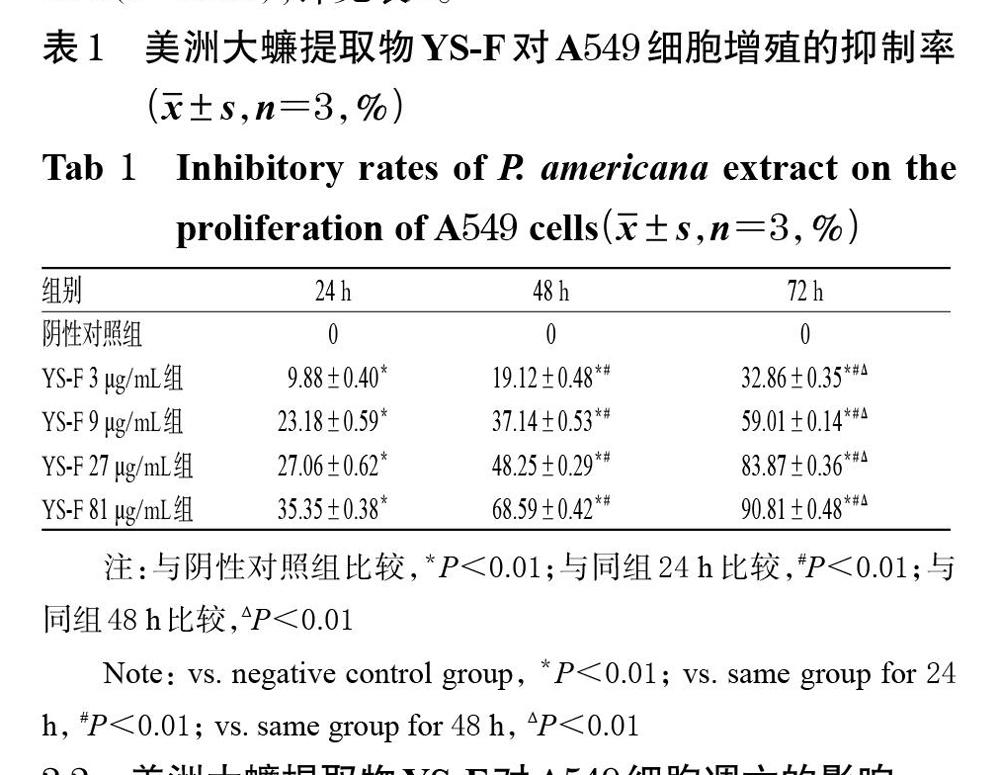
与阴性对照组比较,YS-F各剂量组细胞各时间点的抑制率均显著升高,且药物作用48、72 h时的抑制率显著高于同组24 h,作用72 h时的抑制率均显著高于同组48 h(P<0.01),详见表1。
3.2 美洲大蠊提取物YS-F對A549细胞凋亡的影响
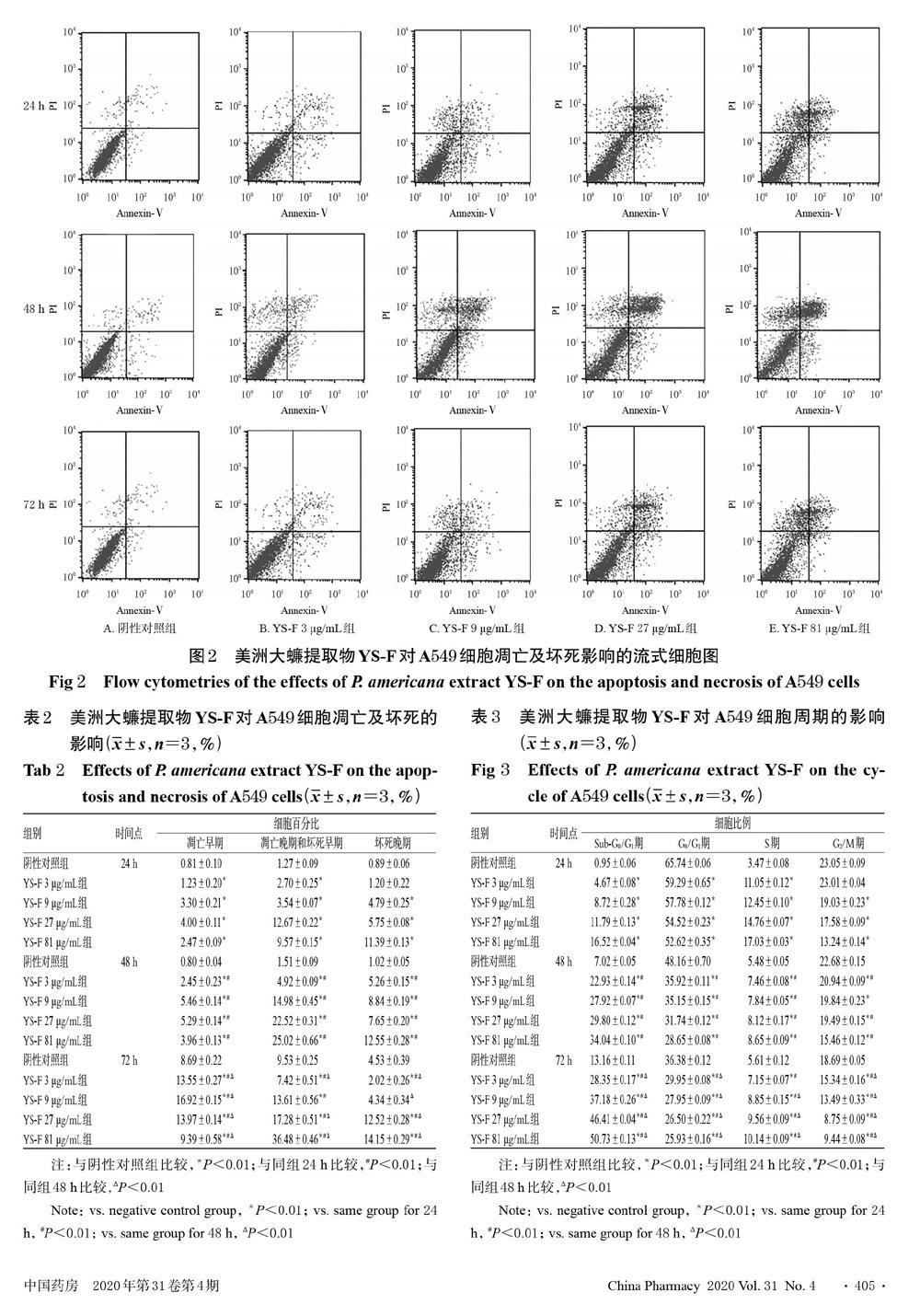
与阴性对照组比较,除YS-F 3 μg/mL作用24 h、YS-F 9 μg/mL作用72 h对坏死晚期细胞百分比无显著影响(P>0.05)外,其余各剂量组各时间点凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞百分比均显著升高,且药物作用48、72 h时的上述指标(除YS-F 9 μg/mL作用72 h时的坏死晚期细胞百分比外)均显著高于同组24 h,药物作用72 h(除YS-F 9 μg/mL组凋亡晚期和坏死早期细胞百分比无显著变化,YS-F 27 μg/mL组凋亡晚期和坏死早期细胞百分比以及YS-F 3、9 μg/mL组坏死晚期细胞百分比显著降低外)均显著高于同组48 h(P<0.01),详见图2、表2。
3.3 美洲大蠊提取物YS-F对A549细胞周期的影响
与阴性对照组比较,除YS-F 3 μg/mL作用24 h对G2/M期细胞比例无显著影响(P>0.05)外,其余各剂量组各时间点G0/G1期、G2/M期细胞比例均显著降低,Sub-G0/G1期、S期细胞比例均显著升高;且药物作用48、72 h时各剂量组G0/G1期、S期、G2/M期(除48 h YS-F 9 μg/mL组外)细胞比例均显著低于同组24 h,各剂量组Sub-G0/G1期、G2/M期(除48 h YS-F 3、9 μg/mL组外)细胞比例均显著高于同组24 h;药物作用72 h时各剂量组G0/G1期、G2/M期细胞比例均显著低于同组48 h,S期(除72 hYS-F 3 μg/mL组外)、Sub-G0/G1期细胞比例均显著高于同组48 h(P<0.01),详见表3、图3。
3.4 美洲大蠊提取物YS-F对A549细胞线粒体膜电位的影响
与阴性对照组比较,YS-F 9、27、81 μg/mL组细胞线粒体膜电位降低率均显著升高,且YS-F 27、81 μg/mL显著高于YS-F 9 μg/mL组,YS-F 81 μg/mL组显著高于YS-F 27 μg/mL组(P<0.01),详见图4、表4。
4 讨论
根据国际癌症研究机构的统计数据显示,肺癌在世界范围内的发病率呈逐年上升趋势,已成为严重的公共卫生问题[9]。肺癌的临床治疗以手术为主,但术后复发性高,患者远期生存率偏低、疗效欠佳[10]。因此,寻找毒副作用低且治疗效果好的肺癌治疗药物极有必要。据相关学者报道,美洲大蠊提取物具有抑制人及小鼠肺癌细胞增殖、诱导细胞凋亡并阻滞其生长周期等作用[11-12],故推测美洲大蠊提取物具有一定的促凋亡作用。为此,本课题组开展了相关研究。
细胞凋亡是抑制肿瘤生长的主要方式之一,其中线粒体是调控细胞凋亡的主要细胞器之一[13]。本研究首先采用MTT法对美洲大蠊醇提物的不同体积分数甲醇洗脱部位的增殖抑制活性进行了筛选。结果显示,醇提物70%甲醇洗脱部位(YS-F)的IC50值最低,即增殖抑制活性最强,故以YS-F作为活性部位进行后续研究。结果显示,以不同剂量YS-F作用于A549细胞后,各剂量组各时间点的细胞抑制率均较阴性对照组显著升高,且48、72 h的抑制率显著高于同组24 h,72 h时的抑制率显著高于同组48 h,呈时间依赖性。
本研究进一步采用流式细胞术检测了不同剂量YS-F对A549细胞凋亡、周期、线粒体膜电位变化的影响。结果显示,YS-F 3 μg/mL作用24 h、YS-F 9 μg/mL作用72 h对坏死晚期细胞百分比,YS-F 3 μg/mL作用24 h对G2/M期细胞比例以及YS-F 3 μg/mL作用48 h对细胞线粒体膜电位降低率均无显著影响;其余各剂量组各时间点凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞百分比以及Sub-G0/G1期、S期细胞比例均较阴性对照组显著升高,G0/G1期、G2/M期细胞比例均较阴性对照组显著降低;且药物作用48、72 h时各剂量组凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞百分比(除YS-F 9 μg/mL作用72 h时的坏死晚期细胞百分比外)以及Sub-G0/G1期、G2/M期(除48 h YS-F 3、9 μg/mL组外)细胞比例均显著高于同组24 h,而G0/G1期、S期、G2/M期(除48 h YS-F 9 μg/mL组外)细胞比例均显著低于同组24 h;药物作用72 h时各剂量组凋亡早期、凋亡晚期和坏死早期、坏死晚期细胞百分比(除YS-F 27 μg/mL作用72 h时的凋亡晚期和坏死早期细胞百分比以及YS-F 3、9 μg/mL作用72 h时的坏死晚期细胞百分比显著降低外)以及S期(除YS-F 3 μg/mL组外)、Sub-G0/G1期细胞比例均显著高于同组48 h,而G0/G1期、G2/M期细胞比例均显著低于同组48 h。由此可见,随着美洲大蠊提取物YS-F作用时间的延长,G0/G1、G2/M期细胞百分比均有所减少;而当药物作用72 h时,S期的细胞比例高于同组48 h,这可能与细胞自身凋亡增加有关。此外,在G0/G1期之前存在明显的细胞凋亡期(Sub-G0/G1),这进一步提示了YS-F可诱导细胞凋亡,且具有一定的时间依赖性。此外,作用48 h后,YS-F 9、27、81 μg/mL组细胞线粒体膜电位降低率均显著升高,且YS-F 27、81 μg/mL组显著高于YS-F 9 μg/mL组,YS-F 81 μg/mL组显著高于YS-F 27 μg/mL组。这提示YS-F可激活线粒体介导的细胞凋亡途径,诱导A549细胞凋亡,并具有一定的剂量依赖性。笔者推测这种抗肿瘤作用可能与YS-F中含有肌苷、腺苷、次黄嘌呤等核苷类成分有关[14-15],有待后续成分研究予以确认。
综上所述,YS-F可通过阻滞细胞从S期向G2/M期转化、降低线粒体膜电位等途径来抑制人肺癌细胞A549的增殖并促进其凋亡,且这种作用具有时间或剂量依赖性。但本研究并未考察YS-F对人正常肺上皮细胞的影响,因此其对正常肺上皮细胞的杀伤作用尚需进一步验证;同时,有关YS-F调节线粒体内凋亡的相关信号通路和分子靶点仍有待后续研究进一步完善。
(致谢:本研究在大理大学昆虫生物医药研发重点实验室完成,感謝实验室的老师和同学对本文的指导和帮助)
参考文献
[ 1 ] 唐苗,余万鑫,吴桃清,等.美洲大蠊提取物Ento-A对免疫抑制小鼠免疫功能的影响[J].中国药理学通报,2018,34(1):72-76.
[ 2 ] 孙星衍.神农本草经[M].北京:商务印书馆,1955:90.
[ 3 ] 常旭,王聪,欧红利,等.美洲大蠊多肽对MFC荷瘤小鼠免疫影响的初步探究[J].免疫学杂志,2017,33(7):564-569.
[ 4 ] 桑文涛,邹俊波,杨胜群,等.美洲大蠊抗菌作用研究现状[J].中药与临床,2016,7(5):57-60.
[ 5 ] 唐霞光,张春妹,刘嘉,等.美洲大蠊不同提取物清除自由基及抗脂质过氧化活性研究[J].食品工业科技,2016,37(13):83-85、91.
[ 6 ] 蒋永新,王熙才,金从国,等.美洲大蠊提取物对小鼠3LL肺癌的抑制作用及其机制探讨[J].中国肺癌杂志,2006,9(6):488-491.
[ 7 ] 张丹,朱伟,余昕,等.美洲大蠊多肽提取物对SMMC- 7721细胞凋亡及Bcl-2和Bax蛋白表达的影响[J].中国医院药学杂志,2017,37(4):328-332.
[ 8 ] CHEN PP,MA XY,LIN Q,et al. Kangfuxin promotes apoptosis of gastric cancer cells through activating ER stress and autophagy[J]. Mol Med Rep,2017,16(6):9043- 9050.
[ 9 ] 国际癌症研究机构. 2018年全球癌症发病率(World)统计[EB/OL]. [2018-12-31]. http://gco.iarc.fr/.
[10] LEMJABBAR-ALAOUI H,HASSAN OU,YANG YW,et al. Lung cancer:biology and treatment options[J]. Biochim Biophys Acta,2015,1856(2):189-210.
[11] 胡艳芬,吕小满,刘光明,等.美洲大蠊提取物对两株人肺癌细胞的影响[J].药物分析杂志,2011,31(7):1245- 1250.
[12] 李婷,乔婷婷,刘俊勇,等.美洲大蠊提取物逆转Bel- 7402/5-FU多药耐药性实验研究[J].大理大学学报,2017,2(2):1-6.
[13] LI J,WU DD,ZHANG JX,et al. Mitochondrial pathway mediated by reactive oxygen species involvement in α-hederin-induced apoptosis in hepatocellular carcinoma cells[J]. World J Gastroenterol,2018,24(17):1901- 1910.
[14] 李远辉.康复新胃漂浮片的药学研究[D].成都:成都中医药大学,2015.
[15] DOM?NGUEZ-?LVAREZ J,MATEOS-VIVAS M,RODR?GUEZ-GONZALO E,et al. Determination of nucleosides and nucleotides in food samples by using liquid chromatography and capillary electrophoresis[J]. TrAC,2017. DOI:10.1016/j.trac.2017.04.005.
(收稿日期:2019-06-21 修回日期:2019-12-05)
(编辑:张元媛)
