术苦芩多糖对湿热泄泻仔猪小肠Notch信号通路干预的探究
2020-03-13林春发郝永峰西南大学动物科学学院中兽医系重庆荣昌402460重庆市高校兽医科学工程研究中心中兽药创新研发实验室重庆荣昌402460
林春发,郝永峰,刘 娟,2∗ (.西南大学 动物科学学院中兽医系,重庆 荣昌402460;2.重庆市高校兽医科学工程研究中心 中兽药创新研发实验室,重庆 荣昌402460)
仔猪湿热泄泻是暑月炎天常发病症,常导致仔猪小肠肠黏膜损伤。Notch信号通路是由Notch受体、Notch配体以及细胞内效应器分子3部分组成,是1条依赖于细胞间相互接触传递的保守信号通路[1],既可促进肠黏膜上皮细胞的增殖,在肠黏膜自我更新及维护肠黏膜完整性中也起着重要作用,又可决定肠黏膜上皮细胞的分化命运,调控肠黏膜上皮内不同细胞的数量和比例,从而维持肠道在不同环境下结构、功能的稳态[2]。Hes-1、Hath-1 作为Notch信号通路下游的主要靶基因,决定着肠道上皮细胞的分化。Hes-1被激活时,肠黏膜上皮细胞向吸收细胞系方向分化,Hath-1被激活时,肠黏膜上皮细胞将向分泌细胞系方向分化[3-5],影响小肠内分泌细胞的数量,维持不同环境下内环境的稳态。
复方术苦芩是由西南大学动物科学学院中药创新研究室研发,具有清热燥湿、健脾和胃、利水止泻等功效。前期研究[6]发现复方术苦芩在临床上对仔猪湿热泄泻治疗效果良好,通过改善胃肠功能、提高免疫、增强抗病能力、促进肠黏膜修复、改善机体各类细胞因子等来发挥主要作用[7]。为此,本试验通过检测复方术苦芩有效成分术苦芩多糖(ZKQPs)对湿热泄泻仔猪小肠Notch 信号通路中Notch-1、Hes-1和Hath-1的m RNA 表达量变化情况,进一步阐明复方术苦芩有效成分ZKQPs对湿热泄泻仔猪小肠损伤修复作用。
1 材料与方法
1.1 试验材料60只30~35日龄三元断奶仔猪(长×大×荣昌),体质量(10.0±0.3)kg,公母各半,由西南大学荣昌校区动物科学学院统一购买。复方术苦芩,由 白术(5.5 份)、苦参(2.0 份)、黄芪(6.5份)、金银 花(6.5 份)、白 头 翁(5.5 份)、栀 子(2.5份)、黄芩(6.5份)、广藿香(4.5份)组成,购自四川千金中药饮片有限公司(批号:160201);番泻叶:购于安徽省毫州市德昌药业有限公司,制备成每毫升含1 g生药的番泻叶提取液;白头翁散:重庆天龙牧业科技有限公司(批号:20170425)。RNA 提取试剂盒(UNIQ-10 柱式TRIzol总RNA 抽提试剂盒)购自生工生物工程(上海)股份有限公司;反转录试剂盒购自GoScriptTMReverse Transcription System;荧光定量试剂盒购自Ta KaRa SYBR®Premix ExTaqTMⅡ。
1.2 主要仪器设备酶标仪,BIO-RAD 公司i Mark;荧光定量PCR 仪,TU-1950 Roche公司;高通道组织破碎机,QIAGEN 公司Schwingmuhle TissuelyserⅡ;FX-IR170SX 型傅里叶变换红外光谱仪,美国Nicolet公司。
1.3 试验方法
1.3.1 药物的制备 ZKQPs提取制备与鉴定:参考文献[8-9],按比例称取所需药材共1 000 g,粉粹后加入8倍石油醚,置于多功能提取浓缩机组中,60℃回流提取3次;将药渣加入6倍75%乙醇,回流提取2次,合并滤液,回收乙醇至无乙醇味,得滤液A;将醇提后药物加入8 倍蒸馏水水提,提取3 次,得滤液B,合并滤液A、B,浓缩至1 g生药/m L,加入无水乙醇至含醇量达80%进行醇沉,4℃过夜,过滤,加水溶解滤渣,反复醇沉3次;将粗提的多糖加水溶解后,加入sevag试剂除蛋白(5 次以上,至几乎无蛋白);进行2次醇沉,最后分别依次加入无水乙醇、丙酮、乙醚进行洗涤、纯化(3次以上),将洗涤纯化后的多糖置于电热鼓风干燥箱30℃干燥过夜,得多糖。参照文献[10]对提取的ZKQPs进行红外光谱鉴定,取2~3 mg ZKQPs及适量溴化钾,将其倒入玛瑙研钵中混匀,压片,然后放入傅里叶红外光谱仪进行测试。选择4 000和400 cm-1作为光谱基线起止点,计算特征峰的高度比,检测其是否存在糖苷键及糖的主要官能团。
番泻叶提取液:将番泻叶水提3次,浓缩为1 g生药/m L的溶液。
1.3.2 动物分组与处理 参考文献方法[11],将适应性饲养1周的断奶仔猪60头随机分为A、B 2组,A组为空白对照组(10头),饲养于湿度65%~75%,25~27℃的圈舍中,给予正常饲料、自由饮水;B 组为造模组(50头),将其饲喂于35~38℃,相对湿度90%~95%的圈舍中,并饲喂高脂配合饲料(猪油18%+蔗糖1%+酒糟5%,连续10 d,隔天加入1%番泻叶提取液)、自由饮水。将B 组造模成功后的50头仔猪随机分为模型组、阳性药物组、ZKQPs高、中、低剂量组,分圈饲养,饲喂正常仔猪配合饲料,自由饮水。ZKQPs高、中、低剂量组仔猪分别给药为75,50,25 mg/kg,2 次/d,阳性药物组仔猪给予白头翁散1.0 g/kg,于每天上午9点,下午15点,拌料给药2次,连续给药7 d。模型组与空白对照组仔猪,拌以等量生理盐水,正常饲喂饲料、自由饮水。
模型成功判定标准[7]:当仔猪出现精神沉郁(喜卧,不愿走动)、采食下降、口渴喜饮、排便次数增加、排稀粪或水样便、肛门红肿、肛周污秽、尿黄短赤、身体消瘦、被毛粗乱等症状时可判定模型建立成功。
1.3.3 ZKQPs对湿热泄泻仔猪疗效 试验期间观察仔猪临床症状变化,记录仔猪精神状态、采食状况、饮水量、粪形态、粪臭味、体温、尿短黄、被毛、肛门异常等情况,评价ZKQPs对仔猪湿热泄泻的疗效,计算有效率,有效率=(痊愈数+显效数+好转数)/总发病数×100%。
1.3.4 ZKQPs对湿热泄泻仔猪小肠组织中Notch-1、Hes-1、Hath-1 m RNA 的影响 试验结束后仔猪禁食12 h,每组随机选取3只仔猪颈静脉放血处死,剖解并采集小肠组织(十二指肠、空肠与回肠)。在每段小肠起始端2 cm 处采集各段小肠组织5 cm 冷冻保存,用于检测Notch-1、Hes-1、Hath-1表达。登录GenBank,根据已有的猪Notch-1、Hes-1 和Hath-1 和内参基因β-actin mRNA 核苷酸序列,利用Primer Premier 5.0 软件设计相对应的引物,由生工生物工程(上海)股份有限公司合成,引物信息见表1。仔猪小肠组织总RNA 提取严格参照UNIQ-10柱式TRIzol总RNA 抽提试剂盒说明书进行操作。使用Promega 反转录试剂盒(GoScriptTMReverse Transcription System),按照说明书方法将提取的总RNA 反转录成cDNA,在Roche Light Cycler 96荧光定量PCR 仪上扩增,共40个循环,每个样品3个重复。

表1 引物信息表
1.3.5 统计分析 用SPSS 20.0 软件进行数据处理。试验数据用图表和柱状图表示,采用单因素方差分析和多重比较实时荧光定量试验结果采用Bio-Rad CFX Manager 1.6软件分析统计,以GraphPad作图。
2 结果
2.1 傅里叶变换红外光谱法测定ZKQPs有效活性组分结果显示(图1),在红外光谱图4 000~400 cm-1的特征谱带中,3 404.96 cm-1有很强的振动,说明是-OH的 伸 缩 振 动 峰;1 741.82,1 625.79 cm-1存 在-COOH 收缩峰;1 402.64,1 262.81 cm-1处存在-C-H变角振动;在1 140.83,1 027.77,1 078.35 cm-1存在吡喃糖的特征吸收峰;834.38 cm-1处存在α-糖苷键。综上所述,ZKQPs为含α-糖苷键的酸性吡喃型多糖。
2.2 ZKQPs对湿热泄泻仔猪的疗效结果显示,造模第3天开始,造模组仔猪陆续开始出现食欲减退,饮水次数增加,精神沉郁,粪便开始不成形,在造模第5天仔猪出现粪便溏稀、泄泻如水样、且腥臭,采食量大幅下降,饮水量增加,仔猪逐渐消瘦,被毛粗乱逆立,肛周有污物、肛门红肿,可判定成功建立湿热泄泻模型。用药后仔猪临床症状出现好转;在给药第5天时,仔猪粪便基本成形,采食、饮水恢复正常。ZKQPs 高、中、低剂量组的有效率分别为90%,80%和70%;ZKQPs高、中、低剂量组的治愈率分别为80%,80%和50%(表2)。
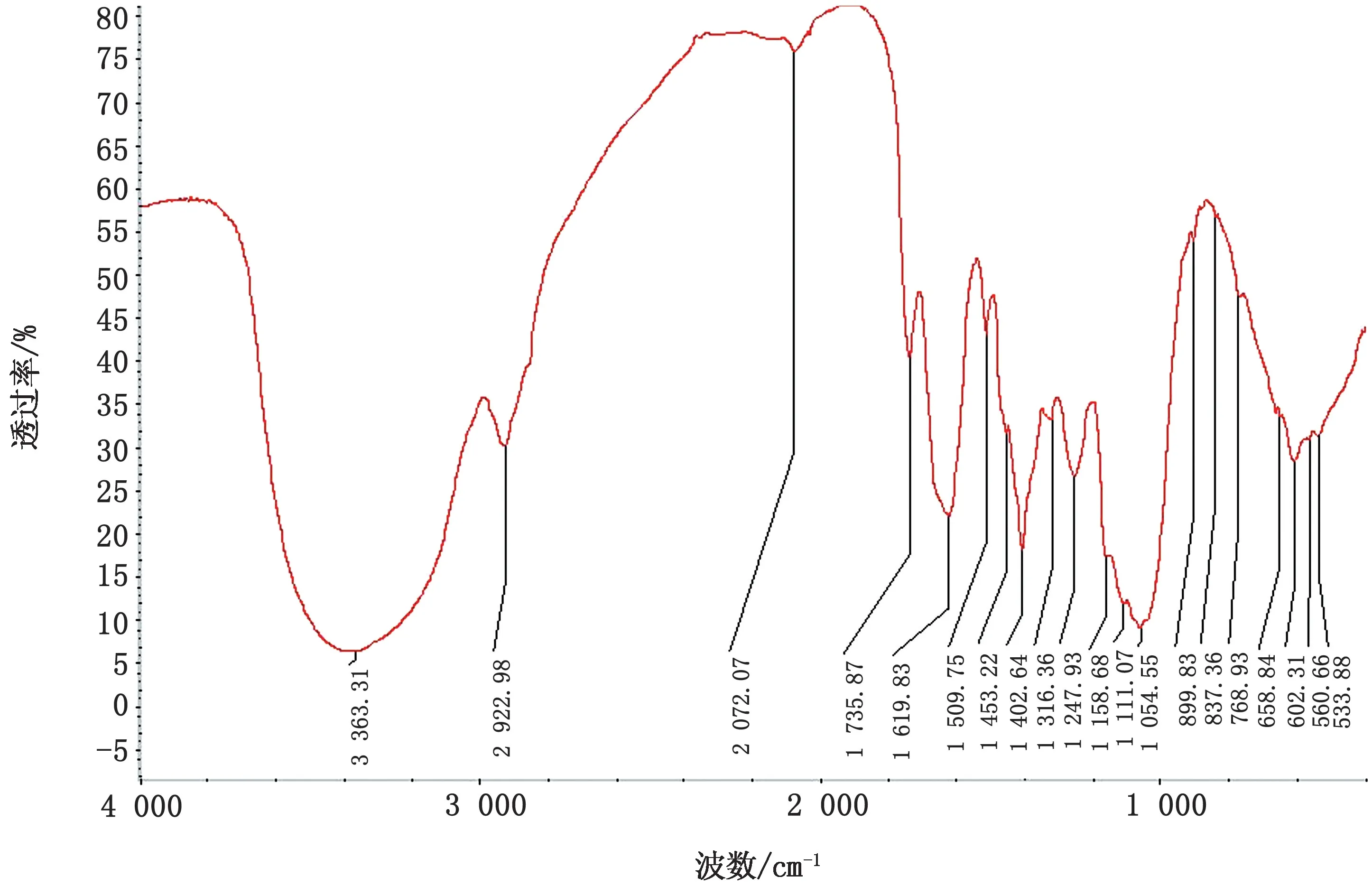
图1 ZKQPs红外光谱图
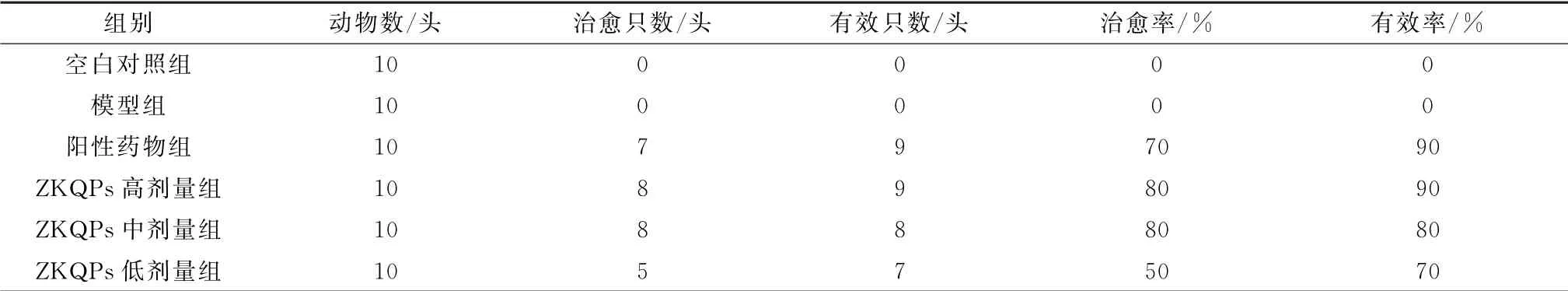
表2 ZKQPs对湿热泄泻仔猪临床治疗效果统计
2.3 ZKQPs对湿热泄泻仔猪小肠组织中Notch-1mRNA表达水平的影响试验结果显示,模型组仔猪十二指肠中Notch-1 mRNA 的表达量升高;ZKQPs各剂量组仔猪十二指肠的Notch-1 m RNA表达量均降低,ZKQPs高剂量组仔猪十二指肠中Notch-1 m RNA 的表达量,与模型组比较,差异显著(P<0.05)(图2A)。如图2A。模型组仔猪空肠中Notch-1 m RNA 的表达量升高;ZKQPs各剂量组仔猪空肠中Notch-1 mRNA 表达量均降低,与模型组比较,差异不显著(P>0.05)(图2B)。模型组仔猪回肠中Notch-1 m RNA 的表达量升高;ZKQPs高、中、低剂量组仔猪回肠的Notch-1 mRNA 的表达量均降低,与模型组比较,差异极显著(P<0.01)(图2C)。
2.4 ZKQPs对湿热泄泻仔猪小肠组织中Hes-1 mRNA表达水平的影响试验结果显示,模型组仔猪十二指肠中Hes-1 mRNA 的表达量升高;ZKQPs各剂量组仔猪十二指肠中Hes-1 m RNA 表达量均降低,其中ZKQPs高、中剂量组仔猪十二指肠中Hes-1 m RNA 的表达量,与模型组比较,差异极显著(P<0.01)(图3A)。模型组仔猪空肠中Hes-1 mRNA 的表达量升高;ZKQPs各剂量组仔猪空肠的Hes-1 mRNA 表达量均降低,其中ZKQPs高、中剂量组仔猪空肠中Hes-1 m RNA 的表达量,与模型组比较,差异极显著(P<0.01)(图3B)。模型组仔猪回肠中Hes-1 mRNA 的表达量升高;ZKQPs高、中、低剂量组仔猪回肠中Hes-1 mRNA 表达量均降低,与模型组比较,差异极显著(P<0.01)(图3C)。
2.5 ZKQPs对湿热泄泻仔猪小肠组织中Hath-1 mRNA表达水平的影响试验结果显示,模型组仔猪十二指肠中Hath-1 m RNA 的表达量降低;ZKQPs高、中、低剂量组仔猪十二指肠中Hath-1 mRNA的表达量均升高,与模型组比较,差异极显著(P<0.01)(图4A)。模型组仔猪空肠中Hath-1 m RNA的表达量降低;ZKQPs高、中、低剂量组仔猪空肠的Hath-1 m RNA 的表达量均升高,与模型组比较,差异极显著(P<0.01)(图4B)。模型组仔猪回肠中Hath-1 m RNA 的表达量降低;ZKQPs高、中、低剂量组仔猪回肠的Hath-1 mRNA 表达量均升高,与模型组比较,差异极显著(P<0.01)(图4C)。

图2 仔猪各肠段组织Notch-1 mRNA 相对表达量 A.十二指肠组织Notch-1 m RNA 相对表达量;B.空肠组织Notch-1 m RNA 相对表达量;C.回肠组织Notch-1 m RNA 相对表达量;1.空白对照组;2.模型组;3.阳性药物组;4.ZKQPs高剂量组;5.ZKQPs中剂量组;6.ZKQPs低剂量组。下同
3 讨论
仔猪湿热泄泻多由高热、高湿的环境使湿邪、热毒集聚仔猪体内,出现泄泻现象。肠道是机体摄取营养物质消化吸收的主要场所、是体内最大的免疫组织器官、是保证机体内环境稳态的重要保障[12-13]。肠道黏膜层是肠道发挥其免疫功能的主要部位所在,主要包括黏膜上皮、固有层、黏膜肌肉层等。肠上皮细胞为单层柱状细胞并弯曲褶皱形成绒毛-隐窝结构,肠黏膜上皮细胞主要由吸收细胞、杯状细胞和内分泌细胞3 部分组成,是肠道内、外环境的界面,是食物消化、营养吸收、免疫等功能的主要组织细胞,也是肠道黏膜屏障的主要构筑成分[14]。赵燕飞等[15]研究发现白术多糖具有改善小肠黏膜结构和改善小肠营养物质吸收的功能,多糖可从很多方面对肠道屏障进行修复;不仅可通过在肠上皮细胞表面形成类似于肠道屏障黏液层的亲水凝胶层,也能通过降低肠黏膜通透性使肠道屏障得到保护[16-17]。复方术苦芩有效成分ZKQPs是由前期有效的处方复方术苦芩提取而来,经红外光谱鉴定证明为多糖物质。本试验结果显示,经ZKQPs治疗后,ZKQPs高、中、低剂量组的治愈率分别为80%,80%和50%;ZKQPs高、中、低剂量组的有效率分别为90%,80%和70%;表明ZKQPs对仔猪湿热泄泻有良好的治疗效果。
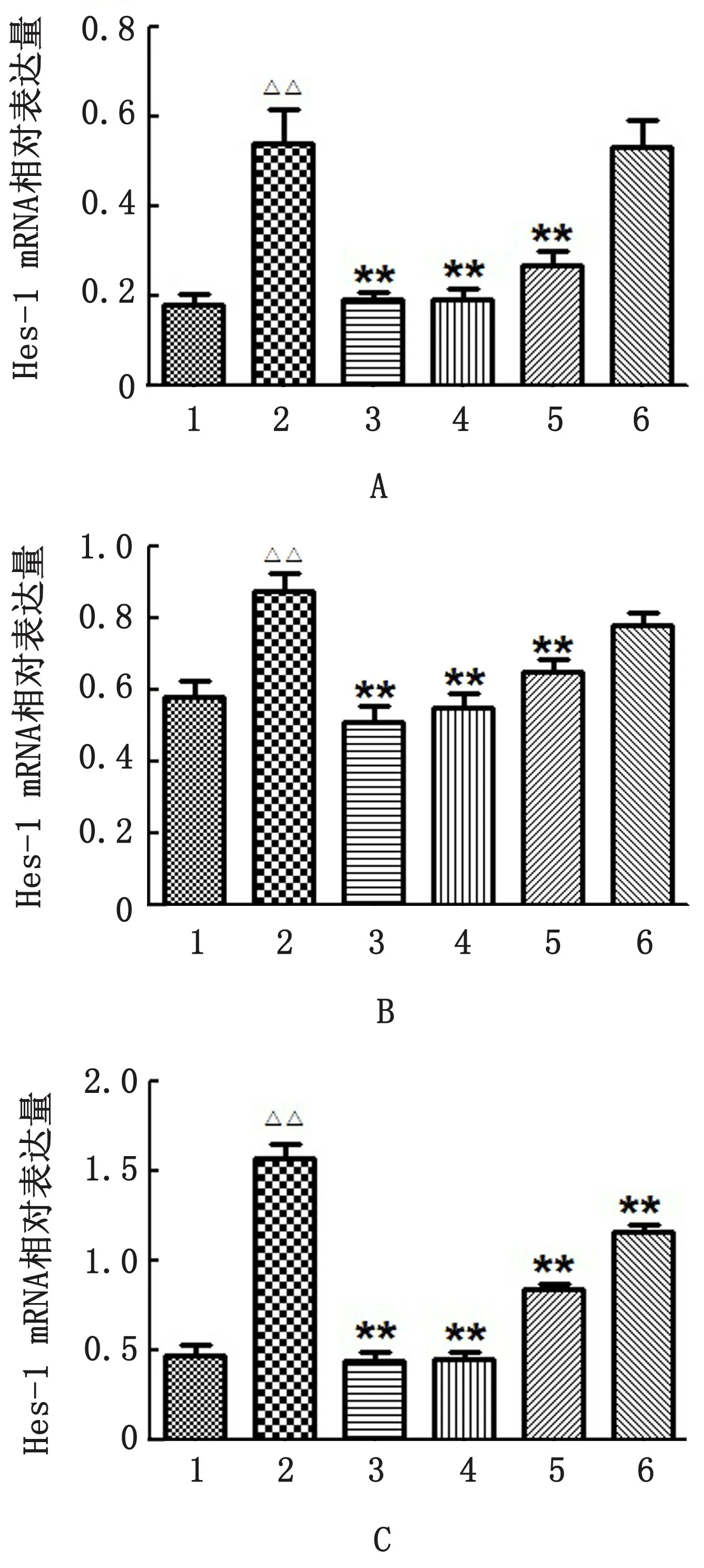
图3 仔猪各肠段组织Hes-1 m RNA 相对表达量 A.十二指肠组织Hes-1 mRNA 相对表达量;B.空肠组织Hes-1 m RNA 相对表达量;C.回肠组织Hes-1 m RNA相对表达量

图4 仔猪各肠段组织Hath-1 m RNA 相对表达量 A.十二指肠组织Hath-1 mRNA 相对表达量;B.空肠组织Hath-1 m RNA 相对表达量;C.回肠组织Hath-1 m RNA 相对表达量
Notch信号通路是一条依赖于细胞间相互接触传递的保守信号通路,在动物发育过程中发挥着极为重要的作用;Notch 信号通路是由Notch受体、配体与DNA 蛋白结合而成的,在哺乳动物体内主要有Notch-1~4 4种受体,其中Notch-1主要分布在肠道之中[18-20]。作为Notch 信号通路下游主要靶基因Hes-1、Hath-1 决定着肠道上皮细胞的分化[21-22],当Notch-1激活后,激活靶基因Hes-1时,肠黏膜上皮细胞向吸收细胞系方向分化,当Notch-1与Hes-1被抑制,而Hath-1激活时,肠黏膜上皮细胞将向分泌细胞系方向分化[23-24]。Notch信号通路促使肠黏膜上皮内不同细胞间的数量和比例各不相同,从而维持不同的环境条件下肠道结构的完整性、基本生理正常水平和内环境的稳态。本试验结果显示,当仔猪发生湿热泄泻时,仔猪小肠各肠段中的Notch-1、Hes-1表达量升高,Notch 信号通路中的Notch-1受体及Hes-1配体被激活,作为Hes-1竞争性配体Hath-1,在Notch-1受体及Hes-1配体被激活时受到抑制,从试验结果也能看出Hath-1的表达量在仔猪发生湿热泄泻时是降低,这是由于Notch-1受体及Hes-1配体的激活会使肠黏膜上皮细胞向吸收细胞系方向分化,分泌细胞相应减少,进而导致小肠内黏液及相关物质分泌不足,出现各种致病因素更加直接的侵袭小肠黏膜,使小肠黏膜受到损伤,病情加重。经ZKQPs治疗后发现,仔猪小肠各肠段Notch-1、Hes-1的表达量降低,与之相反Hath-1的表达量升高;ZKQPs通过影响湿热泄泻仔猪小肠Notch 信号通路中Notch-1、Hes-1 和Hath-1的表达量,达到修复小肠肠黏膜的作用。综上所述,ZKQPs 对湿热泄泻仔猪有治疗效果。ZKQPs作用机理与其降低仔猪小肠Notch信号通路中Notch-1、Hes-1的表达量和升高Hath-1的表达量,以发挥ZKQPs对湿热泄泻仔猪小肠肠黏膜的修复作用,维护肠黏膜完整性有关。
