14型蓝舌病病毒VP7蛋白原核表达及间接ELISA抗体检测方法的建立
2020-03-13张莹辉杜吉革李启红陈小云姚文生钱莺娟印春生
孙 雯,张莹辉,曹 雨,朱 真,杜吉革,李启红,陈小云,姚文生,钱莺娟,印春生∗
(1.中国兽医药品监察所,北京100081;2.南京农业大学 动物医学院,江苏 南京210095)
蓝舌病(bluetongue,BT)是由蓝舌病病毒(bluetongue virus,BTV)引起的传播于绵羊、山羊、牛等反刍动物之间的传染病。BTV 主要通过库蠓对反刍动物的叮咬传播,被感染动物通过水平传播感染其他反刍动物或通过胎盘屏障进行垂直传播。BT 被世界动物卫生组织(OIE)列为法定报告的动物疫病,在我国将其列为一类疫病,作为发现必须申报的动物传染病[1]。目前已发现的BTV 有27种不同血清型,不同血清型之间无交叉保护作用,不同血清型致病力不同,感染反刍动物的临床症状表现差异明显[2]。目前,在对国内29个省区进行BTV 血清病学调查中,检测出BTV1~4、BTV12、BTV15、BTV16等7个血清型,其中BTV1和BTV16为主要致病血清型[3]。BTV14最早在非洲国家发现,并在热带地区传播。2011 年,BTV14 首次在欧洲的俄罗斯被发现,随后相继在立陶宛,西班牙等国出现。2012年,在波兰政府的监测中发现了BTV14,而波兰在此前从未发现BTV。经过同源性比对分析发现,在欧洲地区流行的BTV14 与南非的BTV14疫苗毒株高度同源[4],可表明BTV14有由热带向高纬度地区扩散的趋势。我国目前虽然还未有BTV14出现的相关报道,但是随着国际贸易往来的频繁和全球气候的变化,BTV14传入我国的风险变大。虽然BTV14 本身致病性不高,但是从波兰监测BTV 的经验来看,BTV14可作为监测BTV传播趋势的指示[5]。因此,有必要做好BTV14的相关检疫监测工作。
BTV 属于呼肠孤病毒科,环状病毒属蓝舌病病毒亚群(bluetongue virus subgroup)。呼肠孤病毒(reoviridae)的共同特征是其基因组都为由10到12条线性双链RNA 组成[6],共编码5种非结构蛋白NSl~NS4、NS3a和7 种结构蛋白VP1~VP7[7]。其中VP7蛋白也为BTV 核心蛋白,占内衣壳蛋白的36%[8]。VP7具有群特异性抗原决定位点,为主要血清群特异性抗原。因为VP7蛋白序列高度保守且能刺激被感机体产生强的群特异性免疫反应。所以VP7蛋白是用于建立BTV 群特异性血清学检测方法的最佳选择[9]。BTV 的VP7蛋白为高度保守蛋白,不同血清型之间的同源性高达94%。VP7蛋白可诱导产生中和抗体,可用于建立BTV 特异性血清学检测方法,也可作为检测BTV 抗体的抗原[10]。所以选用VP7蛋白建立特异性血清学诊断方法。本研究应用p ET-32a为表达载体,对群特异性VP7蛋白进行原核表达及纯化,运用ELISA 方法鉴定其免疫原性,为后续方法建立及单克隆抗体制备提供支持。
1 材料与方法
1.1 试验材料14型BTV 由中国兽医药品监察所分离鉴定和保存;p ET-32a原核表达载体、Vero细胞均为本试验室保存;大肠杆菌高质粒拷贝菌株DH5α和蛋白表达菌株Rosetta(DE3)感受态细胞均购自大连宝生物公司。
1.2 主要试剂KOD 高保真DNA 聚合酶购自日本TOYOBO 公司,Bam H I、XhoⅠ等限制性内切酶、DNA T4连接酶购自NEB 公司,DNA Marker,蛋白Marker为大连宝生物公司产品,病毒RNA 提取试剂盒,反转录试剂盒,胶回收试剂盒,质粒DNA小量提取试剂盒购自美国Omega Bio-Tek 公司,IPTG 购自天根生物有限公司,考马斯亮蓝购自上海生工生物工程。
1.3 s 7基因的扩增与重组表达质粒构建
1.3.1 引物的设计与合成 根据GenBank 中的BTV14的s7基因(KY092033.1),利用Primer 5.0软件设计引物,引物由上海生工生物公司合成,设计的引物如下(表1):

表1 扩增VP7基因引物
1.3.2 病毒RNA 的提取及s7基因的扩增 利用OMEGA 病毒RNA 提取试剂盒对感染14型BTV的Vero 细胞进行RNA 提取,利用下游引物BTV14-VP7-R/XhoⅠ反转录成cDNA。以cDNA为模板对VP7 基因进行扩增,扩增条件为:94℃2 min;98℃10 s;50℃30 s;68℃45 s;68℃5 min;33个循环。PCR 扩增结束后,配制1%核酸胶进行凝胶电泳鉴定,并进行胶回收。
1.3.3 重组表达质粒的构建 对扩增后胶回收的s7片段和载体pET-32a分别进行Bam HⅠ和XhoⅠ双酶切,酶切产物经胶回试剂盒,使用T4DNA Ligase进行连接,反应时间为12 h,反应温度为16℃。将连接产物转化到感受态细胞DH5α,转化产物涂布于Amp 抗性的LB 平板上,37℃培养过夜,挑取平板上的单菌落,37℃摇菌培养12~14 h,利用OMEGA 质粒DNA 小量提取试剂盒进行质粒提取。将质粒送中美泰和生物公司进行测序。将测序鉴定正确的质粒命名为p ET-32a-VP7。
1.4 VP7 蛋白的表达及鉴定将构建好的质粒p ET-32a-VP7和空载体p ET-32a分别转化到蛋白表达菌株Rosetta(DE3)感受态细胞内。表达诱导方法:在第1天晚上9:00左右接种到具有Amp抗性LB培养基中,置于摇床上,37℃,250 r/min 过夜。次日上午9:00 按照1∶100 转接于新的含Amp抗性50 m L LB培养基的锥形瓶中,置于摇床上,37℃,250 r/min,4~6 h,取100 μL 菌 液 测D600nm值,直到D600nm值达到0.5~0.6即可取出锥形瓶,先取出1 m L菌液作为未诱导对照,再加入确定终浓度的诱导剂IPTG,在合适的诱导温度下继续培养,诱导结束后收集菌液,将未诱导和诱导后菌液均离心后弃去上清培养基,加入无菌PBS重悬沉淀,进行超声波裂解,直至溶液清亮,10 000 r/min,离心5 min,分别收集包涵体沉淀和裂解上清。SDS-PAGE电泳进行可溶性分析鉴定。并对表达产物经SDS-PAGE 电泳后进行转印,利用HIS 标签的单克隆抗体进行Western blot鉴定。
1.5 VP7表达蛋白的纯化及鉴定大量诱导表达BTV14的VP7蛋白。原核表达载体p ET-32a自身带有的His标签是重组VP7蛋白的识别标签,使用镍柱进行表达蛋白的纯化,目的蛋白能与镍离子结合,其他杂蛋白通过洗涤液与目的蛋白分离,去除杂蛋白,最后通过含有咪唑洗脱液,将目的蛋白从镍离子柱上洗脱下来,得到纯化后的VP7蛋白。对纯化后的蛋白使用BCA 蛋白浓度测定试剂盒进行浓度定量测定,并进行SDS-PAGE电泳进行可溶性分析鉴定和Western blot鉴定。通过SDS-PAGE 凝胶电泳结果分析可知重组蛋白VP7在经过优化诱导温度后,仍以包涵体形式存在于菌体中,所选用含有尿素的缓冲液先对菌体沉淀进行变性和复性。再将复性后的菌体蛋白进行纯化,并进行Western blot鉴定。
1.6 间接ELISA检测方法的建立
1.6.1 抗血清的制备 复苏Vero 细胞,按照10 MOI病毒量大量扩增病毒,收集病毒上清500 m L。将收集的500 m L 病毒上清进行浓缩,浓缩后的病毒置于15%~60%浓度的蔗糖中,进行蔗糖密度梯度离心纯化病毒,用分光光度仪测定纯化后蛋白含量。将病毒与等体积弗氏佐剂混合形成油包水的乳糜状,按照每只山羊免疫1 g蛋白,每隔2周加强免疫1次,加强免疫时采用不完全弗氏佐剂与病毒等体积混匀。从第3次免疫开始,每次免疫后1周对免疫羊进行颈静脉采血,分离血清,分装后储存于-20℃。分离血清后,使用表达制备的VP7蛋白作为包被抗原,利用间接ELISA 检测血清中VP7蛋白的抗体效价。
1.6.2 间接ELISA 方法建立 本试验用间接ELISA 方法检测羊高免血清中所含VP7抗体的效价,将纯化后的VP7蛋白作为抗原包被于固相载体上,1.6.1中制备的羊高免血清抗体与抗原结合。通过洗板去除未结合物,再加入HRP 标记的兔抗羊酶标抗体,最后通过加入能与酶反应的底物显色,通过读取D450nm值进行定量判断。
抗原最佳包被浓度及抗体最佳稀释比例的确定:应用棋盘滴定法,将1 mg纯化后VP7蛋白抗原按照1 ∶50,1∶100,1∶200,1∶400,1∶800,1∶1 600 的稀释度包被到酶标板中,每孔100μL;将阳性和阴性血清同样进行倍比稀释,分别为1∶10,1∶20,1∶40,1∶80,1∶160,1∶320,1∶640,1∶1 280 稀释倍数,每孔100μL 加入酶标板。操作步骤按照常规间接ELISA 方法进行。
酶标二抗稀释度优化:将HRP 标记的兔抗羊IgG 酶标抗体用PBST 进行1∶1 000,1∶3 000,1∶5 000,1∶10 000,1∶20 000 共5 个稀释度稀释。根据间接ELISA 试验结果确定酶标抗体的最佳使用浓度。
底物显色时间优化:使用TMB 底物避光显色5,10,15和20 min。根据间接ELISA 试验结果选择最佳底物作用时间。
判定标准确定:取无BTV 免疫史和感染史的30份健康羊血清,用已建立的间接ELISA 方法进行试验,读取D450nm值,计算出30 份阴性血清的D450nm值的平均值和标准误计算出临界值(阴阳性临界值)。当样品血清的D450nm大于时,判定为阳性,当样品血清D450nm小于等于时,可判定为阴性。
1.6.3 间接ELISA 方法的敏感性和特异性鉴定 敏感性试验:已知的80份血清进行倍比稀释,同时进行中和抗体检测(VN)和间接ELISA 方法检测,根据阴阳性临界值比较2种方法能检测到的阳性血清数量,判断建立ELISA 方法的敏感性。
特异性试验:使用已经建立的间接ELISA 同时检测2份羊痘阳性血清,2份羊口蹄疫阳性血清和2份羊的小反刍兽疫阳性血清,每份血清做3个平行重复,并设置阳性、阴性血清对照,确定该方法的特异性。
2 结果
2.1 s 7基因的扩增以BTV14型的cDNA 为模版,BTV14-VP7-F和BTV14-VP7-R为上、下游引物,扩增出s7全长基因片段,大小为1 050 bp(图1)。
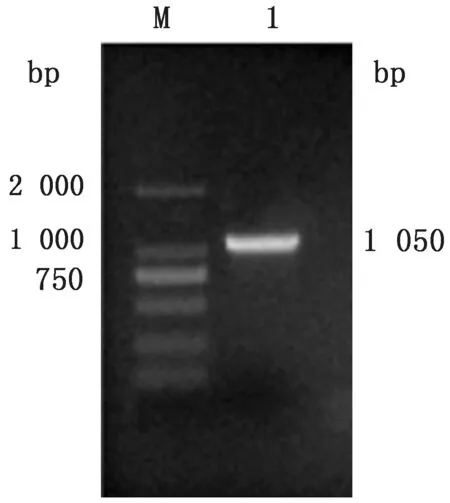
图1 s7 基因PCR 扩增结果 M.DL2000 DNA Marker;1.s7基因扩增产物
2.2 重组表达质粒p ET-32a-VP7 的构建用Bam HⅠ和XhoⅠ对目的片段进行双酶切后连接于酶切后的pET-32a载体上,对质粒进行双酶切鉴定,鉴定正确后送测序,测序结果正确。p ET-32a-VP7构建成功(图2)。
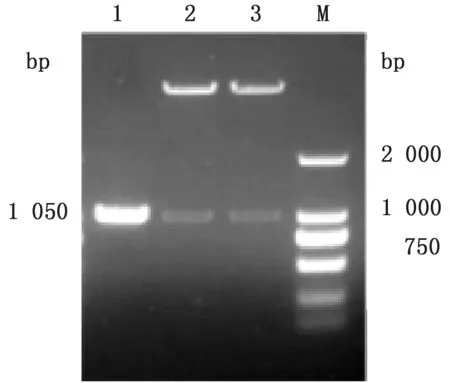
图2 pET-32a-VP7 双酶切鉴定结果 M.DL2000 DNA Marker;1.s7基因扩增产物;2.p ET-32a-VP7双酶切产物;3.p ET-32a-VP7双酶切产物
2.3 VP7蛋白的表达及可溶性分析将收集到的包涵体沉淀和裂解上清,经Western blot分析,结果显示上清和包涵体中均获得清晰的目的条带(图3),结果表明VP7蛋白能够与HIS标签融合表达。
2.4 VP7蛋白的纯化通过SDS-PAGE 凝胶电泳结果可知,目的蛋白VP7以包涵体形式存在于菌体中,所选用含有尿素的缓冲液对菌体沉淀进行纯化。对纯化后的蛋白使用BCA 蛋白浓度测定试剂盒进行浓度定量测定。并对纯化后的蛋白进行可溶性分析和Western blot分析。结果显示纯化后的蛋白无明显杂蛋白,获得清晰的目的条带(图4,5)。
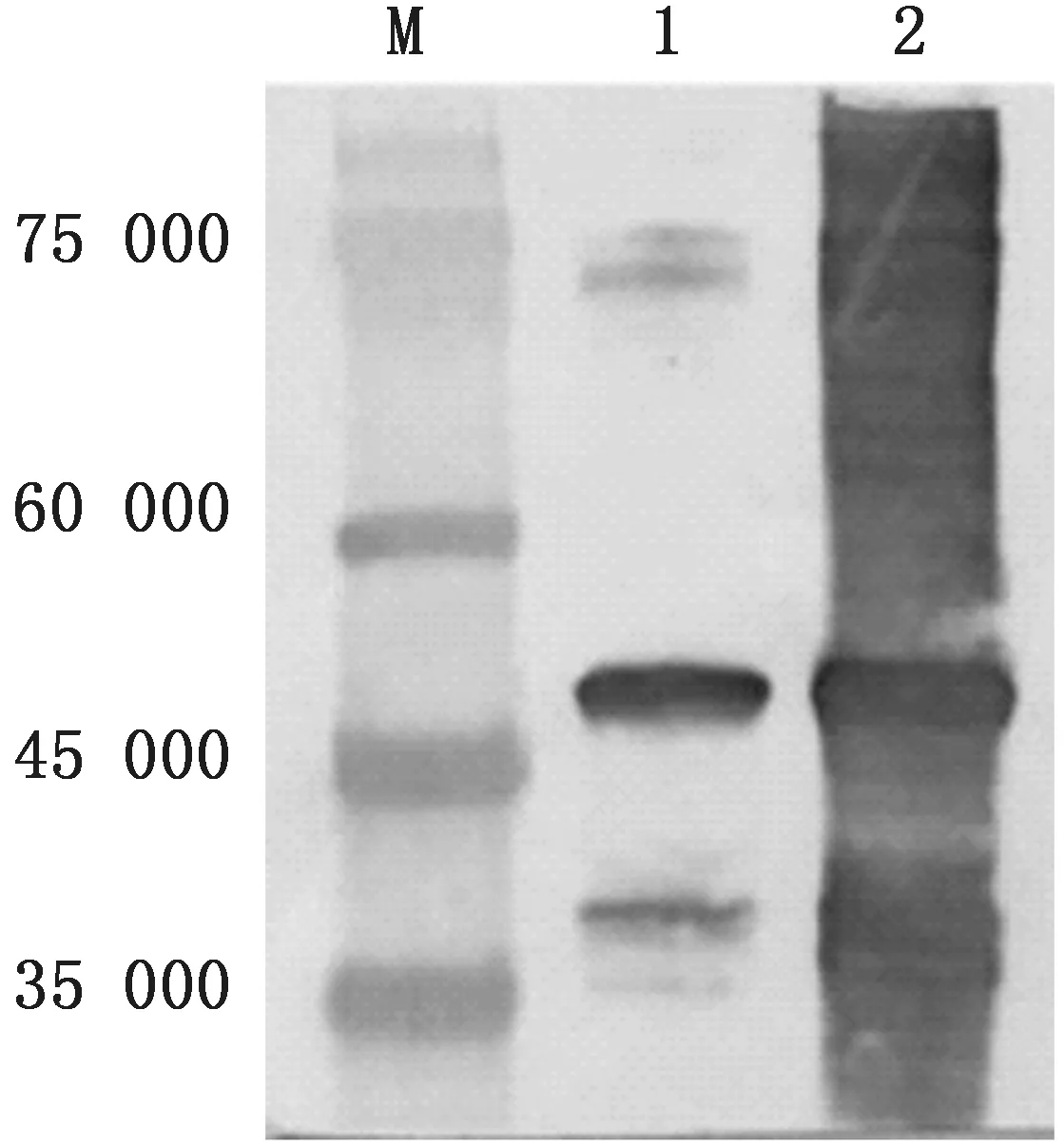
图3 VP7 的Western blot检测 M.蛋白Marker;1.pET-32a-VP7裂解上清;2.pET-32a-VP7包涵体沉淀
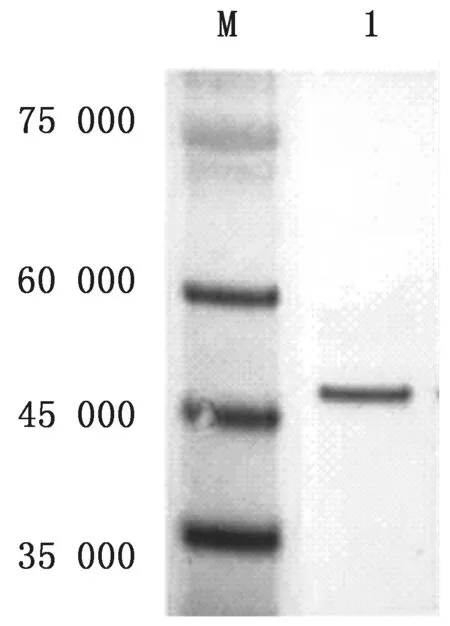
图4 纯化后VP7蛋白SDS-PAGE 分析 M.蛋白Marker;1.p ET-32a-VP7纯化后蛋白
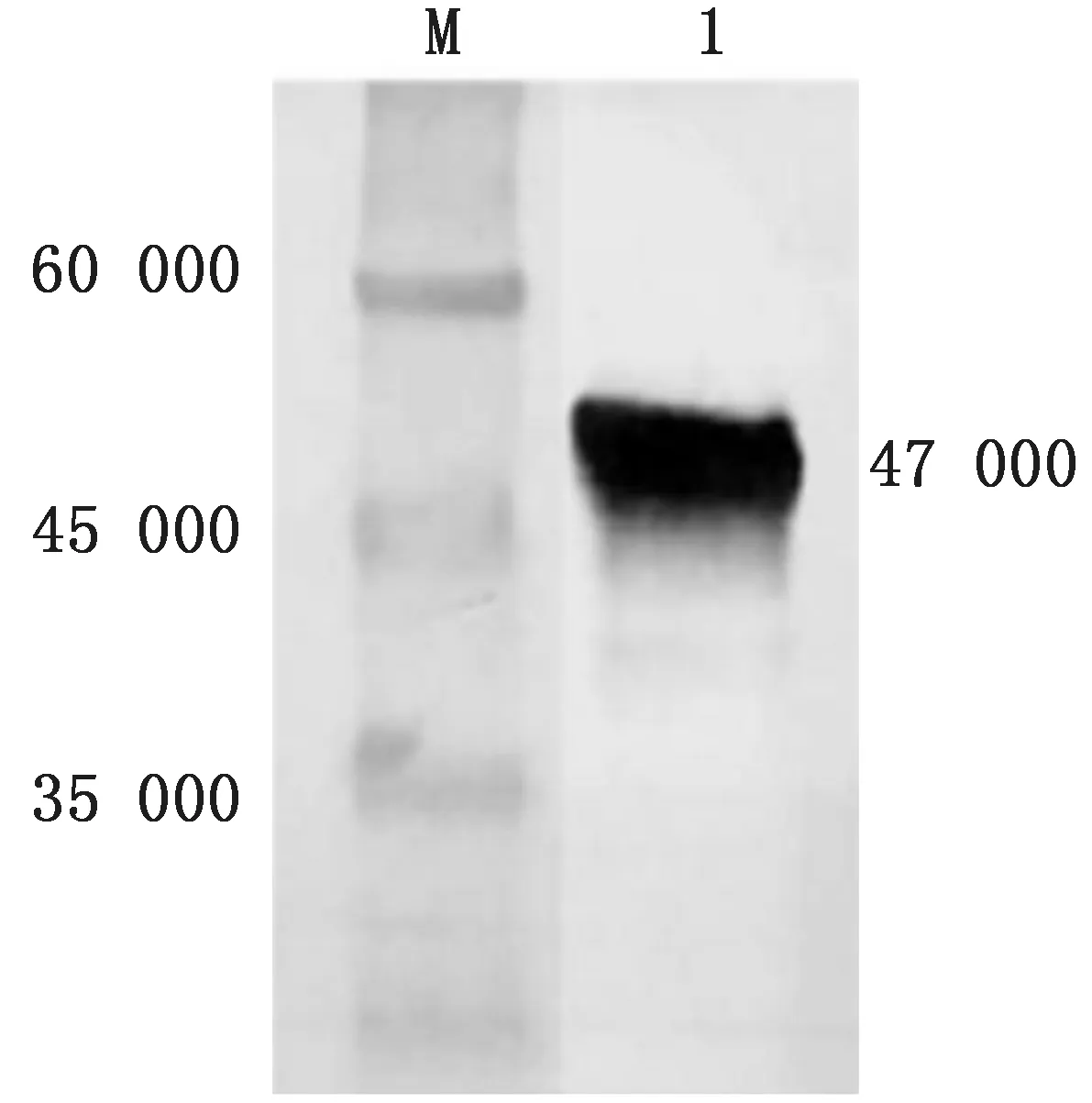
图5 纯化后VP7蛋白Western blot分析 M.蛋白Marker;1.p ET-32a-VP7纯化后蛋白
2.5 间接ELISA最佳工作条件确定根据正交矩阵滴定结果,当VP7 蛋白稀释度达到1∶400(1.25 g/m L)时,羊血清稀释达到1∶320时,阳性血清D450nm值大于1,阴性血清D450nm值小于0.2,且P/N值为8.07;分别以不同的封闭系统对包被的VP7蛋白进行封闭,从结果可得出,利用PBST稀释的5% BSA 作为封闭液时,阳性血清值大于1.0,阴性血清值小于0.2,且P/N值较高;将HRP-兔抗羊IgG 的酶标抗体进行不同浓度的稀释,测定P/N比值,根据结果确定酶标抗体最佳稀释浓度为1∶10 000。
ELISA 临界值判定标准确定:对30 份健康羊阴性血清,用已建立的间接ELISA 方法进行检测,读取D450nm值,计算出30份阴性血清D450nm值的平均值为0.128 3和标准误为0.029 4,因此阴阳性临界值为0.215 6(表2)。
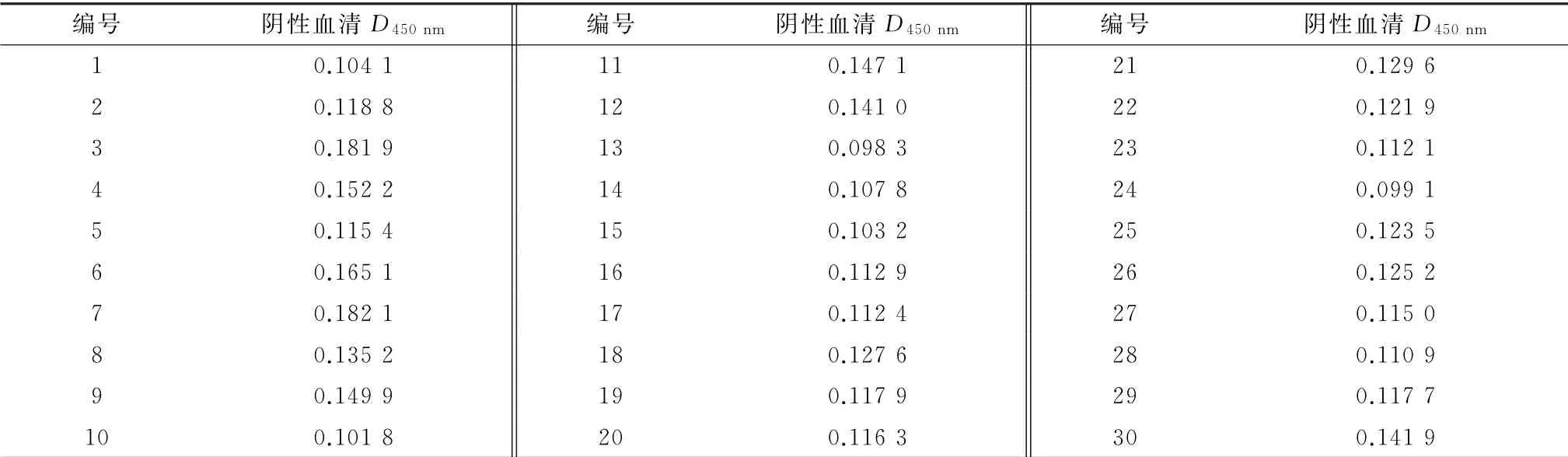
表2 30份BTV 阴性血清的D 450 nm平均值
2.6 特异性试验使用已经建立好的间接ELISA同时检测2份羊痘阳性血清,2份羊口蹄疫阳性血清和2份羊的小反刍兽疫阳性血清,每份血清做3个平行重复,并设置阳性、阴性血清对照,根据检测得到的平均值和阴阳血清临界值对比,当小于临界值0.215 6 时,判定其为阴性,说明BTV 重组蛋白VP7与常见的羊病毒血清无交叉反应,建立ELISA方法具有良好的特异性(表3)。

表3 BTV 间接ELISA 检测方法的特异性分析
2.7 敏感性试验用所建立的间接ELISA 方法,和病毒血清中和试验(VN)同时检测80份实验室保存待检血清样品,病毒血清中和试验共检测出阳性66份,间接ELISA 共检测出阳性69份,2种方法检测结果相同的样品共有72份,符合率达到90%,这说明建立的间接ELISA方法具有良好的准确性(表4)。

表4 间接ELISA 与病毒血清中和试验的结果比对 份
2.8 多克隆抗体效价检测利用已建立的针对羊血清的VP7间接ELISA 方法,对5只免疫羊血清抗体效价进行检测,检测结果得到2,3和5号羊的抗体效价较高,最高效价达到1∶8 192,因此选择这3只羊作为抗体纯化的血清(图6)。
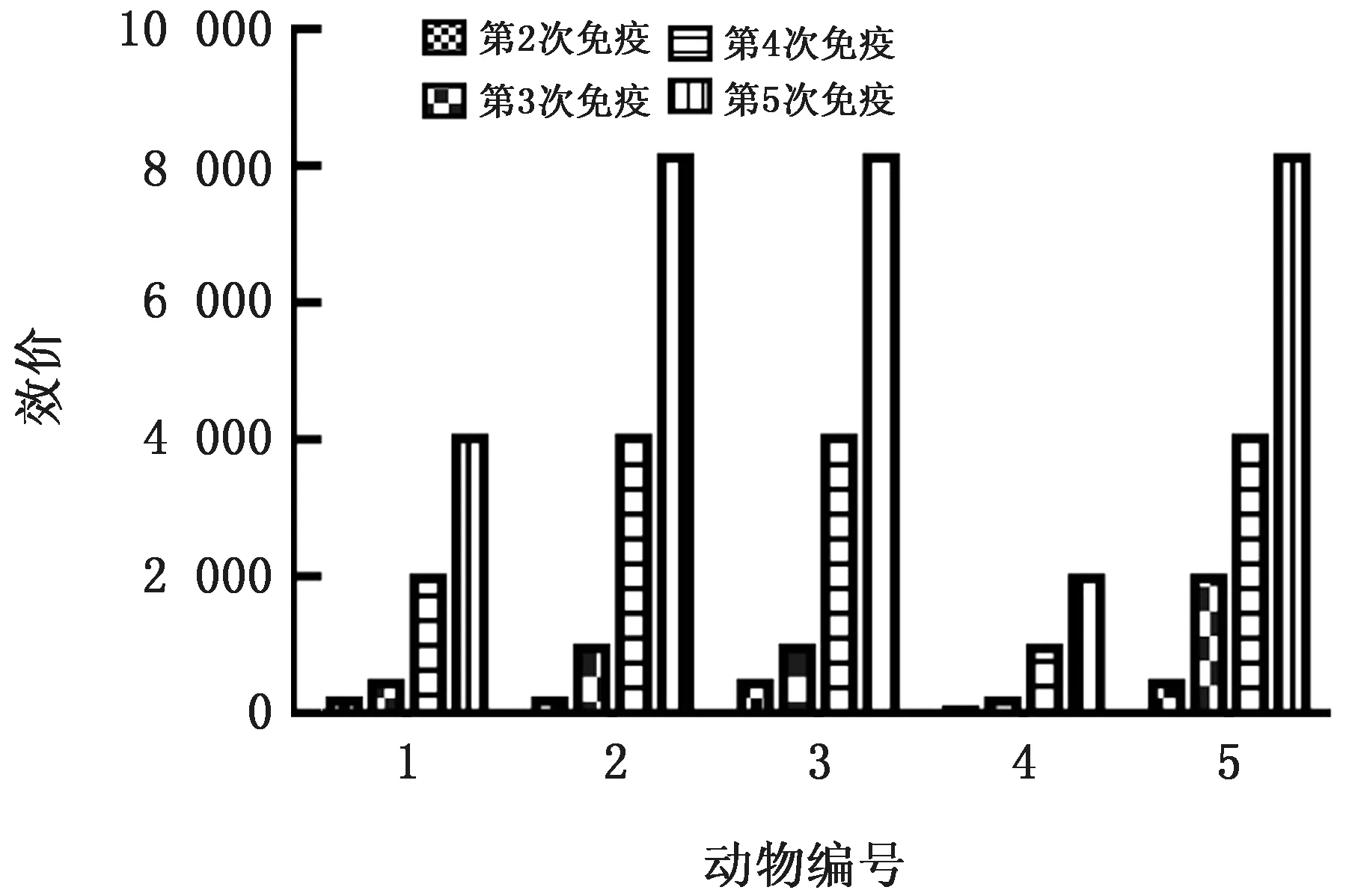
图6 VP7多克隆抗体效价
3 讨论
蓝舌病是在常见家养和野生反刍动物间高度传染的一种疾病,其病原血清型众多且不同血清型的BTV 引起的临床病理特征差异巨大[11]。BTV 是该病的病原,其基因组编码的7种结构蛋白一直是研究基因工程疫苗和诊断方法的重点,VP7 蛋白是BTV 内衣壳的1个主要结构蛋白,占内衣壳蛋白的36%,具有群特异性抗原决定位点,对于病毒的复制和传播具有重要意义[12]。不同血清型BTV 的VP7蛋白同源性高达99%,VP7至少有2个表位暴露在病毒粒子表面,利用重组VP7蛋白对动物体内的抗体水平进行监测,目前对于检测和诊断BTV 来说,VP7蛋白是建立BTV 群特异性血清学检测方法的最佳选择[1]。
大肠杆菌原核表达系统,具有时间短,价格便宜,表达水平较高且可选择较多表达载体等优点,是应用最多的系统[13]。迄今为止,已有很多研究利用大肠杆菌原核表达系统进行VP7蛋白表达。而本试验利用大肠杆菌原核表达蛋白的目的是为了获得具有免疫原性的重组蛋白并将VP7作为包被抗原初步建立间接ELISA 方法[14]。
本研究通过不同诱导时间,不同IPTG 浓度,不同诱导温度,比较HIS标签标记的VP7重组蛋白表达量的差异和可溶性表达程度的不同。经SDSPAGE分析结果显示重组VP7蛋白在原核表达系统中大量表达,Western blot结果显示VP7蛋白与HIS标签融合表达。随后对包涵体纯化蛋白,对包涵体蛋白进行变性获得生物学活性,释放出蛋白质,再进行复性,采用镍柱对复性的蛋白进行纯化。纯化后蛋白无明显杂蛋白,SDS-PAGE 结果显示获得清晰的目的条带,纯化效果良好。
ELISA 是一种定量试验,能够检测到样品中的蛋白和抗体等效价含量的技术[15-16]。利用VP7蛋白建立的间接ELISA 诊断技术,是对于判断免疫后动物血清抗体效价的常用方法。本次试验使用纯化后的全病毒作为免疫原进行免疫健康山羊,然后以大肠杆菌表达的VP7抗原作为包被抗原,利用间接ELISA 方法检测免疫后的血清中VP7 抗体的效价[17]。常用ELISA 检测一共分为4 种:直接ELISA、间接ELISA、竞争ELISA 和双抗体夹心ELISA[18]。其中间接法与直接法相似,不同之处一抗只能识别结合包被抗原,二抗作为酶标抗体辨识一抗来测定抗原量[19]。优势:二抗具有多种选择,能做不一样的测定剖析[20]。缺点:二抗和一抗的相互反应几率较高,所以必须设对照孔排除非特异性反应[21]。
建立的间接ELISA 方法的特异性较好,与其他羊病毒感染的羊血清无交叉反应,敏感性为90%。利用已经建立好的检测方法,检测5只免疫后羊的抗体效价,选择最后1次加强免疫后效价最高的羊血清进行抗体的纯化。由全抗原免疫动物产生的多克隆抗体中,既包含识别目的蛋白的抗体,也包含识别其他杂蛋白的抗体。目前较常用的多克隆抗体纯化方法包括辛酸饱和硫酸铵法[22]、蛋白A 亲和纯化法和抗原亲和纯化法[23]。本次使用亲和层析法纯化高免血清,纯化后的抗体具有清晰的轻链和重链,能够识别抗原且浓缩后抗体质量浓度达1.98 g/L。
