Y-S-Y12发酵液和生物质热解液混配对辣椒炭疽病的防治及作用机理
2020-03-13王薇李泳王伟边雪李熙英
王薇, 李泳, 王伟, 边雪, 李熙英
(延边大学农学院, 吉林 延吉133000)
辣椒炭疽病是辣椒的主要病害之一,主要危害叶片和成熟的果实,造成落叶和果实腐烂,对辣椒生产威胁很大。目前,辣椒炭疽病的防治主要采用化学防治,但化学防治常导致农药残留、环境污染、人畜中毒、农田生态平衡被破坏等一系列社会问题。因此寻找一种对环境友好的防治方法迫在眉睫。
Y-S-Y12菌株是杨树枝条中分离到的内生菌解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。金海强等[1]研究表明,Y-S-Y12菌株及其发酵浓缩液具有较广的抑菌谱,Y-S-Y12菌株对人参锈腐病菌的抑菌率为95.01%,其发酵浓缩液对人参锈腐病菌的抑菌率为69.41%, 田间防病效果达到75.79%,同时有促进人参生长作用。
生物质热解液是农业废弃物(玉米芯、秸秆、枯枝等)通过干馏得到的烟气经冷凝获得的粗产物,进一步精炼提纯得到pH较低的淡黄色酸性透明溶液,主要成分有酸类、酚类、醛类和酮类等,还有钾、钙、锌、镁等微量元素。生物质热解液在农业上的应用主要包括促进植物生长[2-4]和防治植物病虫害发生[5-7]等方面。目前,生物质热解液与化学农药混用方面有较多研究。韩如月等[8]研究表明,稀释10倍的木醋液与稀释1 000倍的农药恶霉灵按9∶1 复配,对大豆菌核病菌抑菌率最高,达到60%。沈国娟等[9]发现,生物质热解液与银法利混用对辣椒疫病有增效防病和减少农药使用的效果。也有研究表明,生物质热解液与多菌灵混用,对水稻纹枯病有增效防病和减少农药使用的作用[10]。杨彪[11]用木醋液与戊唑醇以不同比例混配对苹果斑点落叶病菌均表现出较好的抑制作用,其中木醋液与戊唑醇以 1∶1.4、1∶2 和 1∶11 比例混配时,增效系数SR 值分别达到14.01、13.78 和 14.88,表现为明显的协同增效作用。魏琦等[12]研究表明,竹醋液分别与咪鲜胺和戊唑醇按5∶1的比例混配后均对苹果炭疽病的抑菌具有增效作用。
以上研究均为生物质热解液与化学农药混用方面的研究,对于病菌拮抗菌发酵浓缩液与生物质热解液混配对植物病害防治方面的研究,尚未见报道。本研究将Y-S-Y12菌株发酵浓缩液和生物质热解液混配,筛选出最佳混配比例后,研究最佳比例混配溶液对辣椒炭疽病的防治效果及作用机理,为生物质热解液在辣椒炭疽病的无公害防治应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1供试培养基 马铃薯葡萄糖琼脂培养基(potato dextrose agar medium, PDA):100 mL蒸馏水、2 g琼脂、2 g去皮马铃薯、2 g葡萄糖;金氏B固体培养基(King’s B medium, KB):100 mL 蒸馏水、2 g 蛋白胨、1.5 g琼脂、0.15 g磷酸氢二钾、0. 15 g硫酸镁、1.5 mL丙三醇,pH 7.2。
1.1.2供试菌种 病原菌为辣椒炭疽病菌(Pepper anthracnose),供试拮抗菌为解淀粉芽孢杆菌(Bacillusamyloliquefaciens) Y-S-Y12菌株,均由延边大学植物病理研究室提供。
1.1.3生物质热解液 由广州迪森集团提供,以木屑为原料,中温快速热解法制造的生物油,生物油与水按体积比1∶1混合,在0.1 MPa的真空度下蒸馏,收集100~120 ℃时的蒸馏液。
1.1.4辣椒种子 景尖椒3号,购买于延吉种子公司。
1.2 研究方法
1.2.1不同浓度的生物质热解液对辣椒炭疽病菌的抑菌试验 将生物质热解液原液加入到PDA培养基中,配制为0.5、1.0、1.5、2.0、2.5、5.0、10.0 mL·L-1共7个浓度的生物质热解液PDA培养基。用打孔器在新长满的辣椒炭疽病原菌的平板上打出直径为7.0 mm的病菌菌饼,在含生物质热解液PDA平板中央放置一片菌饼,以无生物质热解液的PDA培养基为对照,每个处理5次重复,放入25 ℃恒温培养箱中培养2 d,用十字交叉法测病菌菌落直径,计算抑菌率。以热解液浓度的对数值为横坐标,抑菌率值为纵坐标,得到毒力回归方程,由毒力回归方程计算得出热解液对辣椒炭疽病菌的EC50值和EC90值。
1.2.2不同浓度Y-S-Y12菌株发酵液对辣椒炭疽病菌的抑菌试验 将Y-S-Y12菌株接种于装有100 mL KB培养液的锥形瓶中,28 ℃、120 r·min-1震荡培养48 h,作为种子菌。按照1%的接种量,在盛有100 mL KB培养液的锥形瓶中加入种子菌,28 ℃、120 r·min-1震荡培养48 h。将发酵液4 000 r·min-1离心15 min,上清液再次用滤纸过滤,上清液用真空旋转蒸发器浓缩至10 mL,高压灭菌后即为发酵浓缩液原液。将Y-S-Y12菌株发酵浓缩液原液配制为浓度1.0、2.5 、3.0、5.0和10 mL·L-1的菌株发酵液PDA培养基。抑菌试验方法及抑菌率计算同1.2.1。
1.2.3Y-S-Y12菌株发酵液与生物质热解液混配的最佳配比筛选 将EC50值浓度的Y-S-Y12菌株发酵浓缩液与生物质热解液以0∶10、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0的比例混配,测定不同混配比例溶液的抑菌率。抑菌试验方法及抑菌率计算同1.2.1。计算预期抑菌率及毒力比率,计算菌落连续生长第3、4、5 d的毒力比率。
预期抑菌率=(单剂A的EC50剂量实际抑菌率×配比百分率)+(单剂B的EC50剂量实际抑菌率×配比百分率)

若毒力比率明显大于1,为增效作用;若毒力比率明显小于1,为拮抗作用;毒力比率为1,则为相加作用。
1.2.4Y-S-Y12菌株发酵液与生物质热解液1∶9混剂的毒力测定 筛选发现Y-S-Y12菌株发酵浓缩液与生物质热解液以1∶9混合处理的效果最佳,将Y-S-Y12菌株发酵浓缩液与生物质热解液的1∶9混剂(简称1∶9混剂)配制为浓度0.2、0.5、1、2.5、5、8和10 mL·L-1的PDA培养基。根据1.2.1的方法建立混剂的毒力回归方程并计算EC50值和EC90值。所得结果参考Sun等[13]计算共毒系数(CTC)。
混配剂的理论毒力指数(TTI)=单剂A的相对毒力指数×单剂A的混配百分比+单剂B的相对毒力指数×单剂B的混配百分比

若共毒系数明显大于100,表示增效作用;明显小于100,表示拮抗作用;接近100,表示相加作用。
1.2.5Y-S-Y12菌株发酵液与生物质热解液及1∶9混剂对辣椒果实炭疽病的防病试验 选择大小基本一致、无损坏的新鲜红辣椒,用自来水反复冲洗,自然晾干后用70%酒精进行表面消毒,晾干备用。在果蒂处和中间部位分别用接种针刺3个伤口,设置3组处理,接药剂24 h后接辣椒炭疽病菌(A)、同时接药剂和病菌(B)、接辣椒炭疽病菌24 h后接药剂(C)。
接菌时伤口滴辣椒炭疽病菌菌悬液15 μL,接药剂时伤口处滴浓度为EC90的生物质热解液、Y-S-Y12菌株发酵浓缩液及1∶9混剂各20 μL,每个处理10个果实,重复3次,以只接病菌无药剂处理为对照,以只接无菌水为空白对照。待晾干后用保鲜膜密封保湿置于28 ℃恒温箱中,每天观察记录,出现病斑后统计辣椒发病时的病斑直径、发病率,计算病情指数和防治效果。
病果分级标准按陈娟芳等[14]的方法稍作修改,病斑直径用十字交叉法测量。0级:无病斑;1级:0.1 cm≤病斑直径≤0.4 cm;3级:0.4 cm<病斑直径≤0.7 cm;5级:0.7 cm<病斑直径≤1.1 cm,病斑上无霉层或有少量霉层;7级:1.1 cm<病斑直径≤1.5 cm,病斑上霉层较多;9级:病斑直径>1.5 cm,病斑上有大量霉层。
病情指数=

1.2.6Y-S-Y12菌株发酵液与生物质热解液及1∶9混剂处理后辣椒炭疽病菌生理指标测定 取PDA培养基上培养8 d的辣椒炭疽病菌菌丝,进行生理指标测定。电导率测定采用吴方丽[15]的方法;细胞蛋白质和核酸类物质外渗的测定参照徐俊光[16];总糖含量的测定采用蒽酮试剂法[17];用考马斯亮蓝G-250法[18]测定蛋白质含量;采用福林酚法[19]测定蛋白酶活性;几丁质酶活性的测定参考Boller等[20];β-1,3-葡聚糖酶活性测定采用余永廷等[21]的方法。
1.2.7平板抑菌试验 EC90浓度的生物质热解液、Y-S-Y12菌株发酵液及1∶9混剂分别与辣椒炭疽病菌进行平板抑菌试验,试验方法同1.2.1。培养5 d后,取病菌生长受抑制部位的菌丝,在光学显微镜下观察并拍照。
1.2.8Y-S-Y12菌株发酵液与生物质热解液及1∶9混剂处理后辣椒叶片抗氧化酶活性测定 春季,将辣椒苗进行田间移栽,株行距为25 cm×40 cm,每株定植2棵,移栽后进行正常田间管理。当辣椒植株开花时,喷浓度均为EC90的生物质热解液、Y-S-Y12菌株发酵液、1∶9混剂,每隔7 d喷施一次,共喷3次,每株每次喷施50 mL。每个处理10株,重复3次。测定处理后21 d的辣椒叶片超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(hydrogen peroxidase,CAT)活性。POD活性用愈创木酚法[22]进行测定,SOD活性用NBT法[18]进行测定,CAT活性参照王学奎[18]紫外吸收法进行测定。
1.3 数据处理与分析
试验数据采用Microsoft Excel 2010进行整理和分析,应用SAPSS 17.0采用Duncan多重比较法对数据进行统计分析。
2 结果与分析
2.1 生物质热解液对辣椒炭疽病菌的抑菌作用
由图1可知,不同浓度的生物质热解液对辣椒炭疽病菌均有抑菌作用,其抑菌率随着浓度的升高有明显增加的趋势。当生物质热解液的浓度为10 mL·L-1时,对辣椒炭疽病菌的抑菌率为100%。根据图1数据建立生物质热解液对辣椒炭疽病菌的毒理方程,为y=0.899 3x+4.198 3,r为0.996 6,大于0.95,说明毒力回归方程的拟合性较好,有较大的可信度。根据毒力回归方程求得生物质热解液的EC50值为2.44 mL·L-1,EC90值为10.14 mL·L-1。说明生物质热解液对辣椒炭疽病菌的EC50和EC90浓度为分别为2.44和10.14 mL·L-1。

注:不同小写字母表示不同处理间差异在P<0.05水平具有统计学意义。Note: Different small letters indicate statistically significant difference between different treatments at P<0.05 level.图1 生物质热解液对辣椒炭疽病菌的抑菌作用Fig.1 Bacteriostasis of biomass pyrolysis solution on pepper anthracnose
2.2 Y-S-Y12菌株发酵液对辣椒炭疽病菌的抑菌作用
由图2可知,不同浓度的Y-S-Y12菌株发酵浓缩液对辣椒炭疽病菌均有抑菌作用,其抑菌率随着浓度的升高有明显增加的趋势。当Y-S-Y12菌株发酵浓缩液的浓度为10 mL·L-1时,对辣椒炭疽病菌的抑菌率为77.79%。根据图2数据建立Y-S-Y12菌株发酵液对辣椒炭疽病菌的毒理方程,为y=0.595 7x+4.209 0,r为0.953 0,大于0.95,说明毒力回归方程的拟合性较好。根据毒力回归方程求得Y-S-Y12菌株发酵液对辣椒炭疽病菌的EC50和EC90浓度为分别为3.77和32.43 mL·L-1。可见,Y-S-Y12菌株发酵浓缩液对辣椒炭疽病菌的抑菌作用,低于生物质热解液原液。

注:不同小写字母表示不同处理间差异在P<0.05水平具有统计学意义。Note: Different small letters indicate statistically significant difference between different treatments at P<0.05 level.图2 Y-S-Y12菌株发酵液对辣椒炭疽病菌的抑菌作用Fig.2 Bacteriostasis of Y-S-Y12 fermentation on pepper anthracnose
2.3 Y-S-Y12菌株发酵液与生物质热解液的最佳混配比例筛选
不同Y-S-Y12菌株发酵浓缩液与生物质热解液混配比例的抑菌结果见表1,可见,不同配比中,随着Y-S-Y12菌株发酵浓缩液比例的增加,毒力比率整体呈下降趋势。当混配比例为1∶9和3∶7时连续3 d的毒力比率均大于1;当混配比例为2∶8时,第4、5 d的毒力比率大于1。其中,配比为1∶9时毒力比率最大,说明1∶9混剂的抑菌增效作用最明显。

表1 Y-S-Y12菌株发酵液与生物质热解液不同配比溶液的抑菌作用Table 1 Bacteriostasis of mixtures with different ratios of Y-S-Y12 strain fermentation to biomass pyrolysis solution
2.4 不同浓度的1∶9混剂对辣椒炭疽病菌的抑菌作用
由图3可见,不同浓度的1∶9混剂对辣椒炭疽病菌均有抑菌作用,其抑菌率随着混剂浓度的升高有明显的增加趋势。当混剂浓度为8 mL·L-1时,对辣椒炭疽病菌的抑菌作用最强,达到91.52%,且与5 mL·L-1混剂的效果无显著差异。
根据图3数据建立1∶9混剂对辣椒炭疽病菌的毒力回归方程,为y= 0.995 8x+ 4.449 4,r为 0.981 9,说明毒力回归方程拟合较好。根据毒力回归方程求得,1∶9混剂的EC50浓度为1.74 mL·L-1,EC90浓度为6.30 mL·L-1。
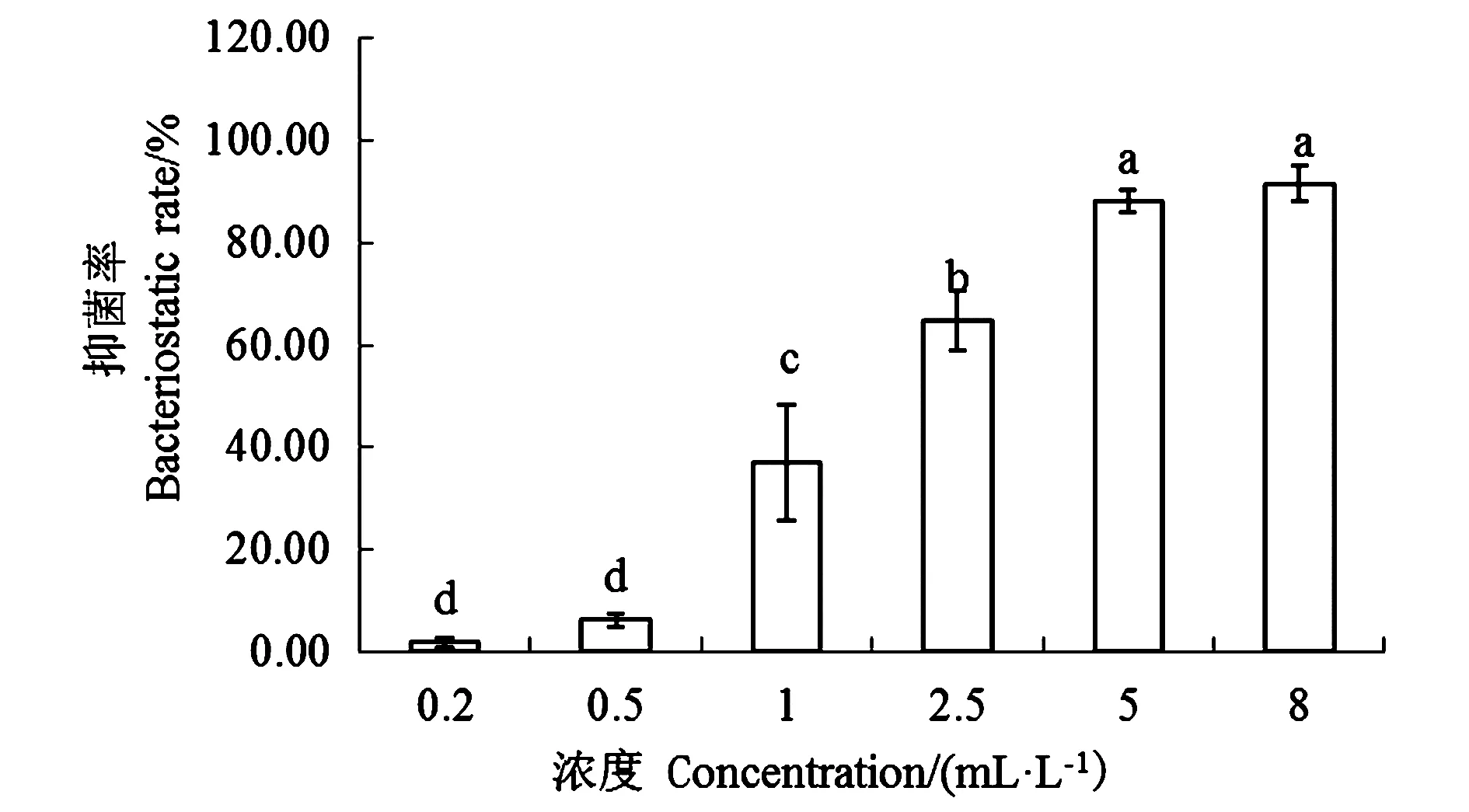
注:不同小写字母表示不同处理间差异在P<0.05水平具有统计学意义。Note: Different small letters indicate statistically significant difference between different treatments at P<0.05 level.图3 不同浓度的1∶9混剂对辣椒炭疽病菌的抑菌作用Fig.3 Bacteriostasis of different concentration solution with 1∶9 ratio of Y-S-Y12 strain fermentation to biomass pyrolysis solution on pepper anthracnose
可见,Y-S-Y12菌株发酵浓缩液、生物质热解液、及1∶9混剂的EC50值和EC90值中,Y-S-Y12菌株发酵浓缩液的EC50值最大,为混剂的2.17倍;其次为生物质热解液,其EC50为混剂的1.40倍;混剂的EC50值和EC90值最小。说明1∶9混剂对辣椒炭疽病菌的抑菌作用最强,其次为生物质热解液,Y-S-Y12菌株发酵浓缩液对辣椒炭疽病菌的抑菌作用最弱。
根据以上两种单剂的EC50值和混剂的EC50值,计算的共毒系数为123.98,明显大于100。进一步说明,1∶9混剂具有明显的增效作用。
2.5 不同药液不同处理对辣椒果实炭疽病的防病作用
Y-S-Y12菌株发酵液、生物质热解液及1∶9混剂3种溶液不同处理的防病结果(表2)显示,不管哪种药液,预防性的先处理24 h后再接菌处理(C)的病情指数最低,防治效果最高,其次是同时接菌和处理(B),而先接菌24 h后处理(A)的病情指数较高,但仍低于对照。Y-S-Y12菌株发酵液、生物质热解液及1∶9混剂的对辣椒果实炭疽病的防病处理中,A、B、C处理时,均为1∶9混剂的病情指数最低,防治效果最高,C处理达到79.26%,其次为Y-S-Y12菌株发酵液,而生物质热解液的防治效果最低。

表2 不同药液不同处理对辣椒果实炭疽病的防病作用Table 2 Prevention of different treatments with Y-S-Y12 strain fermentation, biomass pyrolysis solution and their mixture with 1∶9 ratio on pepper anthracnose of pepper fruit
2.6 不同药液处理对辣椒炭疽病菌生理指标的影响
由表3可知,不同处理的辣椒炭疽病菌菌丝电导率值、蛋白质和核酸类物质外渗浓度均显著高于对照。其中1∶9混剂处理过的辣椒炭疽病菌菌丝的电导率值最高,达到对照的2.05倍;其次为生物质热解液处理,达到对照的1.53倍。1∶9混剂和生物质热解液处理过的辣椒炭疽病菌的蛋白质和核酸类物质外渗浓度最高,蛋白质外渗浓度分别为对照的1.98和1.91倍;核酸外渗浓度分别为对照的1.76和1.68倍。说明1∶9混剂对辣椒炭疽病菌菌丝细胞膜的破坏性最强。
测定炭疽菌病菌的总糖含量和蛋白质含量可以看出病菌菌丝细胞膜是否被破坏,几丁质酶和β-1,3-葡聚糖酶等病原真菌细胞壁降解酶是植病生防检测的重要因素。由表3可知,不同处理的辣椒炭疽病菌菌丝的总糖含量和蛋白质含量显著低于对照,其中1∶9混剂处理的总糖含量和蛋白质含量最低,分别是对照的54.45%和89.39%;其次为两种单剂处理的总糖含量和蛋白质含量。不同处理的辣椒炭疽病菌菌丝的蛋白酶、几丁质酶和β-1,3-葡聚糖酶的活性显著高于对照,其中1∶9混剂处理的蛋白酶、几丁质酶和β-1,3-葡聚糖酶的活性最高,分别是对照的3.37、3.17和1.67倍。

表3 不同药剂对辣椒炭疽病菌生理指标的影响Table 3 Effects of Y-S-Y12 strain fermentation, biomass pyrolysis solution and their mixture with ratio of 1∶9 on physiological indexes of pepper anthracnose
2.7 不同药液处理对辣椒炭疽病菌菌丝形态的影响
由图4可知,在正常PDA培养基培养的辣椒炭疽病菌菌丝形态结构完整,分叉、分隔明显;而经生物质热解液处理的菌丝弯曲变形;经Y-S-Y12菌株发酵液处理的菌丝膨大,分支减少;经1∶9混剂处理的菌丝部分呈不规则膨大、溶菌、分叉处膨大、菌丝变短。

注:A:对照;B:生物质热解液;C:Y-S-Y12菌株发酵液;D:1∶9混剂。红色箭头表示菌丝稍微弯曲,黄色箭头指菌丝膨大,蓝色箭头指溶菌。Note: A: CK; B: Biomass pyrolysis solution; C: Y-S-Y12 fermentation; D: Mixture with ratio of 1∶9. Red arrow indicates hypha slightly curved, yellow arrow indicates hyphal expansion, and blue arrow indicates hypha dissolved.图4 不同处理的辣椒炭疽病菌的菌丝形态Fig.4 Morphology of pepper anthracnose in different treatments
2.8 不同药液处理对辣椒叶片POD、SOD、CAT酶活性的影响
由表4可知,不同处理的辣椒叶片中SOD、POD和CAT酶活性均显著高于对照。其中1∶9混剂处理的SOD、POD和CAT酶活性最高,分别为对照的1.26、2.26和2.70倍。生物质热解液处理的SOD、POD和CAT酶活性分别为对照的1.02、1.93和1.53倍;Y-S-Y12菌株发酵液处理的SOD、POD和CAT酶活性分别为对照的1.10、1.57和2.28倍。

表4 不同处理对辣椒叶片POD、CAT、SOD酶活性的影响Table 4 Effects of different treatments on activities of POD, CAT, and SOD in pepper leaves
3 讨论
本研究中,与木醋液理化性质相似的生物质热解液在不同浓度下对辣椒炭疽病均有明显的抑制作用,且随着浓度的升高抑菌效果有明显的增加趋势,当生物质热解液的浓度为10 mL·L-1时抑菌效果最好,达到100%;辣椒果实炭疽病的防病试验中先用生物质热解液处理24 h后接病菌的防效达到52.30%。说明生物质热解液在辣椒炭疽病无公害防治中有一定的开发利用价值。Y-S-Y12菌株发酵浓缩液和生物质热解液1∶9配比的EC50值明显小于Y-S-Y12菌株发酵浓缩液和生物质热解液单剂EC50值,其共毒系数为123.98,明显大于100,说明Y-S-Y12菌株发酵浓缩液和生物质热解液1∶9混配具有明显的增效作用。辣椒果实炭疽病的防病试验表明,先用Y-S-Y12 菌株发酵浓缩液与生物质热解液1∶9混剂处理24 h后接病菌的防效达到79.62%,进一步证明Y-S-Y12 菌株发酵浓缩液与生物质热解液1∶9混剂对辣椒炭疽病有明显增效防病作用。
本研究发现,Y-S-Y12菌株发酵液、生物质热解液以及1∶9混剂处理的辣椒炭疽病菌菌丝中的几丁质酶活性、β-1,3-葡聚糖酶活性和蛋白酶活性均显著高于对照,其中1∶9混剂处理的蛋白酶活性、几丁质酶活性和β-1,3-葡聚糖酶活性最高,分别是对照的3.37、3.17和1.67倍。说明药液处理后菌体的保护屏障被打破,使其内部电解质、蛋白质以及核酸等外泄至培养液中,进而使培养液的电导率、蛋白质和核酸含量上升。张慧茹等[23]研究发现,绞股蓝内生真菌JY25 发酵液可以使致病大肠杆菌的电导率增加,使细胞膜受到明显破坏。木霉在和抗生菌寄生中,可产生几丁质酶、β-1,3-葡聚糖酶和蛋白酶,分解植物细胞壁,或分泌葡萄糖苷酶等胞外酶来破坏寄主细胞壁[24-26]。这些研究均与本研究结果一致。同时,电镜观察发现,经Y-S-Y12菌株发酵浓缩液和生物质热解液混剂处理的辣椒炭疽病菌菌丝部分呈不规则膨大、溶菌、轻微弯曲、分隔不明显、分叉处膨大、菌丝变短,这进一步证明菌体生长受到威胁。
SOD酶、POD酶、CAT酶是植物体内重要的保护酶,与植物体抗病性相关。本研究结果表明,Y-S-Y12菌株发酵浓缩液、生物质热解液以及1∶9混剂处理的辣椒叶片SOD酶、POD酶、CAT酶活性均明显高于对照,其中1∶9混剂处理的SOD、POD和CAT酶活性最高,比对照分别提高了1.26、2.26和2.70倍。这与前人[27-31]的研究基本一致。说明Y-S-Y12菌株发酵液和生物质热解液以及它们的混剂处理可以诱导辣椒植株抗病性提高。
喷施Y-S-Y12菌株发酵浓缩液和生物质热解液1∶9混剂不仅可以直接作用于病原菌,使其细胞膜和细胞壁受到破坏,抑制其生长,还能够提高辣椒植株体内保护酶的活性,提高植物的抗病性,内因和外因的共同作用使得喷施1∶9混剂后的植物体病害明显降低,从而有效抑制了辣椒炭疽病的危害。
