基于ADC灰度直方图分析鉴别颅内孤立性纤维瘤/血管外皮瘤和血管型脑膜瘤
2020-03-13王佳胡春洪王希明
王佳, 胡春洪, 王希明
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)/血管外皮细胞瘤(hemangiopericytoma,HPC)是一类脑膜间叶组织来源肿瘤,中枢神经系统少见[1],而血管型脑膜瘤(angiomatous meningioma,AM)是脑膜瘤的一种组织学亚型,二者在生物学行为、治疗方法及预后上存在很大差异。SFT/HPC具有恶性的生物学行为,表现为高颅内复发和颅外转移倾向,手术切除加术后放疗为主要治疗手段[2]。相比之下,AM恶性程度低,仅手术切除即可获得良好预后。因此,术前准确鉴别SFT/HPC和AM在临床工作中至关重要。
已有研究报道传统MRI(T1WI,T2WI和T1增强等)术前诊断SFT/HPC和AM的价值[3],但这些图像特征的解释依赖于阅片者的主观经验。Clarencon等[4]探讨磁共振波谱(MRS)、扩撒加权成像(DWI)和灌注加权成像(PWI)对SFT/HPC和AM的鉴别诊断价值,但未获得一致性结论,可能与研究方法有关,因为用肿瘤代表性区域的平均参数值来评估肿瘤,并不能反映肿瘤组织学特征的空间异质性,可能会忽略二者之间的细微差异。
灰度直方图分析是一种客观且可靠的研究方法,可提供肿瘤组织特征的定量信息,该方法已被证明在鉴别肿瘤类型、预测肿瘤分级和预后方面具有重要价值[5-7]。本研究旨在探讨肿瘤ADC灰度直方图分析对SFT/HPC与AM的鉴别诊断价值。
材料与方法
1.研究对象
收集2017-2019年苏州大学附属第一医院收治并经病理证实的18例SFT/HPC和21例AM患者。纳入标准:①初诊且未经任何治疗;②均接受术前MRI检查且无图像伪影;③经手术切除且有确切的组织病理学检查结果。
2.图像采集
采用Siemens Skyra 3.0T MRI扫描仪,头颈联合八通道线圈。取仰卧位,头先进,调整人脑的正中矢状面与线圈的纵轴一致。常规MRI平扫参数如下:横轴面T1WI:TR 1800 ms,TE 9 ms,层厚5.0 mm,层间距1.0 mm,视野220 mm×220 mm,矩阵224×320,激励次数1;横轴面T2WI:TR 4000 ms,TE 94 ms,层厚5.0 mm,层间距1.0 mm,视野220 mm×220 mm,矩阵224×320,激励次数1;DWI:TR 4400 ms,TE 61 ms,层厚5 mm,层间距1.0 mm,视野220 mm×220 mm,b值=0,1000 s/mm2,矩阵126×126,激励次数1。MRI平扫完成后行增强扫描,对比剂为Gd-DTPA。经肘静脉注射Gd-DTPA(0.2 mL/kg),注射流率3 mL/s,扫描参数同T1WI平扫。
3.图像分析
常规MRI特征包括形状(类圆形/分叶形/不规则形)、DWI信号、T1增强特征(均匀或异质)、基底附着(广/窄基底)、有无跨线/跨叶生长、硬脑膜尾征、血管流空征、坏死/囊变和骨质破坏征象。在病理结果未知的情况下,由两名具有丰富经验的放射科医生独立阅片并评估以上特征,结论不一致时通过协商达成一致意见。
ADC灰度直方图分析:将数据导入Siemens Syngo后处理工作站自动计算ADC图。以T2WI和T1增强图像为参考,在获得的ADC图上,由一名放射科医生使用Image J软件选取肿瘤最大层面手动勾画ROI,避免瘤周血管和水肿,并略小于肿瘤边界,以减少部分容积效应。提取每个肿瘤的ADC灰度直方图参数:平均ADC、中位ADC、偏度、峰度、第10百分位数(ADC 10%)、第25百分位数(ADC 25%)、第75百分位数(ADC 75%)和第90百分位数(ADC 90%)。由同一名医生在一个月后对所有病例进行再次测量,取两次测量结果的平均值。
4.病理检查
所有患者均行肿瘤全切除手术,手术标本经HE染色和免疫组化染色。由一名病理科医生依据2016年WHO中枢神经系统肿瘤分类标准确定病理结果。
5.统计学分析
所有统计分析均使用SPSS 22.0软件。使用独立样本t检验比较SFT/HPC和AM组患者的年龄差异,采用Fisher精确检验比较两组间的性别、常规MRI特征差异。两组间ADC灰度直方图参数的差异使用Mann-Whitney U检验。使用受试者工作特征曲线(ROC)评估灰度直方图参数的诊断效能,并计算ROC曲线下面积(AUC)、截断值、敏感性和特异性。P<0.05为差异具有统计学意义。
1.临床和常规MRI特征结果
SFT/HPC出现脑膜尾征较AM少见,而血管流空征、坏死/囊变及骨质侵犯较AM多见(P均<0.05)。两组的年龄(t=1.638)、性别、肿瘤形态、DWI信号和T1增强特征等均无统计学差异(P均>0.05,表1)。
2.ADC灰度直方图分析结果
SFT/HPC和AM患者的ADC灰度直方图参数值见表2。SFT/HPC组的ADC 90%明显高于AM组(P<0.001),峰度明显低于AM组(P=0.026)。两者间ADC 10%、ADC 25%、ADC 75%、平均ADC、中位ADC及偏度均无统计学差异(P均>0.05)。ROC曲线分析结果如图1。峰度和ADC 90%区分SFT/HPC和AM的AUC分别为0.88(敏感度72.2%,特异度100.0%)和0.87(敏感度94.4%,特异度68.4%),最佳截断值分别为4.76和22.75。典型病例如图2、3所示。
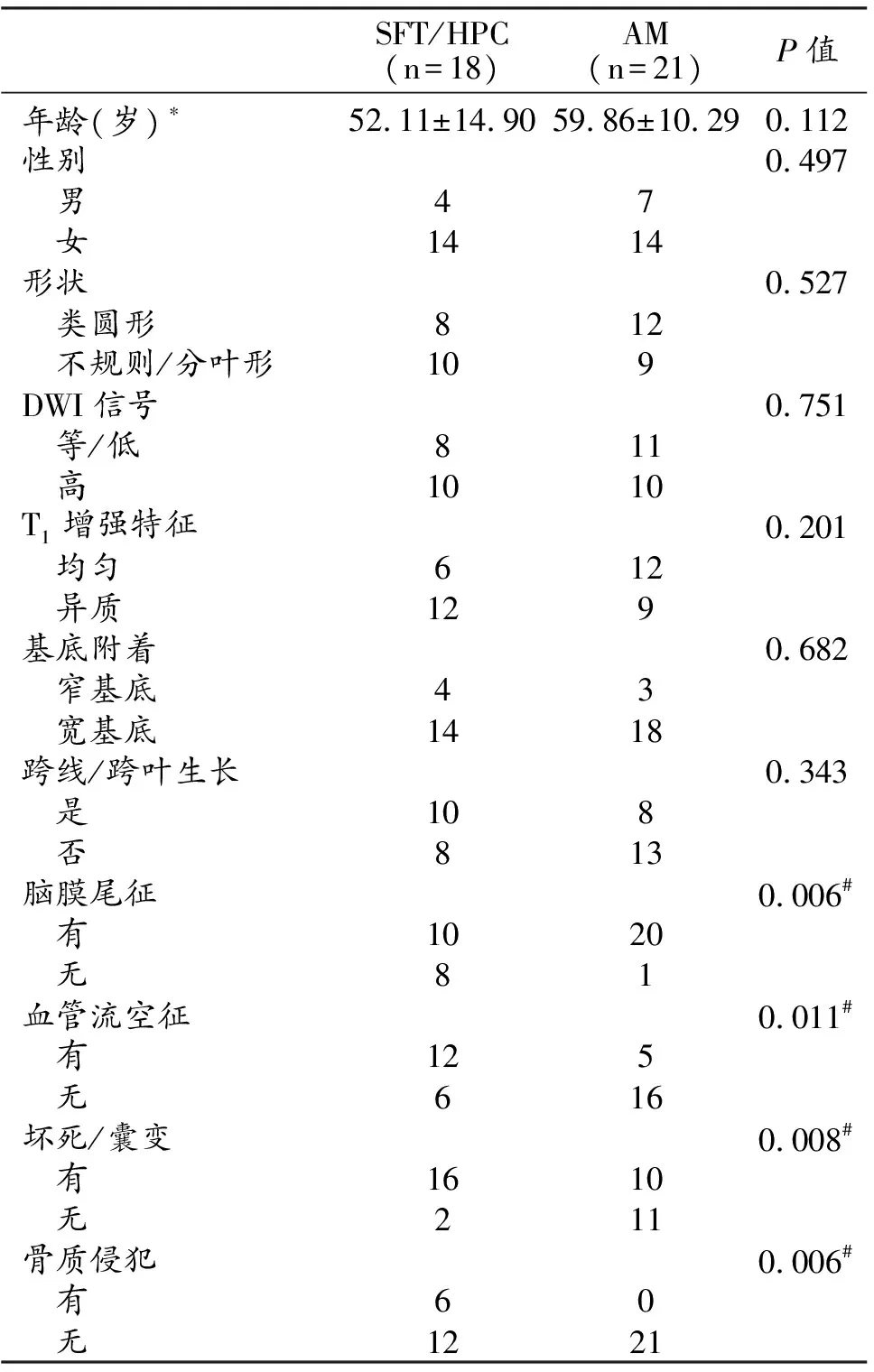
表1 SFT/HPC和AM患者的临床和常规MRI特征比较
注:*为数据符合正态分布,以均数±标准差表示,使用独立样本t检验,余数据均使用Fisher精确检验;#为差异具有统计学意义。

表2 SFT/HPC和AM患者的灰度直方图参数值比较
注:数据均呈非正态性分布,以中位数(四分位数)表示,使用Mann-Whitney U 比较,#为差异具有统计学意义。
讨 论
SFT/HPC发病率低,位于中枢神经系统更为罕见,国内外未见大宗病例总结报道;且肿瘤发病部位及病理级别不同,其影像学表现各异,因此放射科医师对该病的影像学特点认识尚不充分,发生于颅内时常误诊为脑膜瘤。
1.常规MRI特征
常规MRI是评估颅内肿瘤的首要方式,但受限于阅片者的主观性,不同研究往往得出不同结论[8-10]。本研究中,SFT/HPC和AM在脑膜尾征、血管流空征、坏死/囊变以及骨质侵犯方面存在统计学差异,而性别、年龄、形态、T1增强特征等均无明显差异。
2.ADC值频数特征
ADC值与肿瘤细胞密度、细胞核浆比有关;高细胞密度和核浆比限制细胞内外水分子的自由运动,导致ADC值下降[11]。目前已有学者报道最小ADC值或平均ADC值在SFT/HPC和AM中的鉴别诊断价值[12,13]。灰度直方图通过提取病灶图像像素值的灰度分布情况进行统计分析,可获得大量与疾病组织学特征相关的参数,为进一步评估肿瘤提供优化分类方法,已成为一种重要的肿瘤评价方法[14]。既往研究多采用常规MRI序列进行纹理分析[3],而ADC图作为功能成像方法,可能含有更丰富的纹理信息,有望提供比平均ADC值更敏感的诊断信息。本研究结果显示,SFT/HPC组ADC 90%明显高于AM组,符合SFT/HPC多呈DWI等/低信号的特点,也与既往文献报道SFT/HPC的ADC值高于AM的结论一致[15]。原因可能在于SFT/HPC血管组织较丰富,水分子扩散受限程度降低,此外病灶中无法察觉的微囊变区也可能影响SFT/HPC的ADC值。本研究中,其他所有的百分位数以及平均ADC、中位ADC值在SFT/HPC和AM组间均无统计学差异。Liu等[16]报道HPC的平均ADC值显著高于间变性脑膜瘤,而HPC和AM的平均ADC值无显著差异,因此笔者认为平均ADC值仅能区分分化程度相差较大的肿瘤类型,对HPC和AM的鉴别诊断价值有限。
3.ADC值分布特征
ADC直方图可以通过可视化图形的不对称性和平坦度来评估参数值的空间分布。峰度和偏度是评价组织空间异质性的重要指标。峰度是峰值高度的位置,反映分布的峰值,即ADC值的最大频率。本研究中,SFT/HPC组峰度明显小于AM组,表明AM图像的灰度分布更集中于平均值附近。笔者认为这主要是由于AM内瘤细胞分布更均匀,结构更致密,而SFT/HPC内细胞成分混杂,坏死和囊变较多所致[3]。ADC偏度在鉴别病变类型和良恶性中也具有重要价值[17]。偏度反映平均值周围分布的不对称性,正偏斜表明病灶内多数ADC值低于平均值,曲线向右倾斜。然而,本研究没有发现偏度有助于区分SFT/HPC和AM的结果。
本研究存在一定局限性。首先这是一项回顾性研究,样本量相对较小;此外,手动勾画ROI不可避免地会产生偏差,未来图像自动分割和提取技术将提供更为客观的研究方法。
综上所述,基于ADC的灰度直方图分析可有效地反映SFT/HPC和AM之间细微的组织病理学差异,其中峰度和ADC 90%具有较高的诊断效能,可为治疗方案的制定和预后评估提供帮助。
