气相色谱-串联质谱法测定豆芽中3种生长调节剂
2020-03-12方志青李婷婷
方志青,李婷婷,王 娅,林 野
(1 贵州民族大学生态环境工程学院,贵州 贵阳 550025;2 贵州省疾病预防控制中心理化科,贵州 贵阳 550004)
豆芽,又称芽苗菜,其营养丰富、美味可口且价格低廉是人们日常生活中常食的食品,常见的有黄豆芽、绿豆芽等。豆芽的培植常使用植物生长调节剂,可以使豆芽粗壮无根、提高产量和缩短生长周期,长期以来被国内外豆芽生产者应用[1-3]。植物生长调节剂(Plant growth regulator,PRGs)包括经人工合成的对植物的生长发育有调节作用的化合物或从生物中提取的天然植物激素,用于调节植物生长发育的一类农药[4-7]。因其在农作物的生长、开花、结果以及矮化植物、缩短水果蔬菜的成熟期等方面发挥了巨大的作用,广泛应用于现代农业生产,能够调节果蔬生长,达到增产、丰收等目的[8-10]。但长期食用会对人体内分泌和代谢平衡造成影响,通常会导致消费者骨质疏松、恶性肿瘤等疾病,而且易造成儿童早熟等症状[11-12]。由于盲目滥用和超量使用植物生长激素而造成的食品安全问题时有发生,目前是食品安全领域的一个重大问题。本研究针对豆芽生产过程中可能使用的3种植物生长调节剂,采用气相色谱-三重四级杆串联质谱法对贵阳省市售豆芽中植物生长调节剂进行了残留监测,以期为豆芽中植物生长调节剂残留量对居民健康的影响提供一定的数据基础。
1 实 验
1.1 样品来源
随机购置于各大超市、农贸市场豆芽样品合计107份,其中绿豆芽36份,黄豆芽71份。所有样品装入食品保鲜袋内后-20 ℃冻藏备用。
1.2 仪器与试剂
p管柱(30 m×0.25 mm,0.25 μm,Thermo Fisher公司);GX-274固相萃取仪,美国吉尔森;MCS固相萃取柱(500 mg/6 mL),Waters公司;Milli-Q AdvantageA10超纯水仪,美国密理博;SIGMA3-18KS冷冻离心机,德国SIGMA;IKA MS-3漩涡混合仪,德国IKA公司;TTL-DCII型氮吹仪,北京同泰联;旋转蒸发仪,Heidolph Laborota 4001 ellicient。
甲醇、乙酸乙酯、正己烷、甲酸、乙腈(色谱纯);盐酸(优级纯);无水硫酸钠、三氟化硼乙醚溶液(分析纯);4-氯苯氧乙酸、吲哚乙酸、吲哚丁酸混合标准品(纯度>99.0%,德国Dr.Ehrenstorfer GmbH公司),分别称取3种标准品0.025 g(精确至0.0001 g)用甲醇溶解并定容至25 mL,得到1.0 mg/mL 3种植物生长调节剂储备液。使用时分别吸取各储备液1.0 mL甲醇定容至100 mL,得到10.0 μg/mL混合标准使用液,4 ℃保存。
1.3 样品处理
1.3.1 样品提取
称取试样10.0 g(精确至0.0001 g)于具塞离心管中,加入20.0 mL 体积分数为0.5%甲酸乙腈溶液,漩涡混匀2 min,超声提取30 min,置于离心机中8000 r/min离心5 min,上清液转移至新的具塞离心管中,然后加入3.00 g NaCl(使其饱和结晶),漩涡混匀,超声10 min,冷却后8000 r/min离心5 min,吸出乙腈层,用无水Na2SO4脱水过滤至圆底烧瓶内,旋转蒸发仪浓缩近干后加入2.0 mL甲醇超声溶解。取1.0 mL甲醇样液加入9.0 mL 40 mmol/L HCl,超声混匀,转移至离心管8000 r/min离心5 min,上清液待净化。
1.3.2 样品净化
取预先加5.0 mL 甲醇、5.0 mL水、5.0 mL 40 mmol/L的HCl活化的MCS柱(500 mg/6 mL),将1.3.1中待净化的上清液过MCS柱后收集,待样品过柱后,用5.0 mL水淋洗除杂,真空抽干柱内液体后加入5.0 mL甲醇洗脱收集,合并收集液于10.0 mL试管中50 ℃下用氮气吹干待衍生。
1.3.3 样品衍生
在试管内加入1.0 mL 10%三氟化硼甲醇衍生溶液,涡旋混匀,70 ℃加热衍生30 min,冷却至室温后加入1.0 mL乙酸乙酯/正己烷混合溶液(V/V=1:4)和2.0 mL超纯水,涡旋混匀,4000 r/min离心5 min,取有机相待气相色谱-串联质谱测定。
1.4 标准系列溶液配制
分别吸取50 μL、100 μL、200 μL、400 μL、1000 μL 10.0 μg/mL植物生长调节剂混合使用液甲醇定容1.0 mL,参照1.3.3样品衍生方法衍生,提取获得0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、4.0 μg/mL、10.0 μg/mL植物生长调节剂标准系列溶液,GC-MS/MS测定。
1.5 色谱-质谱条件
色谱条件:TG-5MS毛细管色谱柱:30 m×0.25 mm×0.25 μm,载气:高纯氦气(≥99.99%),柱流量:1.0 mL/min,进样口温度:250 ℃,柱温:程序升温,初始温度80 ℃保持2 min,20 ℃/min升温至290 ℃保持5 min,不分流进样,进样量:1.0 μL。
质谱条件:电离方式:EI源,70 eV,离子源温度:230 ℃,传输线温度:280 ℃,检测方式:质谱多反应监测(multiple reaction monitoring,MRM)。
2 结果与讨论
2.1 仪器测定条件优化

表1 3种植物生长调节剂的多反应监测质谱参数
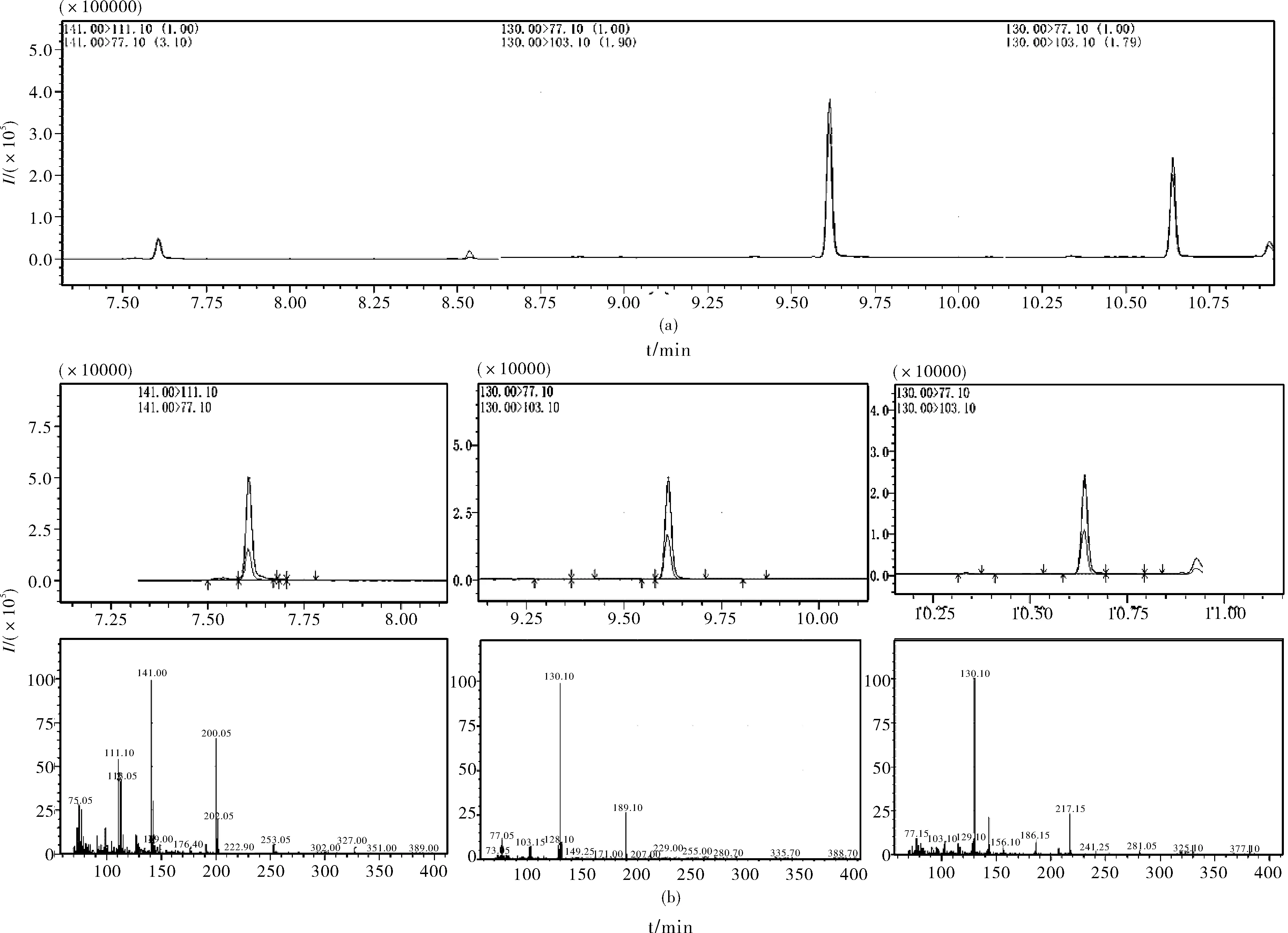
图1 3种植物生长调节剂总离子流图(a)和二级质谱图(b)
为减少基质干扰,降低检出限,采用多反应监测模式(MRM)对10.0 μg/mL 3种植物生长调节剂进行分析,首先通过全扫描确定4-CPA、IAA和IBA的母离子,采用子离子扫描方式进行二级质谱分析,进一步优化碰撞能量等质谱参数,使各分析化合物的响应最大化,优化后3种植物生长调节剂的母离子、子离子及其碰撞能量见表1,总离子流图和二级质谱图见图1所示。
2.2 方法的线性范围、定量限和检出限
以3种植物生长调节剂质量浓度(μg/mL)(x)和其定量离子峰面积(y)进行线性回归计算。结果显示:3种植物生长调节剂在0.5~10.0 μg/mL浓度范围内线性关系良好,相关系数0.9959~0.9994(见表2)。同时,以定量离子信噪比(S/N)的3倍和10倍作为方法的检出限和定量限,计算本方法检出限为6.0~9.0 μg/kg、定量限为12.0~23.0 μg/kg(见表2)。

表2 标准曲线、检出限和定量限
2.3 加标回收率和精密度
分别以回收率和相对标准偏差(RSD)表示方法的准确度、精密度。在阴性样品中分别按高、中、低三个不同加标水平加入PGRs混合标准溶液,按“1.3”样品处理方法进行提取、净化和衍生后测定其含量并计算回收率。每个浓度水平进行6次加标回收测定并计算精密度。结果表明:加标回收率范围在82.1%~106%,相对标准偏差(RSD)<8%(见表3)。

表3 方法的加标回收率和相对标准偏差(n=6)
2.4 样品检测
采用本文建立的方法对贵阳市市售黄豆芽、绿豆芽等107份豆芽样品中的植物生长调节剂残留量进行了测定。其中4-CPA检出率为7.6%,含量在0.011~0.59 mg/kg范围,IAA出率为31.2%,含量在0.01~3.36 mg/kg范围,IBA出率为2.1%,含量在0.01~0.17 mg/kg范围。IAA是刺激植物生长发育最具代表性且最常用的内源激素,因此解释了IAA的检出率最高。目前我国的国家食品安全风险监测工作要求豆芽中不得检出4-CPA、IAA、IBA等植物生长调节剂,本研究较高的检出率说明,市场上植物生长调节剂滥用现象依然存在,有待进一步的监管和规范。
3 结 论
本研究通过优化前处理方法建立了同时测定豆芽中4-氯苯氧乙酸、吲哚乙酸、吲哚丁酸残留量的GC-MS/MS方法,方法在0.5~10.0 μg/mL浓度范围内线性关系良好,检出限为6.0~9.0 μg/kg、定量限为12.0~23.0 μg/kg,3个不同浓度水平下加标回收率为82.1%~106%,能够满足于豆芽中植物生长调节剂的定性和定量检测。且应用该方法测定了贵阳市107份豆芽样品中3种植物生长调节剂的测定,其中IAA检出率较高,说明市场上植物生长调节剂滥用现象依然存在,有待进一步的监管和规范。
