γH2AX、53BP1及RAD51焦点用于分析DNA双链断裂损伤
2020-03-12王依朝王红霞杨思路崔雅妮段奕鋆段静静任来峰
王依朝, 樊 丽, 王红霞, 杨思路, 崔雅妮,段奕鋆, 段静静, 任来峰, 苏 文
(1. 山西医科大学 第二临床医学院,太原 030013; 2. 山西医科大学附属肿瘤医院研究所,太原 030013)
基因组不稳定是肿瘤的标志性特征之一。各种内外源性基因毒因素如紫外线、电离辐射(ionize radiation,IR)、化学因素、活性氧、DNA复制错误等皆可诱导产生DNA损伤,包括单链断裂(single strand breaks,SSBs)、链间二聚体及双链断裂(double strand breaks,DSBs)等而引起基因组不稳定[1]。DNA损伤形成后,可激活细胞内称为DNA损伤应答的精密调控反应,招募一系列的损伤应答蛋白到损伤位点,介导细胞周期阻滞修复损伤的DNA或诱导凋亡清除修复无望的细胞,维持基因组稳定性[2-3]。
DSBs损伤是最为严重的DNA损伤类型,其修复主要通过非同源末端连接(nonhomologous end joining, NHEJ)和同源重组(homologous recombination, HR)两种方式[2]。DSBs损伤形成后其断裂点的组蛋白H2AX(组蛋白H2A变体)139位丝氨酸被迅速磷酸化形成所谓的γH2AX而参与DNA损伤应答过程,用特异性抗体染色后可在荧光显微镜下看到相应的焦点(foci),γH2AX foci分析已被公认为是DSBs损伤的标志之一[4-5]。53BP1是另外一种参与DSBs损伤应答的关键蛋白,其foci分析也成为评价DSBs损伤的标志[3]。RAD51则是参与DSBs的HR修复的关键蛋白之一,用于分析DSBs损伤修复的HR途径[6-7]。
γH2AX foci分析是目前最常用的DSBs损伤评价指标,然而,近来有研究[8-14]发现γH2AX foci在某些情况下与DSBs损伤并不完全一致。因此,本实验通过电离辐射和喜树碱作为不同类型的DNA损伤诱导方法,研究以上几种修复蛋白在DSBs损伤时的动力学变化,探讨各指标用于评估DSBs合理性。
1 材料与方法
1.1 材料
人肝癌SMMC-7721细胞系为本实验室保存;DMEM培养基及胎牛血清均购自GIBCO公司;抗53BP1抗体购自Thermo公司;抗γH2AX抗体购自Millipore公司;抗RAD51抗体购自武汉三鹰生物技术有限公司;FITC荧光标记抗鼠和Cy3标记的抗兔二抗均购自Sigma公司;DAPI染料购自Vector公司。
1.2 方法
1.2.1 细胞培养
SMMC-7721肝癌细胞培养在DMEM高糖培养基中(含10%胎牛血清及1%抗生素),置于含5% CO2的培养箱中37 ℃连续培养,每1~2 d换液,细胞生长至80%~90%汇合度时使用胰酶消化传代。
1.2.2 X-ray诱导DNA损伤
将细胞接种到细胞爬片上,待其长至对数生长期且汇合度达70%~80% 时,X光辐照仪(RX-650)照射2 Gy 或10 Gy,继续培养并分别在照射后1、4、12、24和36 h收样进行免疫荧光检测,同时以设未照射组为对照(0 h)。
1.2.3 CPT诱导DNA损伤
将细胞接种到细胞爬片上,待其长至约40%~50% 汇合度时用CPT(2 μmol/L)持续处理,并分别在处理后3、24和36 h收样进行免疫荧光检测,同时设未处理组为对照组(0 h)。
1.2.4 免疫荧光(immunofluorescence,IF)检测
细胞经4%多聚甲醛室温下固定10 min,0.3% Triton X-100(PBS配制)通透10 min;再经2% BSA(PBS配制)室温封闭30 min后,先后用特异性一抗和荧光素标记二抗湿盒内37 ℃分别孵育30 min;最后经DAPI染色并封片后在荧光显微镜下观察结果,每组独立实验至少分析100个细胞的foci数,实验重复3次,取平均值。
1.2.5 数据处理与统计
实验数据用平均数±标准差的形式表示,显著性分析通过SPSS 18.0 软件进行,组间均数比较采用t检验或方差分析,率的比较采用卡方检验,以P<0.05为差异有统计学意义,P<0.01表示差异极其显著。
2 结果与分析
2.1 电离辐射诱导的γH2AX和53BP1 foci分析
分别用2 Gy和10 Gy的X-ray照射7721细胞诱导DSBs损伤,并在照射后不同时间点收样,通过免疫荧光染色分析γH2AX与53BP1 foci动力学变化情况。结果显示,未照射的细胞几乎无γH2AX及53BP1 foci形成,经2 Gy剂量照射后γH2AX及53BP1 foci数在1 h后达到峰值且几乎100% 细胞都为γH2AX及53BP1 foci阳性细胞,然后随着时间的推移逐渐减少,24 h后已基本消失;此外,γH2AX及53BP1 foci基本上可以共定位在DNA损伤位点(图1-A、B)。细胞经大剂量(10 Gy)X-ray照射后,γH2AX与53BP1 foci数在相应时间点明显多于2 Gy照射组,其变化趋势类似2 Gy照射组;需要注意的是,随着时间的推移γH2AX及53BP1 foci 消退速度减慢,直到照射后36 h仍有较多foci(图1-C、D)。这些结果提示:γH2AX与53BP1在细胞DSBs形成后可被募集到损伤部位参与损伤修复进程,随着损伤DNA逐渐被修复,γH2AX与53BP1逐渐恢复到基线水平;而大剂量X-ray照射引起更为严重的损伤,其修复进程相应减缓。
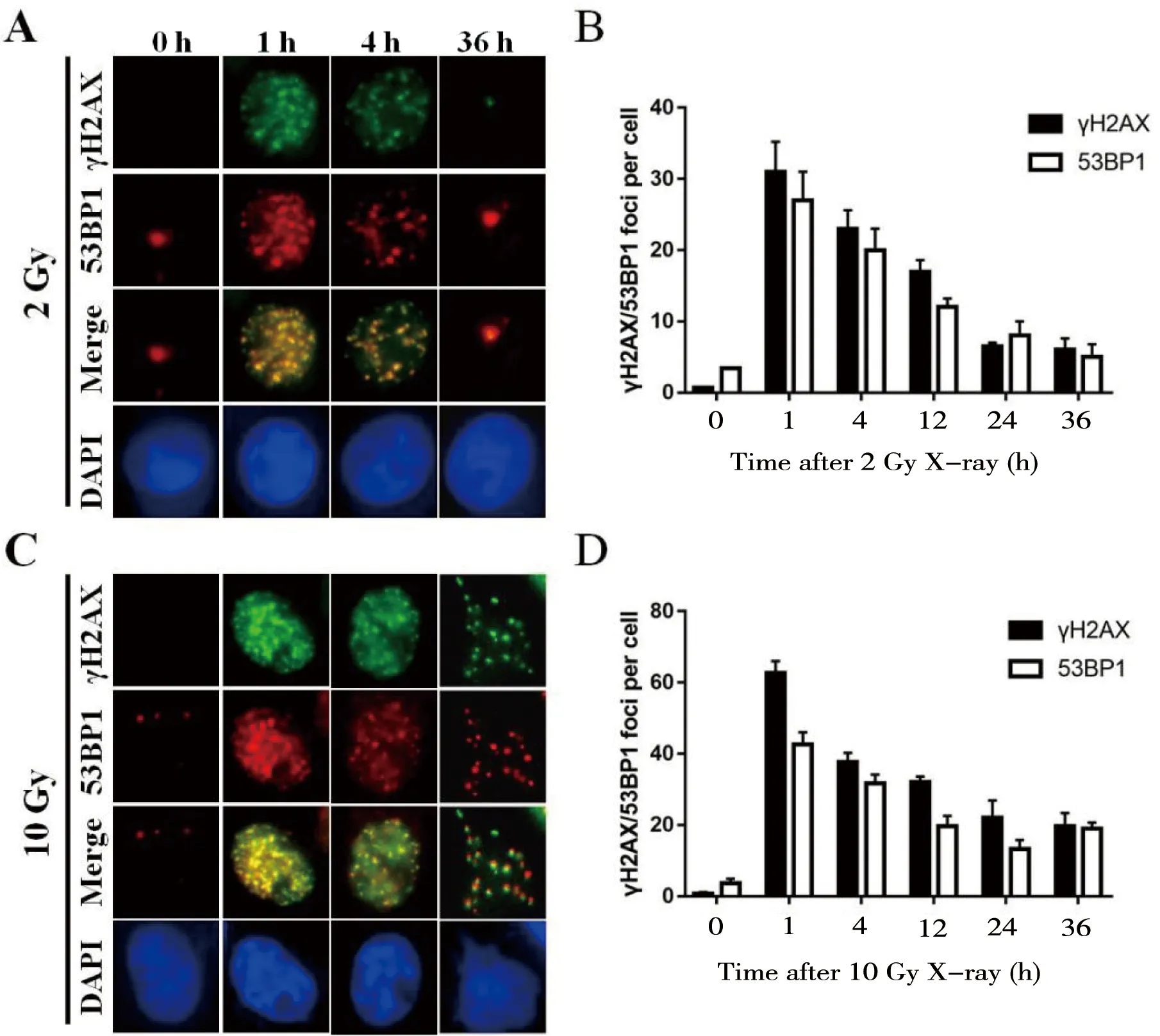
A 和 C:用抗γH2AX和53BP1抗体染色,分析经X-ray 2 Gy(A)和10 Gy(C)辐照的7721细胞,并计数细胞内相应foci数; B和D:统计分析A和C中γH2AX及53BP1 foci数量,误差线代表n=3的标准差
图1γH2AX和53BP1foci在IR处理后的动力学变化
Figure 1 The dynamic changes of γH2AX and 53BP1 foci after IR treatment
2.2 电离辐射诱导的RAD51 foci动力学变化
7721细胞经2 Gy或10 Gy的电离辐射后,RAD51 foci数均呈现出先上升后下降的趋势。2 Gy剂量组,RAD51 foci计数峰值为4 h,36 h后foci基本消退;而10 Gy剂量组foci高峰延迟至12 h,且36 h后仍有较多foci(图2-A、B)。结果提示RAD51也参与了细胞DSBs损伤修复动力学过程。

A:用抗RAD51抗体染色,分析经X-ray 2 Gy或10 Gy照射的7721细胞,并计数细胞内相应foci数; B:统计分析A中RAD51 foci数量,误差线代表n=3的标准差
图2RAD51foci在IR处理后的动力学变化
Figure 2 The dynamic changes of RAD51 foci after IR treatment
此外,如图3所示,电离辐射诱导的RAD51 foci也可与γH2AX foci共定位,但RAD51 foci阳性细胞仅约占所有细胞的20%~30%,而几乎100%细胞产生γH2AX foci。这就说明,与γH2AX不同,RAD51仅参与部分DSBs损伤细胞的修复过程。
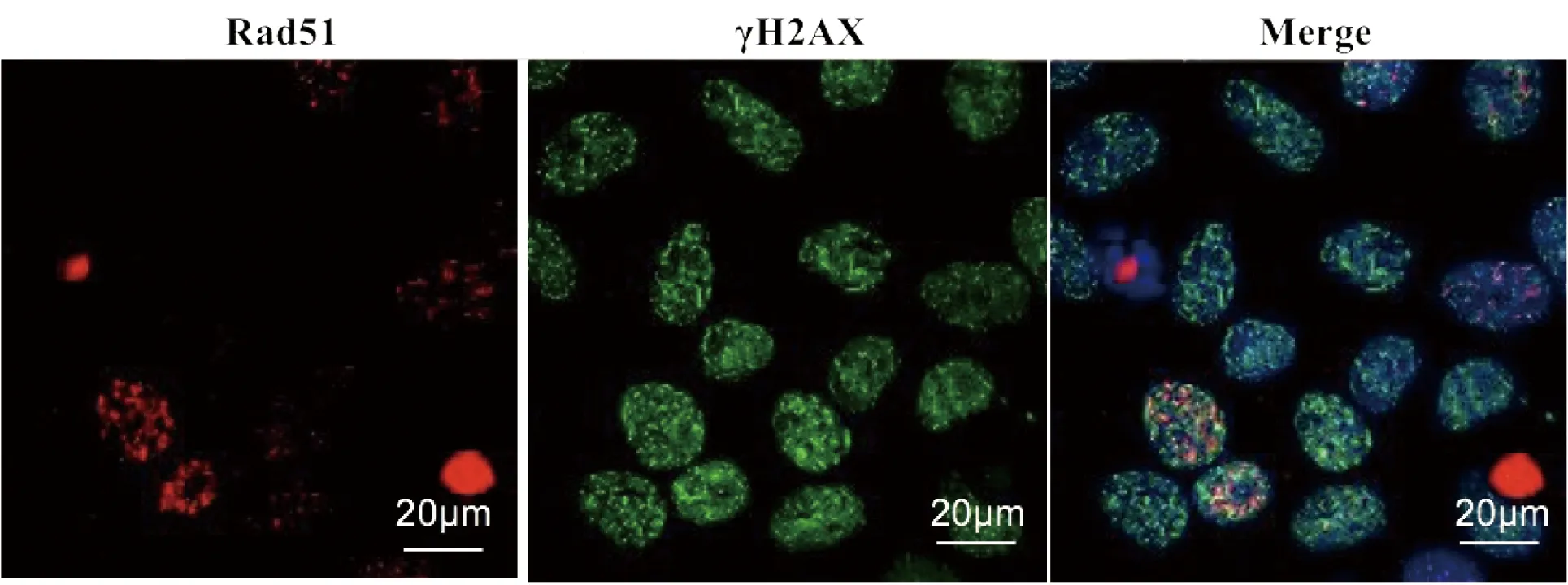
用X-ray 2 Gy照射的7721细胞4 h后,经抗γH2AX和RAD51抗体染色并分析结果
图3电离辐射诱导的γH2AX和RAD51foci模式
Figure 3 γH2AX and RAD51 foci modes induced by IR
2.3 CPT诱导的γH2AX和53BP1 foci 动力学变化
为进一步研究γH2AX和53BP1 foci用于评估DNA双链断裂损伤的准确性,我们用CPT(短期处理主要诱导DNA单链损伤,长时间处理引起大量双链断裂)处理细胞不同的时间,然后进行免疫荧光染色分析。如图4-A和4-B所示:CPT未处理组(对照组)细胞几乎无γH2AX和53BP1 foci形成;CPT处理3 h组细胞形成两种模式的γH2AX foci, 模式1为亮而离散的类似于电离辐射诱导的foci类型,模式2为小而致密的泛核γH2AX染色(泛核磷酸化),模式1约占γH2AX阳性细胞的(20.67±3.62)%;随着处理时间的延长,呈现模式1型γH2AX染色的细胞比例逐渐增高,CPT处理12 h组约占γH2AX阳性细胞的(59.33±2.58)%,而CPT处理24 h组约占γH2AX阳性细胞的(79.00±2.12)%。此外,53BP1 foci仅出现在模式1类型的γH2AX阳性细胞,且与γH2AX foci共定位。

A:经CPT处理7721细胞预示时间点后,免疫荧光分析γH2AX和53BP1 foci变化情况(箭头代表模式1,即亮而离散的类似于电离辐射诱导的foci类型;三角代表模式2,即为小而致密的γH2AX泛核磷酸化染色)。B:统计分析A中γH2AX和53BP1 foci阳性细胞比例,误差线代表n=3的标准差
图4CPT诱导的γH2AX和53BP1foci的动力学变化
Figure 4 The dynamic changes of γH2AX and 53BP1 foci induced by CPT
3 讨论
DSBs损伤形成后,γH2AX可在损伤位点迅速形成,30~60 min达峰值,随着DSBs修复的完成逐渐消退,其foci数与DSBs数量正相关, 故γH2AX foci分析成为目前评估DSBs修复动力学的最常用指标[4-5]。53BP1在DSBs损伤后被招募到损伤位点参与NHEJ修复过程,也是广泛应用的DSBs损伤修复评价指标[5]。Yan等[15]的研究显示,DSBs损伤后,细胞γH2AX和53BP1 foci迅速达峰值(1 h)且呈现出动力学变化过程。Tsvetkova等[16]的研究表明,IR诱导细胞DSBs损伤后,γH2AX和53BP1 foci数量相当且可共定位;而Reindl等[17]的研究发现,DSBs形成后γH2AX和53BP1 foci 数量和大小大致相同,但定位存在细微差异。本研究中,我们首先以X-ray为DSBs损伤诱导剂,研究了γH2AX和53BP1 foci的动力性变化。结果表明(图1),细胞经X-ray(2/10 Gy) 照射后诱导γH2AX和53BP1 foci形成,且二者具有高度一致性(数量相近,能共定位),均在照射后1 h达峰值,随时间延长foci数逐渐降低,反映了DSBs损伤的动力性修复过程;需注意的是,高剂量(10 Gy)X-ray照射后在各相应时间点γH2AX和53BP1 foci数明显多于低剂量照射组。由此可见,我们的研究结果同国内外报道基本符合,γH2AX和53BP1 foci分析均可较为准确地反映电离辐射诱导的DSBs损伤修复过程,是理想的DSBs损伤评价指标。
RAD51则参与DSBs损伤的HR修复过程,仅在S/G2期细胞的损伤修复中发挥作用[6-7,18]。Anastasia Tsvetkovazu等[16]的研究表明,DSBs诱导时RAD51 foci仅出现在增殖细胞(Ki67阳性)中。Judith Reindl等[17]的超微结构观察发现,RAD51 foci仅出现部分53BP1 foci阳性细胞可共定位但尺寸小于后者,可能是损伤部位的53BP1 foci被驱出后RAD51进入而介导同源重组。我们的RAD51 foci染色结果发现(图2-A、B,图3):1)RAD51 foci也在损伤诱导后呈现动力性变化,照射后4 h达峰值,以后逐渐消退;2)与γH2AX foci(几乎100%细胞阳性)不同,仅有20%~30%的细胞产生明显的RAD51 foci。这与RAD51仅参与S/G2期细胞的HR修复的研究结果一致。
最近有研究表明,γH2AX诱导可不依赖于DSBs损伤,单链损伤、复制阻滞及凋亡等均可诱导γH2AX形成[8-14]。
为进一步探讨γH2AX和53BP1 foci与DSBs损伤的一致性,我们采用DNA拓扑异构酶抑制剂CPT作为DNA损伤诱导剂,其可诱导的损伤类型较为复杂,包括单链损伤和双链断裂损伤等[4]。我们的结果(图4-A、B)显示,CPT处理后细胞形成两种模式的γH2AX染色,亮而离散的foci和泛核磷酸化;53BP1 foci仅出现在亮而离散的γH2AX foci阳性细胞中,且与γH2AX foci共定位;这就提示γH2AX泛核磷酸化很可能与DSBs损伤不相关。我们还发现,短时间(3 h)处理后,γH2AX染色以泛核磷酸化为主,随着处理时间的延长,γH2AX染色逐渐转向以亮而离散的foci为主;我们推测CPT短时间作用主要引起DNA的单链损伤而形成泛核磷酸化形式的γH2AX,随着作用时间延长,单链损伤逐步积累而形成双链单链,γH2AX染色也相应转变为亮而离散的foci类型。
本研究系统探讨了DNA损伤时γH2AX、53BP1及RAD51 foci的动力性变化及其在DSBs损伤评估中的合理应用。我们的结果表明,γH2AX和53BP1 foci分析均可较准确的用于电离辐射诱导的DSBs损伤修复评价,而RAD51 foci分析仅适用于DSBs损伤的同源重组修复。此外,我们还发现在CPT处理时可形成不依赖DSBs损伤的γH2AX染色。因此,应用γH2AX染色评估DSBs损伤需保持谨慎,必须充分考虑损伤诱导因素并结合53BP1 foci分析等综合评价。
