类风湿关节炎患者血清长链非编码RNA表达谱的差异性分析
2020-03-12张立平陈芳芳李晓军
刘 鹭,张立平,陈芳芳,于 娟,李晓军
0 引 言
类风湿关节炎(rheumatoid arthritis,RA)主要特征为以手、足等小关节的滑膜腔慢性炎症为主的自身免疫性疾病,起病隐匿,病因不明,好发于35~70岁人群,且女性多于男性[1-2]。目前作为RA的诊断和分层指标多采用蛋白类生物标志物,主要包括各种自身抗体如类风湿因子(rheumatoid factor, RF)和抗环瓜氨酸肽抗体(anti-cyclic citrullinated peptide antibody, A-CCP)及相关炎症分子等[3-4]。近些年,含microRNA(miRNA)以及长链非编码RNAs(long non-coding RNA,lncRNA)在内的非编码RNA(ncRNA)[5]在RA中的作用也越来越受到关注。研究表明,包括RA在内的许多自身免疫病的发生发展与lncRNA的突变或失调有关[6],采用高通量测序及基因芯片等技术[7],在RA患者关节滑膜、软骨、血液(体液)样本及细胞包括FLSs、PBMCs、淋巴细胞等中均发现异常表达的lncRNAs[8]。本研究前期发现,相较于SLE疾病组、健康对照组,RA患者HOTAIR血清水平显著较高,RA血清HOTAIR水平正向相关于DAS28评分与CRP血清水平[9]。为进一步全面分析RA患者血清中lncRNAs的差异表达情况,本研究采用基因芯片技术对RA患者及健康体检人员血清进行lncRNAs差异表达及生物信息学分析。
2 材料与方法
1.1 研究对象收集2017年11月至2018年11月于本院中西医结合科入院就诊的RA患者和健康体检人员血清标本。其中RA患者血清标本30份(RA组),健康体检人员的血清标本30份(对照组)。入组RA患者符合2010年美国风湿病学学会(ACR)以及欧洲抗风湿联盟(EULAR)制定的“RA诊断标准”[10]。本研究获得东部战区总医院伦理委员会的批准(批件号:2014GJJ-023)。两组抗环瓜氨酸肽抗体(A-CCP)、类风湿因子(RF)、血细胞沉降率(ESR)、C反应蛋白(CRP)、白细胞介素-6(IL-6)差异有统计学意义(P<0.05)。见表1。

表1 芯片样本基本资料Table 1 Basic information and data of the RA group and NC group of the chip sample
1.2研究方法
1.2.1 血清总RNA的提取以TRIzol试剂(Invitrogen,ThermoFisherScientific,MA)操作步骤为参照,进行血清内总RNA的提取。采用Qubit荧光计进行定量。
1.2.2反转录合成First Strand cDNA& Second Strand cDNA吸取5 μL总RNA至0.2 mL无核酸酶的离心管中,标记为1号。再加Spike A (Agilent)2.0 μL,同时配制反转录反应混合物5 μL,混匀瞬时离心,7500 r/min, 后加到1号管中,共12 μL体系,轻柔吹吸混匀后瞬时离心,将此管标为2号。借助PCR仪,进行反应,以下为反应条件:25 ℃,60 min;42 ℃, 60 min;4 ℃,5 min。待完成反应,将管取出,再瞬时离心。完成0.05 mL的Second Strand反应混合物的制备,待吹吸混匀2~3次后,瞬时离心,移至2号管内,体系总量为0.06 mL,混匀瞬时离心,并标记此管为3号,同时利用PCR仪,进行反应,以下为具体反应条件:16 ℃,60 min;65 ℃,10 min;4 ℃,5 min。
1.2.3体外转录合成cRNA先进行0.03 mL体外转录反应混合物体系的制备,待混匀短暂离心,离心管最下端可见沉淀。把此反应混合物转移至3号管内,待混匀瞬时离心完成,标记此管为4号,借助PCR仪,进行反应,以下为具体的反应步骤:于40 ℃下,反应16 h;于4 ℃温度下保持。待结束反应,瞬时离心处理,对cRNA产物实施纯化处理,同时借助紫外分光光度计,实施定量分析。
1.2.4cRNA反转录生成cDNA取0.01 mg已完成纯化处理的cRNA产物,定容为22 μL,同时移至不含核酸酶成分的离心管(0.2 mL)内,再放入2 μL的Random Primer,充分混合,借助PCR仪,进行相关反应,以下为具体反应步骤:70 ℃,5 min;25 ℃,5 min;4 ℃,2 min。瞬时离心后得到沉于底部的溶液,将该管标记为5号。配制cRNA反转录反应混合物16 μL,混匀瞬时离心后溶液沉至管底,再加到5号管内,共40 μL体系,混匀短暂离心,此管标为6号并在PCR仪上反应,反应条件设置为:25 ℃,10 min;40 ℃,1.5 h;70 ℃,10 min;4 ℃,5 min。将2 μL的RNase H添加至6号管内,待混合后,进行瞬时离心处理,设置PCR仪反应如下:37 ℃,45 min;95 ℃,5 min;4 ℃,5 min。待反应完成,对cDNA进行纯化处理,同时进行定量分析,上述反转录总流程都于冰上进行。
1.2.5荧光标记向经反转录、纯化所得cDNA产物内添加引物Random Primer,通过Klenow Fragment 酶,进行cDNA互补链的合成,同时添加内有荧光基团分布的Cy3-dCTP(GEHealthcare),对cDNA进行纯化(Nucleospin©Extract II, MACHEREY-NAGEL),同时对标记产物进行定量分析,供芯片杂交用。
1.2.6芯片杂交及扫描洗脱纯化的cDNA标记产物,依次加入2X GExHyb Buffer,Formamide,Sample三种试剂,共计110 μL。吸取0.1 mL杂交液放至杂交盖片围栏内,把附标签的一面向下盖于围栏上,同时旋紧。先将杂交盒安装好,再向托盘内添加稍许超纯水,于45 ℃温度下,杂交过夜。借助芯片洗干仪(Slide Washer8,博奥)对芯片进行清洗,最后离心甩干。把单管标记cy3-dCTP纯化洗脱产物的总量调整为27.5 μL,待用。
1.3图像采集和数据分析对处理结束的芯片进行扫描,同时借助Agilent Feature Extraction v10.7软件进行数据的分析与提取,再借助软件Agilent GeneSpring标准化处理数据,并分析表达谱差异倍数。以上基因芯片实验由北京博奥晶典生物技术有限公司提供技术支持。对差异表达的lncRNA进行GO&Pathway分析、共表达分析、靶基因预测、转录因子预测等。
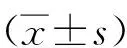
2 结 果
2.1 基因芯片数据的质量控制散点图显示lncRNA的离散度较低,基本呈45度对角线分布。见图1。在血清lncRNA表达谱上,RA组与对照组存在显著差异。见图2。上述结果可证明,本试验的生物学重复性稳定,部分外在干扰,如芯片质量及技术操作也未对基因芯片的结果造成影响。
2.2差异表达的lncRNAs基因芯片分析结果显示,在表达谱方面,RA组与对照组差异有统计学意义(P<0.05)。由图3可知,与对照组比较,RA组1693个lncRNAs表现出显著性差异表达,在总lncRNAs中占比为23.67%,其中376个lncRNAs的表达上调超过2倍,1317个lncRNAs表现为表达下调;11个lncRNAs表达上调超过了4倍。见表2。35个lncRNAs表达下调超过了7倍。见表3。

图1 lncRNAs散点图Figure 1 Scatter plot of lncRNAs
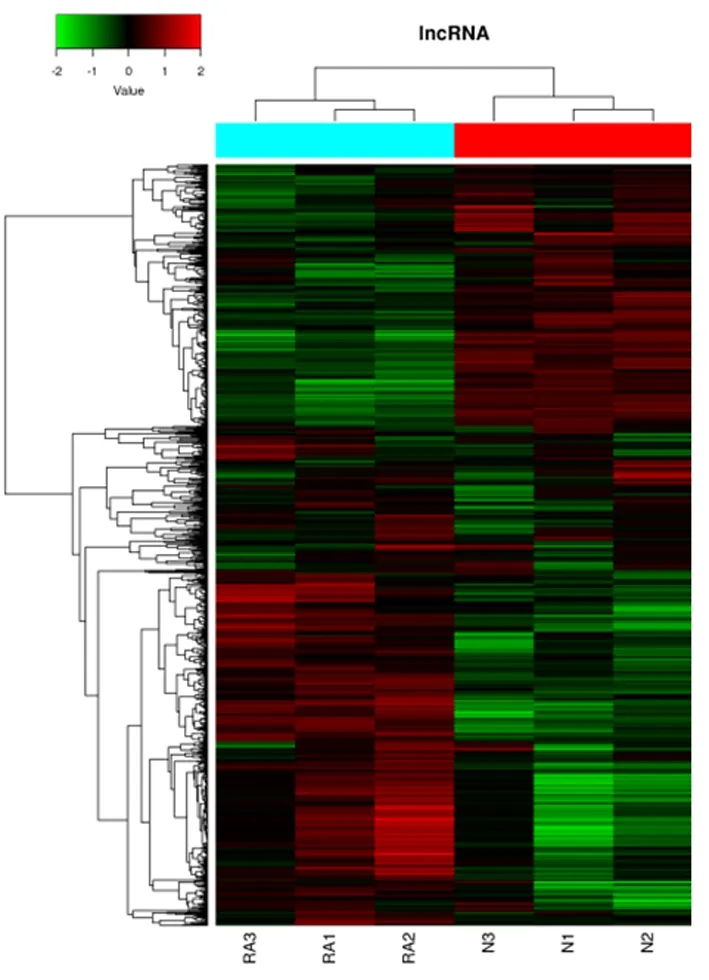
图2 类风湿关节炎组、健康体检人员组血清lncRNAs聚类图Figure 2 The cluster diagram of serum lncRNAs in the rheumatoid arthritis groups and the normal control groups

图3 lncRNAs火山图Figure 3 Volcano plot of lncRNAs

表2 4倍以上表达上调的lncRNAsTable 2 lncRNAs with up-regulated expression (FC>4)

表3 7倍以上表达下调的lncRNAsTable 3 lncRNAs with down-regulated expression (FC>7)
2.3差异表达基因GO富集分析对于表现出显著的差异表达谱开展GO富集分析,发现376个高表达基因影响到丝状肌动蛋白、细胞骨架、树突生长锥及肌动蛋白丝束的收缩等分子功能284项,有补体激活途径、抗生素的运输、肽酰丝氨酸去磷酸化的正向调控及腺苷酸分解等生物学过程1455项,以及四环素运输活动、2-羟戊二酸的脱氢酶活性、肌动蛋白丝的绑定、磷酸丝氨酸磷酸酶活性等细胞组成分析253项。
2.4差异表达基因KEGG Pathway分析对表达谱差异有统计学意义的基因进行KEGG Pathway分析显示,主要与脂肪酸的生物合成、胰岛素抵抗通路、腺苷酸活化蛋白激酶信号通路、内吞作用通路等有关。见图4。

图4 RA差异表达基因KEGG通路图Figure 4 KEGG pathway of RA differentially expressed genes
3 讨 论
LncRNA为一类长度在200nt以上的非编码RNA,同时还被当做非功能性RNA[11],由于其显著影响胚胎发育、肿瘤与细胞生长[12]、免疫信号而受到广泛重视[13-14]。LncRNA可从多层面对基因表达进行调控,包括表观遗传调控层面、转录后层面、转录调控层面[15-17]。在自身免疫性疾病的发生发展中,某些特定的lncRNA的表达会发生改变,并在免疫调控中发挥重要作用,lncRNA的发现为研究自身免疫病的侵袭、转移和生物学标志提供了重要依据[18-20]。
随着人类基因组计划草图的完成,生命科学逐渐要求对基因进行大规模、并行性分析。传统的分子生物学方法已不能满足这一需求,而高通量、大规模的基因芯片技术则为此需求提供了可能,因此被广泛地应用于生物医药研究的各个领域[21-22]。表达谱芯片是将数量众多的寡核苷酸固定在载体基质上制备成的基因芯片,它基于T7启动子线性扩增技术,通过T7聚合酶体外转录双链cDNA模板得到cRNA (complement RNA),目的是为了增加模板量,又不会改变本身表达的差异,这种扩增方法线性较好,能扩增出足够数量的cDNA靶分子。利用同一用量和限制循环次数的条件,通过RT-PCR可平行的扩增实验组和对照组的RNA样本以满足实验要求并同时进行荧光标记[23]。经过一定时长的芯片杂交反应,将未与探针发生特异结合的样品清洗掉,随后对玻片进行激光共聚焦扫描,测定芯片上的各点的荧光发光强度,推算出各基因的相对表达水平。该芯片使用单通道实验,它的实验结果重复性更好,也使得比较不同样品之间各种基因表达的相对比例是可靠的。
在自身免疫性病变中,RA为多系统性、炎症性、慢性病变的重要疾病,此病主要特征为主要体现在手部、足部的小关节慢性、对称性炎症,同时大多合并关节外的器官损伤,会引发关节畸变与机能丧失[8, 24-26]。本研究收集了30例RA患者与30例健康体检人员血清样本,通过基因芯片表达谱进行生物信息学分析,根据分组信息,进行差异比较,得到差异基因,对差异的lncRNA进行GO和KEGG 通路分析、共表达分析、靶基因预测、转录因子预测等。本研究发现了1693个差异表达的lncRNAs,他们与胰岛素抵抗通路、腺苷酸活化蛋白激酶信号通路、内吞作用通路等有关,并参与了补体激活途径、腺苷酸分解过程、腺苷受体结合等生物学过程。结果显示,在存在显著性差异表达的1693个lncRNAs中,有376个表达上调超过了2倍,有1317个表达下调超过了2倍;有11个表达上调超过了4倍;有35个表达下调超过了7倍。
LncRNA能够经由和相邻基因的互作,对周围基因表达加以调控,也可经由 miRNA的间接作用,对远端基因表达加以调控,判断lncRNA可能干预的mRNA[27-29]。通过对顺式作用和反式作用的预测,互相作用的差异表达lncRNA和mRNA有301对,分为顺式作用为60对,其中顺式作用又分为正义30对、反义9对、双向2对、基因间16对、基因内2对。反式作用预测是lncRNA和mRNA之间通过microRNA的竞争性促进作用,经过blat计算,得到lncRNA和mRNA的反式作用有243对。
此次研究对于显著差异表达基因开展了更为深入的GO富集分析,还有对KEGG Pathway进行了分析,从而对其作用展开初步探究。从GO富集分析结果显示,376个上调基因共参与了1455项生物学过程,如:补体激活途径、抗生素的运输、腺苷酸分解过程;参与了284项分子功能,如:丝状肌动蛋白、肌动蛋白丝束的收缩、膜攻击复合物;和253项细胞组成,如:2-羟戊二酸的脱氢酶活性、磷酸丝氨酸磷酸酶活性、腺苷受体结合等过程。本研究对表达谱差异有统计学意义的基因也进行KEGG Pathway通路分析,结果显示Pathway分析可能主要与脂肪酸的生物合成、胰岛素抵抗通路、腺苷酸活化蛋白激酶信号通路、胆甾醇丁酸酯的代谢通路、同源重组通路、内吞作用通路等有关。
综上所述,lncRNA在RA中的作用也越来越受到关注,通过生物信息学方法可为筛选自身免疫性疾病相关lncRNA提供一个方便、快捷的途径。在解决研究的盲目性以及节约时间和成本上起到一定的作用,也可为lncRNA与RA之间进一步研究提供理论依据,以期系统阐述这些差异表达的lncRNA在RA的发生、发展及治疗中的作用和机制[30],为寻找RA新型标志物提供了新的思路,为后续实验奠定了基础,从而实现RA的精准化诊治,提高RA患者的生存质量。
