黄芩提取物对鱼类水霉病病原菌的抑制机制
2020-03-12蒋飞勇何小娥王文龙
石 浩, 蒋飞勇, 何小娥, 王文龙
(湖南应用技术学院农林科技学院,湖南常德 415000)
水霉是水霉属的真菌之一,可感染淡水鱼及鱼卵,这些感染通常被称为“水霉病”,水霉病是水产养殖中最常出现的真菌性寄生疾病,别称肤霉病、白毛病、覆棉病或水棉病等[1]。水霉孢子感染受伤鱼体的皮肤或鱼卵容易引起水霉病,因淡水鱼易感染水霉病,给渔业生产造成了巨大的经济损失[2]。而在渔业上用来防治水霉病的化学药物具有广谱抗菌、使用便捷、见效快等特点,但化学药物又有其自身的缺点,包括致癌症、致畸形、致突变、高毒副作用、高残留及极易产生抗药性等问题[3]。中草药在防治水产养殖动物病害中的应用也早有研究,1990年童裳亮研究了5种野生的植物提取液对鱼病毒效应及抗鱼病菌的效果[4];汪晓娟等研究了鱼藤酮、蛇床子素、百部碱、苦楝素及烟碱5种植物提取物对水霉菌的抑制作用,发现这些植物提取物对水霉菌均有抑制作用,且抑制效果从强至弱表现为烟碱<蛇床子素<百部碱<鱼藤酮<苦楝素[5]。目前,中药资源常被利用为水霉病的防治药剂,由于中草药中的有些有效成分会以破坏真菌的细胞壁、阻碍真菌的正常合成、影响真菌正常代谢等方式来影响水霉菌的正常生长[6],并且中草药具有来源广泛、不易产生耐药性、低残留、低成本等特点[7]。中药黄芩的药用价值很高[8],不管是在医学临床方面还是在植物药方面都有广阔的应用前景。国内外有关的研究报道很多,例如,宋丽雅等通过对花椒的抑菌机制研究,发现花椒提取物通过改变细胞膜的通透性及影响细胞壁来达到抑菌的效果[9]。云宝仪等研究黄芩素对金黄色葡萄球菌的抑制作用及其抑菌机制发现,黄芩素使金黄色葡萄球菌的细胞膜渗透性增大[10]。但关于黄芩提取物对水霉菌的抑制机制还未见相关报道。本研究初步探讨黄芩提取物对鱼类水霉病病原菌的抑制机制,以期为防治鱼类水霉病和水产养殖研发安全、高效、无污染、无残留的绿色药品提供试验依据和理论依据。
1 试验材料与方法
1.1 药品与仪器
1.1.1 主要试验药品 中药黄芩、孢子悬浮液、水霉菌、马铃薯液体培养基、黄芩提取物、无菌生理盐水、葡萄糖、葡萄糖溶液、葡萄糖标准溶液、浓硫酸、草酸、醋酸、蒽酮、pH值为7.0的磷酸缓冲液、石英砂、茚三酮、蛋白质标准溶液、考马斯亮蓝G-250试剂、50 mmol/L磷酸缓冲液、130 mmol/L 甲硫氯酸(Met溶液)、氨基酸标准溶液、750 μmol/L NBT溶液、100 μmol/L乙二胺四乙酸二钠(EDTA-Na2)、20 μmol/L 核黄素、10% H2SO4、0.1 mol/L H2O2、0.1 mol/L KMnO4。
1.1.2 主要试验仪器 250H恒温培养箱,购自金坛国旺实验仪器厂;BA310Digital数码显微镜,购自麦克奥迪实业集团有限公司;UV5100B紫外分光光度计,购自上海元析仪器有限公司;L400离心机,购自金坛国旺实验仪器厂;7230型分光光度计,购自上海仪田精密仪器有限公司;OK-98-Ⅱ恒温水浴锅,购自上海市泰斯特仪器有限公司;YXQ-SL-100S11高压灭菌锅,购自上海博迅实业有限公司医疗设备厂;QLF-6020真空冷冻干燥机,购自北京乐普纳科技有限公司;JA2003N电子天平,购自上海佑科仪器仪表有限公司。
1.2 试验方法
1.2.1 黄芩提取物对水霉菌生长发育影响试验
1.2.1.1 对孢子形成的试验 制备孢子悬浮液105CFU/mL:于6孔板加入马铃薯液体培养基 500 μL 和孢子悬浮液100 μL;待10 h孢子全部萌发后,将黄芩提取物分别按质量浓度0、10、50、100、300、500 mg/L制成终体积为1 mL总液体;将6孔板放入18 ℃培养箱培养3 d,采用血球计数板进行计数。
1.2.1.2 对孢子萌发的试验 制备马铃薯液体培养基;制备孢子悬浮液105CFU/mL;在6孔板中加入马铃薯液体培养基 500 μL 和孢子悬浮液 100 μL;将提取物分别按质量浓度0、10、50、100、300、500 mg/L制成终体积为1 mL的总液体;待 10 h 后观察孢子萌发情况,进行计数处理,计算萌发率。
1.2.1.3 对菌丝生长抑制率的试验 黄芩提取物分别按质量浓度为0、100、200、300、400、500 mg/L制成PDA平板,于超净工作台完成此操作,将直径0.9 cm的供试病菌菌饼块置于含药剂的培养基平板中央,每皿1块,每处理3次重复,放于18 ℃培养箱中培养4 d。测量菌落净生长距离,计算菌丝生长抑制率。
菌丝生长抑制率=(对照菌落净生长距离-处理菌落净生长距离)/对照菌落净生长距离×100%。
1.2.1.4 对菌丝生长量的测定 将活化好的水霉菌用无菌生理盐水洗下,过滤掉菌丝,制得孢子悬浮液(105CFU/mL)。马铃薯液体培养基冷却后于无菌条件下采用移液器加入孢子悬浮液1 mL,18 ℃振荡培养,待菌丝球生长良好时加入提取物,对照组则为不添加组。继续培养5 d后,过滤得菌丝体,采用蒸馏水反复冲洗菌丝,将培养基去除干净,在真空冷冻干燥机中冻干至恒质量,精确称取菌丝体的质量。每个处理重复3次,试验重复3次。
1.2.2 黄芩提取物对水霉菌生理代谢影响试验
1.2.2.1 菌丝总糖含量的测定 (1)总糖含量的测定采用苯酚试剂法[11]。葡萄糖的标准曲线制作:取6支洁净试管并依次编号,分别依次加入0.0、0.2、0.4、0.6、0.8、1.0 mL的100 μg/mL葡糖糖标准溶液,在各试管中加入1 mL 6%苯酚溶液,并立刻在各试管中加入5.0 mL浓硫酸,充分摇匀,静置10 min,各试管补水至7 mL,在波长495 nm下依次测量反应液吸光度,横坐标为标准的葡萄糖质量m(μg)、纵坐标为吸光度并以绘制葡萄糖标准曲线。按下列数据依次加入各种溶液,得标准曲线:y=0.013 6x+0.071 8(r2=0.993 6)。
(2)样品处理与测定。精确称取0.5 g水霉菌丝,放于研钵,加入5 mL蒸馏水研磨,转入三角瓶,再加水至50 mL左右,再用塑料薄膜封好瓶口,在沸水中提取15 min,水浴冷却至室温,定容至250 mL刻度线处,过滤得滤液。各取1 mL上清液于3支试管中,调零组加1 mL蒸馏水,按照标准曲线方法进行加样和显色测定,重复3次,取其平均值。
含糖量=(m×V)/(VS×m1×106)×100%。
式中:m表示查标准曲线所得的糖质量,μg;V表示总体积,mL;VS表示测定时所取体积,mL;m1表示样品质量,g。
1.2.2.2 菌丝蛋白质含量的测定 (1)绘制蛋白标准曲线,采用了考马斯亮蓝法[12]。取6支玻璃试管,采用1 000 mL移液管分别量取100 μg/mL蛋白质标准溶液0.0、0.2、0.4、0.6、0.8、1.0 mL于 10 mL 玻璃试管中,在各试管中加蒸馏水补齐至1.0 mL,然后在每支试管中加入4 mL考马斯亮蓝试剂,迅速振荡摇匀,静置5 min后在595 nm处测定溶液的吸光度D595 nm,以蒸馏水作为空白组。横坐标为牛血清白蛋白含量m′(μg)、纵坐标为溶液的吸光度D,得出标准曲线:y=0.012 1x-0.005 2(r2=0.996 7)。
(2)样品处理与测定。称取菌丝0.5 g,加入pH值7.0磷酸缓冲液8 mL和少量石英砂,充分研磨成匀浆,加磷酸缓冲液定容至10 mL,然后于 4 ℃、10 000 r/m离心20 min,取出上清液并低温保存备用。分别取0.1 mL上清液于3支试管中,调零组加0.1 mL蒸馏水,按照标准曲线方法进行加样和显色测定,重复3次,取其平均值。
样品蛋白质含量(mg/g)=(m′×V)/(VS×m2)。
式中:m′表示查得的蛋白质质量,×10-3mg;V表示提取液总体积,mL;m2表示样品质量,g;VS表示测定时取用提取液体积,mL。
1.2.2.3 氨基酸含量的测定 (1)标准曲线的确定。准确吸取200 μg/mL氨基酸标准溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0 mL(相当于0、100、200、300、400、500、600 μg氨基酸)放置在7支试管中,将pH值为 6的缓冲溶液稀释至5.00 mL,再在其中加入茚三酮水溶液1 mL,充分摇匀,在沸水浴中加热10 min;冷却直至室温,在波长569 nm下测定吸光度。采用氨基酸质量m″(μg)和吸光度制作标准曲线:y=0.001 2x+0.005 7(r2=0.994 0)。
(2)样品处理与测定,采用茚三酮法[13]。称取菌丝 0.5 g,加10%醋酸5 mL,后于研钵中研碎,采用蒸馏水洗移入100 mL容量瓶中,加水定容,然后再过滤至三角瓶中,最后取滤液测定。吸取1 mL样品溶液,调零组加1 mL蒸馏水,按照标准曲线制作的步骤,在相同的条件下测定吸光度D值,测得的D值可以在标准曲线上查到对应的氨基酸质量(μg)。
氨基酸含量(mg/g)=m″×100/M3。
式中:m″表示查得的蛋白质质量,×10-3mg;M3表示菌丝质量g;
1.2.3 黄芩提取物对水霉菌酶活性影响试验
1.2.3.1 超氧化物歧化酶(SOD)活性的测定 (1)酶液提取。取新鲜水霉菌菌丝0.2 g于预冷研钵中,加2 mL预冷的0.05 mol/L、pH值7.8磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为 10 mL。于4 000 r/min下离心15 min,上清液即为酶粗提液。
(2)显色反应。取3支试管编号,1号试管为测定管,另外2、3号试管为对照管,3支试管分别加入50 mmol/L磷酸缓冲液5.0 mL、130 mmol/L Met溶液0.3 mL、750 μmol/L NBT溶液0.3 mL、100 μmol/L EDTA-Na21.0 mL、去离子水 2.0 mL、20 μmol/L核黄素0.3 mL,其中1号样品试管加入 0.3 mL 酶液、另外2支对照管加入0.3 mL缓冲溶液。混合均匀后将1支对照组试管放在暗处,其他试管放于4 000 lx的日光下反应20 min,后立刻遮光,以遮光管为对照调零,在560 nm下测定光的密度。待反应结束后,以没有照光的对照管作空白,分别测定其他试管的吸光度。
SOD总活性=(Di-Do)×V/(Di×0.5×m×Vt)=(Di-Do)/(Di×0.015×m);
式中:Di表示光照对照管的吸光度;Do表示样品管的吸光度;V表示样品液总体积,mL;m表示水霉菌菌丝质量,g;Vt表示测定时样品用量(0.3 mL)。
1.2.3.2 过氧化氢酶(CAT)活性的测定 取 50 mL 三角瓶4个(2个为测定组,另2个为对照组),测定瓶加入“1.2.3.1”节酶液1 mL,对照加煮死酶液1 mL,再加入2.5 mL 0.1 mol/L H2O2,同时计时于18 ℃恒温水浴中保温10 min,立即加入10% H2SO42.5 mL。采用0.1 mol/L KMnO4标准溶液作滴定,直到出现粉红色(且在30 s内粉红色不消失)为终点。酶活性用1 g鲜质量菌丝中过氧化氢酶在1 min内分解H2O2的质量(mg)表示:
过氧化氢酶活性=(A-B)×n/(m×1.7×t)。
式中:A表示对照KMnO4滴定的质量,mg;B表示酶反应后 KMnO4滴定的质量,mg;m表示水霉菌菌丝质量,g;t表示反应时间;“1.7”表示1 mol/L KMnO4相当于1.7 mg H2O2;n表示酶液稀释倍数。
1.2.4 统计分析 采用WPS 2018软件进行图形的制作。采用statistix 8软件对试验数据进行统计分析。取α=0.05显著性水平,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 黄芩提取物对水霉菌生长发育的影响
2.1.1 不同质量浓度黄芩提取物对水霉菌孢子的影响 黄芩提取物对水霉菌孢子形成与萌发均具有较强的抑制作用。由表1可知,随黄芩提取物质量浓度的增大,产生的孢子数逐渐变少,当黄芩提取物质量浓度达到300 mg/L时,孢子数量仅为 0.10×106个,质量浓度达500 mg/L时,水霉孢子几乎停止生长。同时,随黄芩提取物浓度的增加,对水霉菌孢子萌发的抑制率逐渐增加,当黄芩提取物质量浓度在10~100 mg/L之间时,抑制率呈大幅度上升趋势,但抑制率最高未超过60%;当提取物质量浓度于300~500 mg/mL时,抑制率高达90%以上。由此可知,当提取物质量浓度达到300 mg/L及以上时,黄芩对水霉菌的繁殖代谢具有加强的抑制作用。

表1 不同质量浓度黄芩提取物对水霉菌孢子形成的影响
2.1.2 不同质量浓度黄芩提取物对菌丝生长的影响 黄芩提取物对水霉菌菌丝的生长具有较强的抑制作用。由表2可知,随着黄芩提取物质量浓度的增大,对水霉菌菌丝生长的抑制率逐渐增强,当黄芩提取物质量浓度达到300 mg/L时,抑制率达到65%以上;当黄芩提取物质量浓度达到400 mg/L时,抑制率达到85%以上。试剂空白对照组菌丝的生长量达15 mg左右;当黄芩提取物质量浓度为100 mg/L时菌丝生长量为 12.32 mg;当提取物质量浓度达400 mg/L时,菌丝生长量为2.07 mg;当黄芩提取物质量浓度达至500 mg/L时,菌丝生长量接近1.50 mg,说明当黄芩提取物质量浓度在500 mg/L时对水霉菌的生长具有非常的大抑制效果。
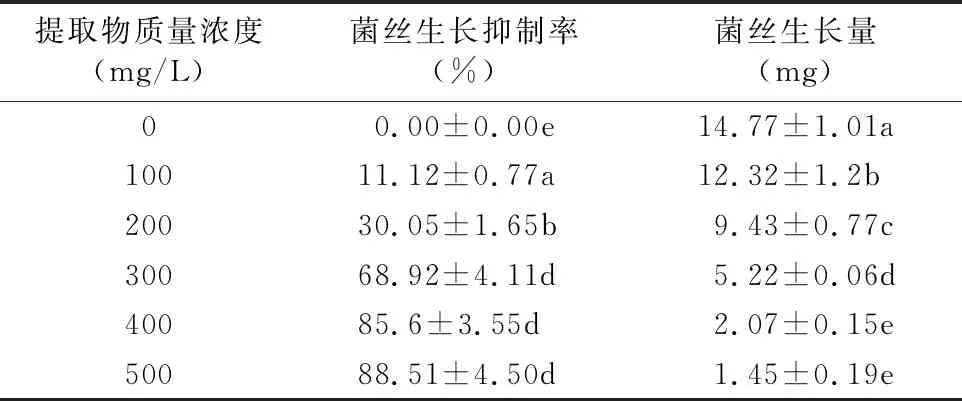
表2 不同质量浓度黄芩提取物处理对水霉菌生长的影响
2.2 黄芩提取物对水霉菌生理代谢的影响
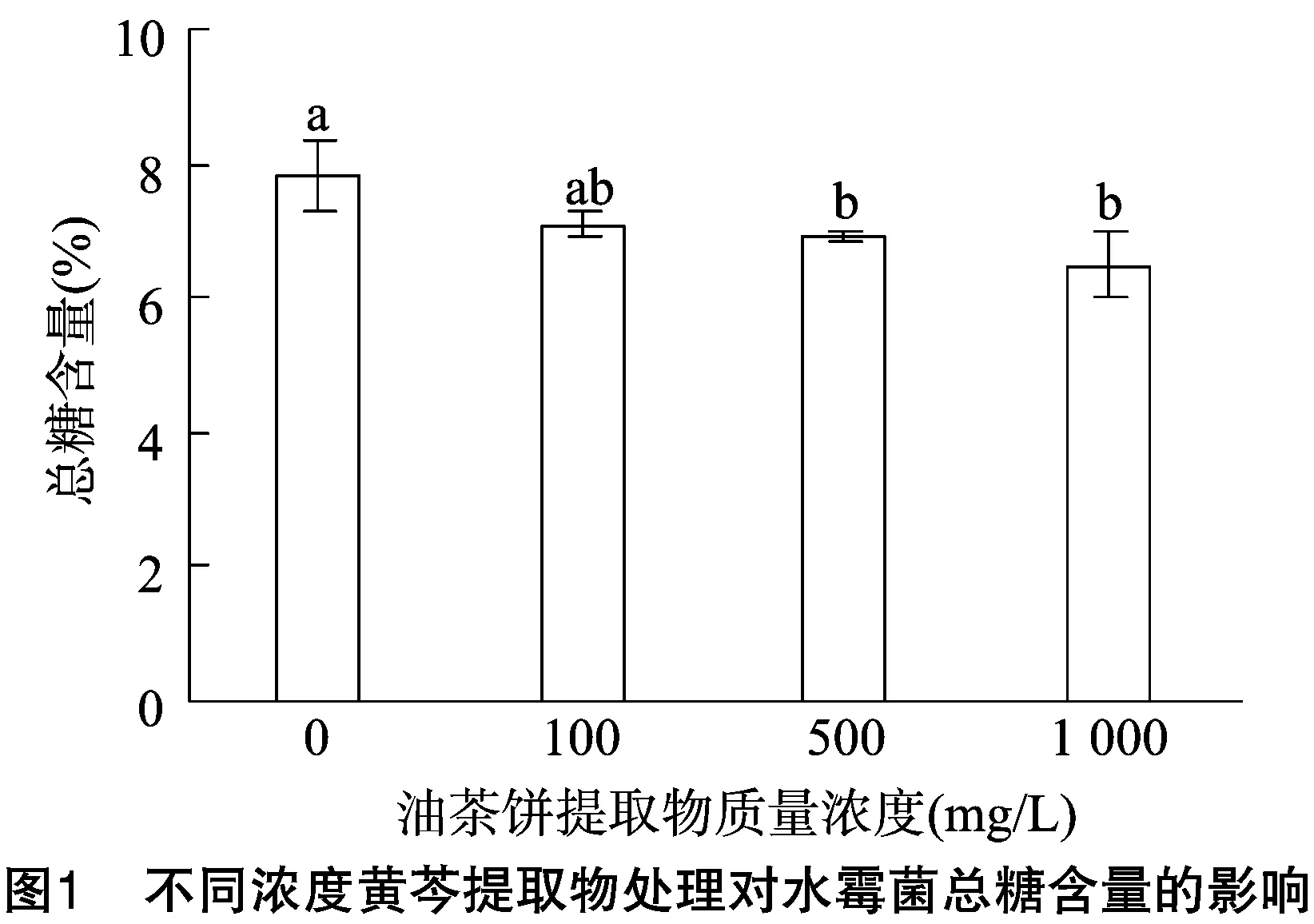
2.2.1 不同浓度黄芩提取物对菌丝总糖含量的影响 由图1可知,随着黄芩提取物质量浓度的增大,水霉菌菌丝总糖含量在逐步下降。当黄芩提取物质量浓度为0 mg/L时,菌丝总糖含量占8%左右,当黄芩提取物质量浓度在100~1 000 mg/L时,菌丝总糖含量在逐步下降,但是菌丝总糖含量下降最多也仅为 1.5% 左右,说明黄芩提取物对水霉菌丝总糖含量的影响效果不明显。这可能是由于提取物在破坏菌丝细胞结构,影响菌丝的生长代谢,将多糖分解为小分子糖,但其体内总糖含量的减小量并不大。
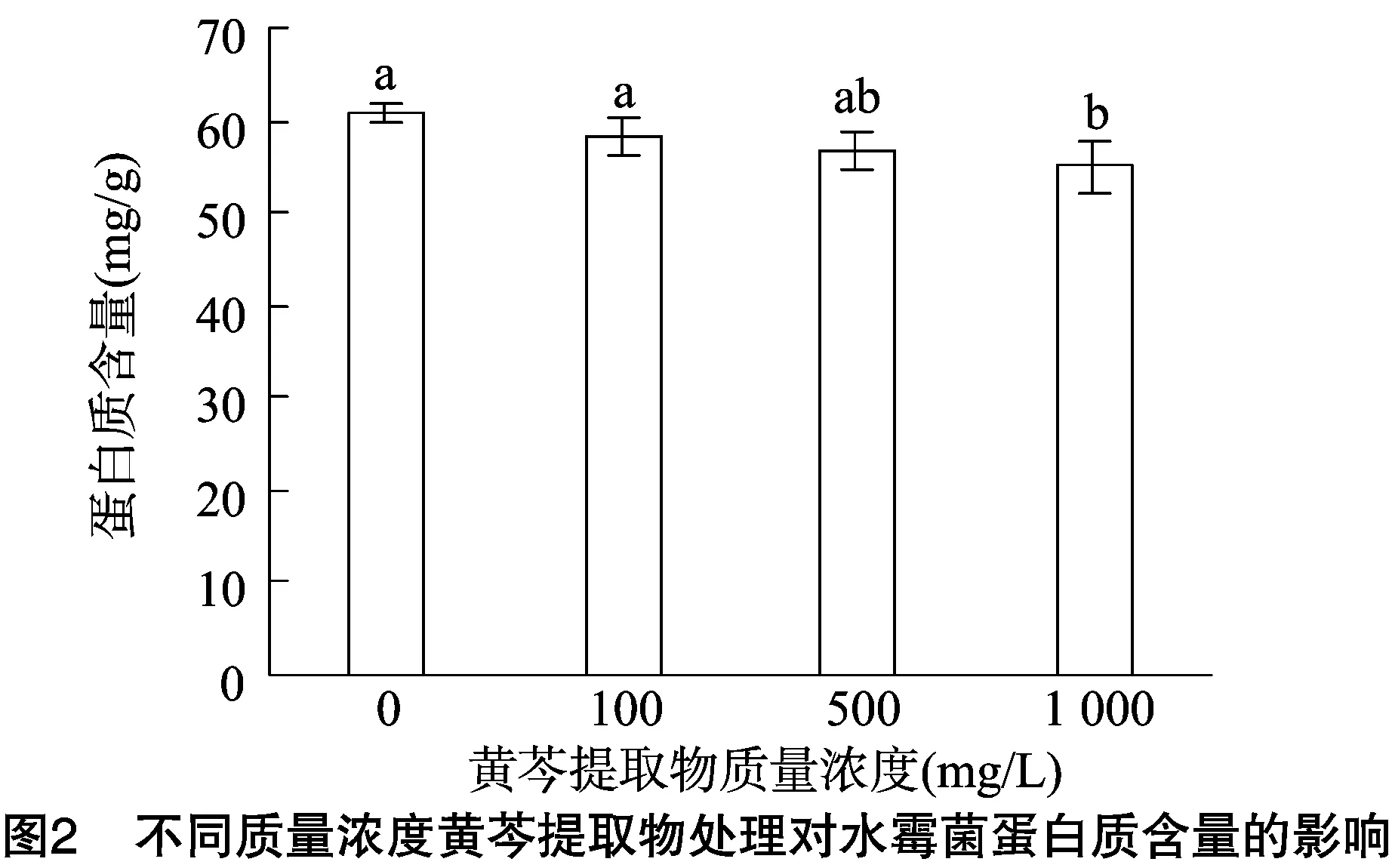
2.2.2 不同浓度黄芩提取物对菌丝蛋白质含量的影响 由图2可知,随着黄芩提取物质量浓度的增大,水霉菌菌丝蛋白质含量在逐步下降。黄芩提取物质量浓度为0时,菌丝蛋白质含量是60.31 mg/g;当质量浓度为100 mg/L时,菌丝蛋白质含量下降至58.21 mg/g;当质量浓度上升至1 000 mg/L时,菌丝蛋白质含量仍在55.67 mg/g。可见黄芩提取物对水霉菌丝蛋白质含量的影响虽有一定减小的趋势,但不显著(P>0.05)。说明在高质量浓度时菌丝生长代谢受到了较大的抑制,蛋白质形成的更新量已逐渐减少或趋近为0。
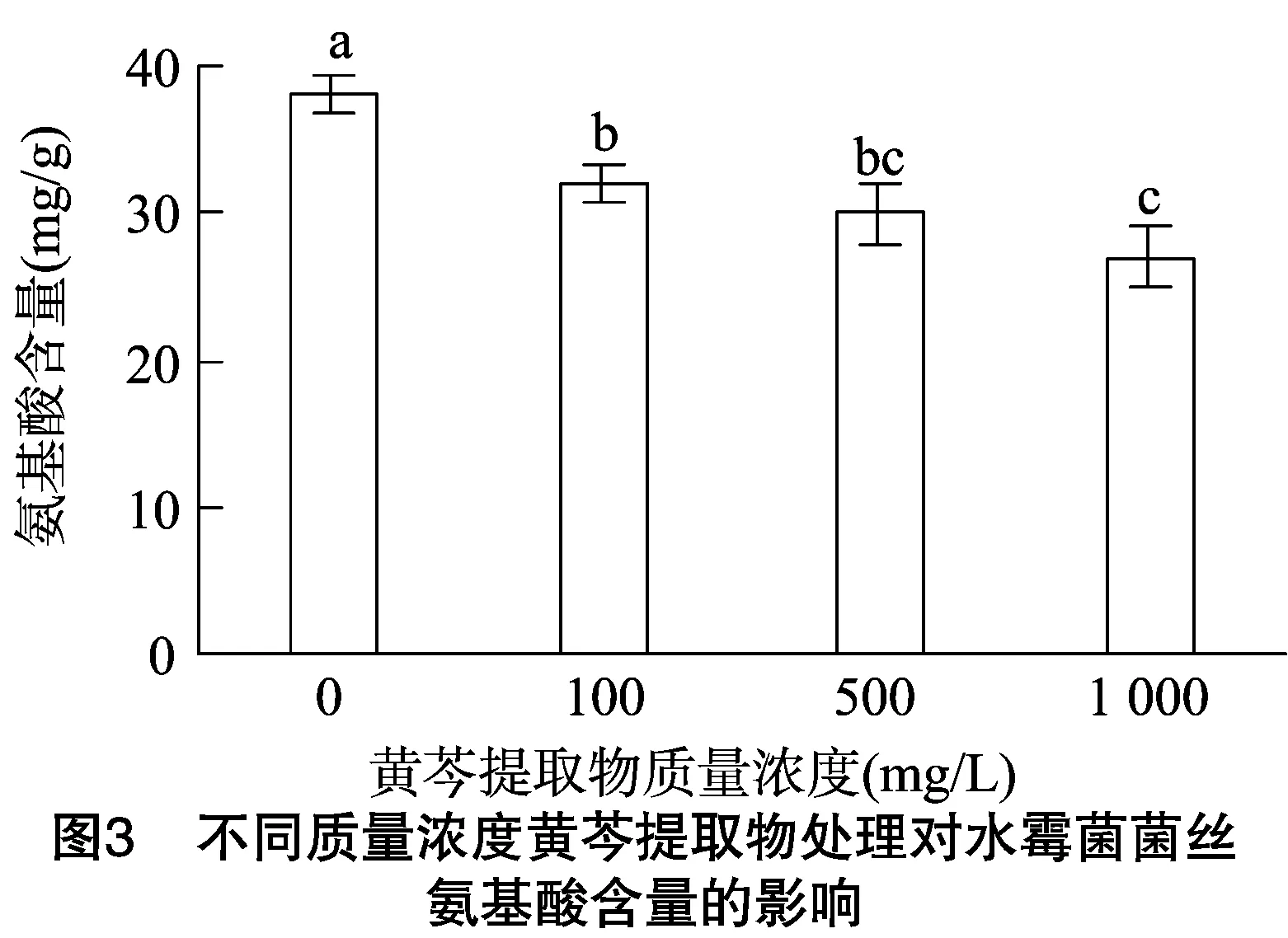
2.2.3 不同质量浓度黄芩提取物对菌丝氨基酸含量的影响 由图3可知,随着黄芩提取物质量浓度的增大,水霉菌菌丝氨基酸含量呈递减趋势,递减幅度在高质量浓度处理时较大。黄芩提取物质量浓度为0时,菌丝蛋白质含量是 38.32 mg/g;当黄芩提取物质量浓度在0~100 mg/L 之间时,氨基酸含量下降显著(P<0.05),100 mg/L时氨基酸含量下降至32.38 mg/g,说明黄芩提取物对菌丝氨基酸的形成具有较明显的抑制效果;当质量浓度为 1 000 mg/L 时菌丝氨基酸含量下降至27.04 mg/g,其菌丝氨基酸含量的变化结果与蛋白质含量相一致。
2.3 黄芩提取物对水霉菌酶活性的影响
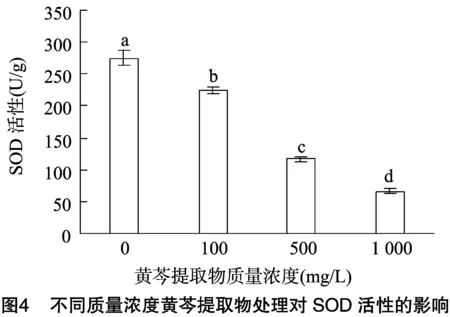
2.3.1 不同质量浓度黄芩提取物对SOD活性的影响 由图4可知,随着黄芩提取物质量浓度的增大,水霉菌菌丝SOD活性呈递减趋势。当没有添加黄芩提取物时,由图4可知,是275 U/g;但当黄芩提取物质量浓度在100 mg/L时,SOD活性有下降但幅度不是很大,说明黄芩提取物在这个质量浓度范围对菌丝SOD活性的抑制作用不明显。但当黄芩提取物质量浓度在500 mg/L 时;SOD活性显著下降(P<0.5),说明黄芩提取物在这个质量浓度时对菌丝SOD活性的抑制作用强,对菌生长代谢的影响大。
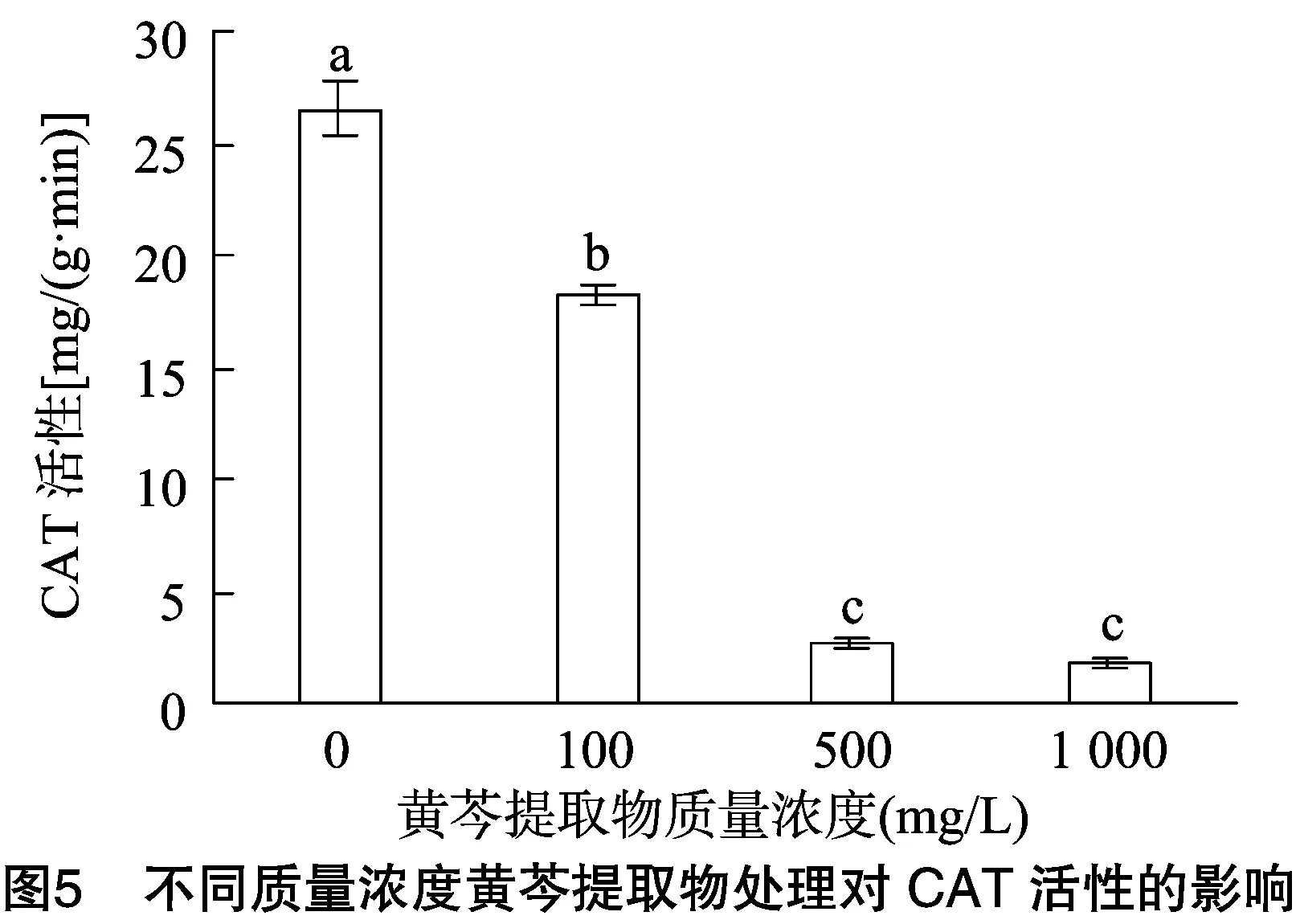
2.3.2 不同质量浓度黄芩提取物对CAT活性的影响 由图5可知,随着黄芩提取物质量浓度的增大,水霉菌菌丝CAT活性同样呈递减趋势。由图5可知,当黄芩提取物质量浓度在0~500 mg/L 之间时,CAT活性下降显著(P<0.05),说明黄芩提取物质量浓度在500 mg/L时对菌丝CAT活性的抑制作用强。当黄芩提取物质量浓度为1 000 mg/L时,CAT活性下降不明显且较为缓慢,说明菌丝体CAT活性于500 mg/L时,几乎受到了最大限度的抑制,因此随着后期处理质量浓度的进一步提高,菌丝酶活减少量非常少。
3 讨论
为初步研究黄芩提取物对水霉菌抑制机制,本试验从水霉菌的繁殖、生长、理化、酶活性质等方面进行分析测定,当提取物质量浓度达到300~500 mg/L 时,孢子的形成量非常少,仅在0.01×106~0.10×106个之间,同时孢子萌发抑制率更是达到了90%以上,这可能是提取物破坏了菌丝的生殖代谢,菌丝孢子不能够正常形成或形成不具有活性的孢子[14-15]。对菌体分别采用PDA液体、固体培养基的培养,当提取物质量浓度达到400~500 mg/L 时,菌丝生长抑制率达到85%以上,菌丝生长量仅为1.5 mg左右,相对于空白组(14.77 mg)减少了约90%,这可能由于提取物迫害菌丝的正常生长代谢、阻碍了菌丝细胞的分裂与分化,从而有效地抑制菌丝生长[16]。糖、蛋白质、氨基酸是菌丝生长的主要代谢物之一,当菌丝停止生长或生长受到抑制时这些指标含量均会有所下降,通过试验分析可知,当黄芩处理质量浓度在1 000 mg/L时,三者含量均有一定程度的下降,且下降量均达到了5%以上,说明提取物可有效阻碍菌丝的糖代谢和蛋白代谢,从而影响菌丝的生长,直至死亡。菌丝体内酶活性的强弱同样是衡量菌体生长代谢强弱的主要指标之一,通过研究发现当采用1 000 mg/L提取物处理时,氧自由基和过氧化氢自由基清除酶的活性菌均有很大程度提高,分别达到60%、80%左右,说明此时菌体自由基的清除能力非常差,菌体正加速衰老和死亡。通过抑菌机制研究分析测定可有效判定菌死亡的原因,可为相类似绿色抑菌产品的开发奠定基础。本研究抑菌机制指标较少,后期可进一步从菌丝细胞结构、关键基因表达与代谢进行分析,以期更全面地探索抑菌机制。
