家蚕抗性品系NC99R抗BmNPV作用机制分析
2020-03-12董战旗雷雪蛟秦琪张新铃唐亮石美宁潘敏慧
董战旗,雷雪蛟,秦琪,张新铃,唐亮,石美宁,潘敏慧,2
·农业生物技术·
家蚕抗性品系NC99R抗BmNPV作用机制分析
董战旗1,2*,雷雪蛟1*,秦琪1,张新铃1,唐亮3,石美宁3,潘敏慧1,2
1 西南大学 家蚕基因组生物学国家重点实验室,重庆 400716 2 西南大学 农业农村部蚕桑生物学与遗传育种重点实验室,重庆 400716 3 广西壮族自治区蚕业技术推广总站,广西 南宁 530007
家蚕是具有重要经济价值的鳞翅目模式昆虫,由家蚕核型多角体病毒 (nucleopolyhedrovirus,BmNPV) 引起的家蚕血液型脓病每年给我国蚕桑产业造成巨大的经济损失。文中拟通过鉴定目前存在的家蚕抗病毒品系NC99R抗性特征,初步解析其抗BmNPV机制,以期为家蚕抗病品系分子机制解析提供一定参考。将对照组大造 (Dazao,DZ) 品系和实验组NC99R抗性品系家蚕幼虫分别定量添食BmNPV包涵体 (Occlusion bodies,OB),计算DZ和NC99R品系对BmNPV的半致死剂量 (Median lethal dose,LD50),结果显示DZ品系半致死剂量为1.2×105多角体/头,抗性品系NC99R的半致死剂量为1.8×106多角体/头,抗性水平相比对照组提高15倍左右。进一步统计分析DZ和NC99R品系口服感染1×106多角体/头和体腔注射1×106粒子/头出芽型病毒粒子 (Budded virus,BV) 后的死亡率,结果显示DZ品系死亡高峰集中在第4–6天,NC99R抗性品系死亡高峰集中在第6–8天,与对照相比延迟1–2 d。通过RT-PCR分析BmNPV DNA拷贝数,显示DZ在口服感染和体腔注射后BmNPV基因组都快速增殖,抗性品系NC99R BmNPV DNA拷贝数缓慢增加。HE染色分析显示DZ和NC99R品系在口服感染前期没有显著差异,感染到96 h,DZ中肠细胞核变大,成脱落趋势;而抗性品系NC99R,细胞核膨大,但细胞排列仍较整齐。RT-PCR分析病毒不同时期基因表达显示抗性品系NC99R在口服感染和体腔注射24 h后早期基因开始下调表达,其他时期基因随即下调表达;最后维持在较低表达水平或消失。
家蚕,家蚕核型多角体病毒,抗性,NC99R
我国是世界第一蚕丝大国,蚕茧和蚕丝产量分别占世界的76%和81%。蚕桑产业的发展对增加农民收入、解决三农问题和生态建设、环境保护具有重要作用。但是,每年蚕病给我国蚕桑产业造成巨大的经济损失,其中家蚕核型多角体病毒(nucleopolyhedrovirus,BmNPV)感染引起的家蚕血液型脓病尤为严重[1]。目前,由中国农业科学院蚕业研究所培育的“华康”系列和广西壮族自治区蚕业管理总站培育的“桂蚕N2”都取得了显著的抗BmNPV效果[2-3]。其中,桂蚕N2原种是由中系NC99R和NC9C、日系NJ7和NJZ四元杂交获得,其中NC99R是以抗病品种材料955萍和932 (石) 为母本(99),限性品种CVDAR为父本(R) 进行杂交选育的抗性品系,适宜亚热带蚕区饲养[4]。因此,鉴定其亲本NC99R抗BmNPV特征及其抗病机制,可为桂蚕N2综合性状改良和家蚕抗病育种研究提供新的思路,也为家蚕抗BmNPV关键基因筛选提供基础支撑。自20世纪70年代开始,国内外研究者就通过攻毒试验筛选对BmNPV耐受性较高的家蚕品系,对抗性品种选育提供了大量基础数据[5-6]。1991年,陈克平首次对现存的344个家蚕品系进行了抗病毒耐受性筛选,确定家蚕耐受BmNPV呈正态分布,并发现一株抗BmNPV抗性较高的品系NB;随后对该品系和其亲本易感品系306进行了定位克隆、重测序、双向电泳、转录组和蛋白组等分析,鉴定到一些抗BmNPV相关基因,为家蚕抗病育种研究提供了大量素材[6-13]。同时,由中国农业科学院蚕业研究所过选育的“华康”系列也具有高抗BmNPV能力,对其亲本抗性品系871C和敏感品系871进行了大量基础数据分析和机制研究,目前已经初步定位其抗性基因所在染色体位置,并对BmNPV在该品系中侵染特征进行解析,确定了其侵染阻断路径在BmNPV复制第一轮完成之后[3, 14-15]。而“桂蚕N2”自2006年选育以来,对其抗性特征描述和抗性机制解析鲜有报道,对其抗性特征基础研究更为匮乏。鉴于其在两广地区推广应用价值,迫切需要确定其亲本NC99R抗性特征和抗性机制[4, 15]。本研究通过分析BmNPV入侵家蚕中肠细胞和血液特征,鉴定BmNPV在抗性品系中受抑制机制,是从病毒角度着手解决家蚕抗性品系抗病机制的重要切入点。通过分析家蚕抗性品系NC99R抗BmNPV特征,确定家蚕抗性品系阻断BmNPV入侵特征,可为家蚕抗性品系抗性机制解析提供借鉴,为家蚕抗病育种研究提供思路。
1 材料与方法
1.1 家蚕品系和病毒
家蚕大造品系、抗性品系NC99R和BmNPV病毒为西南大学家蚕基因组生物学国家重点实验室保存。
1.2 半致死剂量分析
正常饲养对照品系DZ和抗性品系NC99R至四龄起蚕,挑选叶面平整的新鲜桑叶剪裁成 1 cm×1 cm,每片桑叶定量添加不同浓度梯度的病毒悬液(106PIBs /mL、l07PIBs/mL、108PIBs/mL、109PIBs/mL和1010PIBs/mL),每头家蚕幼虫添加10 μL,终浓度为1×104、1×105、1×106、1×107和1×108多角体/头,阴性对照桑叶上添食相同体积的ddH2O。每组选择40头个体体型相似的健康的DZ和NC99R品系幼虫,待桑叶表面风干后,逐头幼虫进行口服感染喂食病毒粒子,饲养1–4 h后,分别挑选完全吃完桑叶的DZ和NC99R品系幼虫30头进行正常饲养,每天按正常品系进行喂养,统计喂食后10 d内家蚕幼虫死亡个体,并解剖确定感染BmNPV,统计每天死亡率,并计算最终死亡率。利用SPSS软件计算半致死剂量。
1.3 BmNPV DNA拷贝数分析
DZ和NC99R品系分别感染BmNPV 6、12、24、48、72、96 h后,每组分别提取中肠组织,−80 ℃保存。取灭菌后预冷的干净研钵,加入液氮和中肠组织,研磨成细粉状,收集到1.5 mL无RNA酶离心管中,利用Promega全基因组提取试剂盒提取中肠组织BmNPV基因组DNA。BmNPV基因组DNA提取步骤为:1) 加600 µL核酸裂解液,剧烈振荡为流动液体;2) 加200 µL蛋白质纯化液,振荡20 s,置于冰上5 min,13 400 r/min离心10 min;3) 吸取上清至包含600 µL异丙醇的离心管中,轻轻颠倒混匀,直至出现白色线性DNA,13 400 r/min离心5 min;4) 弃上清后加600 µL预冷的70%乙醇,轻轻颠倒,13 400 r/min离心5 min,弃上清;5) 在超净工作台风干酒精后,加入30 µL DNA提取液在65 ℃溶解1 h,测取DNA提取浓度,根据所测浓度加水稀释至浓度为100 ng/µL,进行定量PCR,根据BmNPV DNA标准曲线计算不同样品BmNPV拷贝数[16]。本研究所用引物见表1。
1.4 石蜡切片制备和染色
DZ和NC99R品系分别感染BmNPV 0、12、24、48、72、96 h后,分别将每组干净的中肠组织取出,放置于3倍体积以上的固定液中做好标记并保存,固定24 h后用70%乙醇换洗样品,直到淡黄色消失为止,将样品放置于包埋盒中−4 ℃保存在70%乙醇中。将包埋盒进行脱水、透明、浸蜡、包埋以及切片等一系列的操作后,根据样品名称、切片厚度、日期做好相应的标记放置于展片板在37 ℃烘箱过夜或60 ℃烘烤2 h。将蜡片经过脱蜡、水化后进行染色,其中苏木精染细胞核,伊红染细胞质,染色后进行脱水和透明,镜检检查染色情况是否合格,最后封片,干燥后利用荧光显微观察不同样品,并记录。
1.5 荧光定量PCR (RT-PCR) 分析
DZ和NC99R品系分别感染BmNPV 0、12、24、48、72、96 h后,进行研磨分装,总RNA使用 TRIzol Reagent (Invitrogen) 提取,检测提取成功后,使用反转录试剂盒(Promega) 合成cDNA,保存于−20 ℃备用。按照5 μL iTMUniversal SYBR®Green Supermix (Bio-Rad) 定量试剂, 3.6 μL dH2O,0.2 μL Primer F/R,1 μL cDNA模板进行混匀,混匀后加入定量板的孔中,即每个反应重复3次。将分装好的反应产物连同定量PCR板4 ℃、3 000×离心3 min后,放置在定量PCR仪中,反应程序为:95 ℃ 10 min;95 ℃ 5 s,60 ℃ 30 s,循环40次,65 ℃以0.5 ℃每5 s梯度增长至95 ℃。以家蚕真核翻译起始因子4A (探针号:sw22934) 为内参基因,相对定量PCR的数据处理用2-△CT法。本研究所用引物见表1。
DZ和NC99R品系中病毒DNA拷贝数分析采用绝对定量方法,将提取的不同样品的病毒基因组DNA稀释到相同浓度(100 ng/μL) 的家蚕组织作为PCR模板,以病毒基因为定量引物,以不同稀释浓度(10–1、10–2、10–3、10–4、10–5、10–6) 的BmNPV基因组为标准品,以标准品拷贝数对数值为横坐标,以测得的CT值为纵坐标,计算标准曲线为=16.351–3.970 9,代表荧光定量的CT值,代表基因组拷贝数的对数值。采用上述定量PCR体系和条件进行绝对定量检测,根据不同样品的CT值带入标准曲线计算不同样品病毒基因组拷贝数。
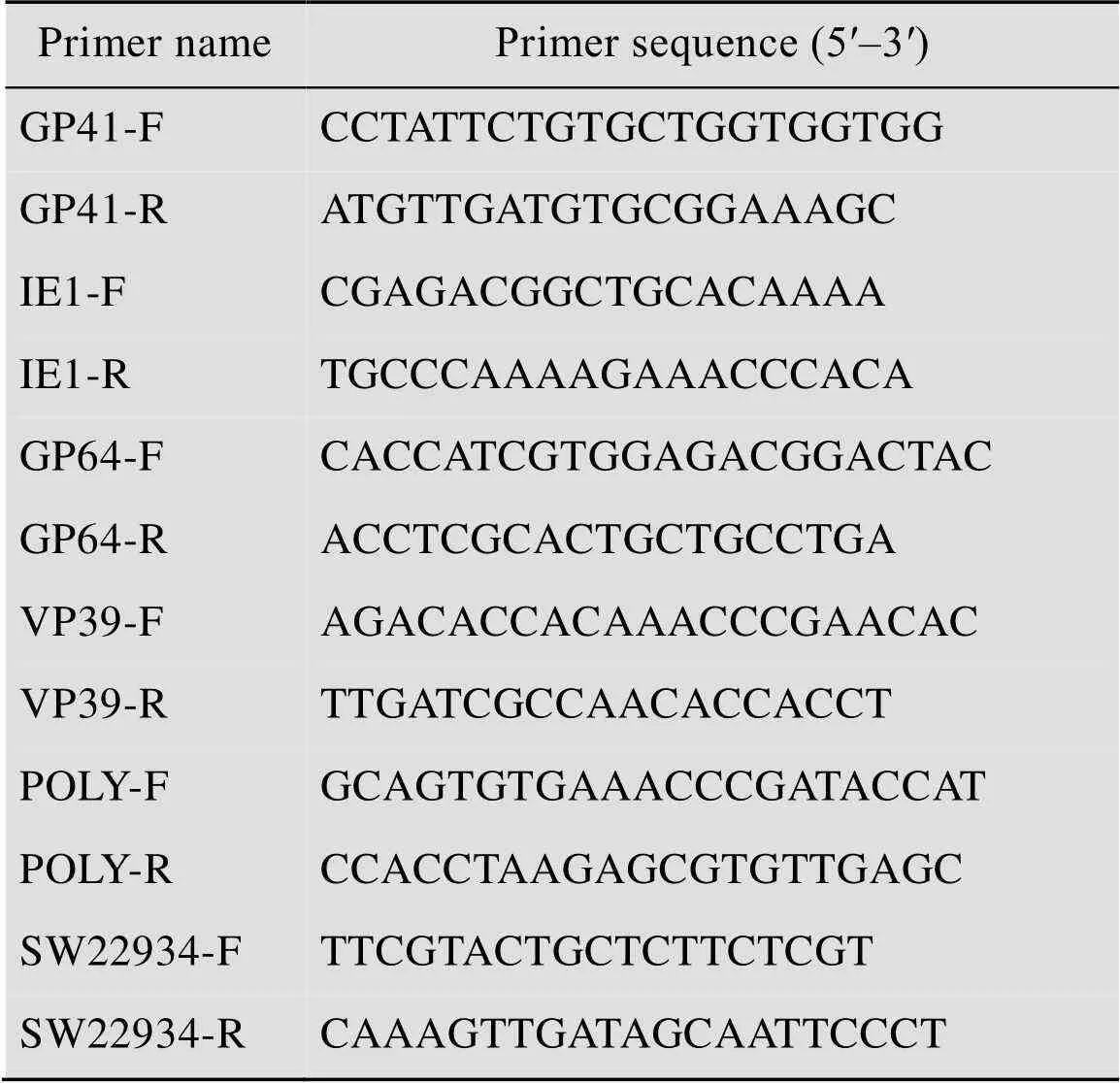
表1 本研究所用引物
2 结果与分析
2.1 家蚕品系DZ和NC99R对BmNPV的抗性鉴定
选取健康的家蚕品系DZ和NC99R饲养至四龄起蚕,经口感染BmNPV病毒粒子,正常饲养,统计其感染后10 d内的死亡情况。结果显示DZ品系经口添食1×107和1×108多角体/头时,死亡率为100%,经口添食1×106、1×105、和1×104多角体/头时,死亡率分别为84.56%、42.52%和26.38%;而抗性品系NC99R在添毒剂量为1×108、1×107、1×106、1×105和1×104多角体/头时,死亡率分别为82.20%、62.9%、39.6%、22.00%和13.20% (图1)。统计分析显示在各添食剂量条件下,NC99R存活率均显著高于DZ品系。根据死亡率统计结果,利用SPSS分析软件计算分析不同品系家蚕半致死剂量,结果显示家蚕品系DZ和NC99R的半致死剂量分别为1.2×105和1.8×106多角体/头,家蚕品系NC99R抗性水平高于DZ 15倍,呈明显抗性(图1)。

图1 家蚕品系DZ和NC99R半致死剂量分析
2.2 口服感染和体腔注射家蚕品系DZ和NC99R死亡率分析
根据两种家蚕品系DZ和NC99R死亡率统计分析,我们鉴定了NC99R品系在1×107多角体/头感染时出现大面积死亡,为了确定NC99R品系表现抗性差异的时间特征,我们分别选取1×106多角体/头口服感染和1×106粒子/头体腔注射两个品系。结果显示口服感染时,DZ品系死亡高峰出现在感染后5–6 d,而抗性品系NC99R死亡高峰出现在感染后7–8 d,死亡时间相对于对照组推迟2 d左右,死亡率显著高于对照组(图2A)。为了判断这种抗性差异是否具有组织特异性和侵染差异,同时体腔注射1×106粒子/头BV病毒,结果显示BV注射后DZ品系在4–6 d大规模死亡,而抗性品系NC99R保持较高的抗性,在第6天出现少量死亡,最终呈现显著抗性水平(图2B)。
2.3 BmNPV在家蚕品系DZ和NC99R中DNA复制分析
为了在分子水平确定DZ和NC99R品系在体腔注射和口服感染后的差异,本研究通过RT-PCR分析了不同处理条件下BmNPV DNA拷贝数变化。结果显示在添食1×106多角体/头时,DZ品系中BmNPV拷贝数成对数上升,而抗性品系NC99R中在感染后相对DZ增加缓慢,在感染 72 h后,拷贝数保持在稳定水平,可能是病毒粒子停止进一步复制(图3A)。同理,体腔注射BV病毒显示,对照组DZ中BmNPV拷贝数同样呈指数增加,而抗性品系NC99R中在感染24 h后BmNPV拷贝数逐渐下降,维持在较低水平(图3B)。结合上述结果,说明口服感染后原发感染能够降低BmNPV毒力,但是不能完全抑制BmNPV复制,随着BV的二次感染,血液等组织对BmNPV能够更高效地抑制病毒增殖。

图2 口服感染和体腔注射家蚕品系DZ和NC99R死亡率分析

图3 家蚕品系DZ和NC99R中BmNPV gp41拷贝数分析
2.4 家蚕品系DZ和NC99R感染BmNPV后中肠病理学变化分析
中肠和血液组织是家蚕免疫防控的主要组织,中肠组织同样也是BmNPV原发感染的场所。为了进一步探究BmNPV在中肠组织增殖情况,本研究对感染BmNPV 12、24、48、72、96 h后中肠组织进行了组织切片观察。结果显示家蚕品系DZ和NC99R在未感染条件下,细胞核和细胞质排列紧密,没有显著的差异。添食BmNPV 48 h后,DZ品系上皮细胞分泌物开始增多;72 h后,DZ品系细胞核染色变浅、细胞缩小、细胞核比例增大、往肠腔靠近;96 h后,DZ品系上皮柱状细胞形态紊乱,细胞核继续膨大,部分细胞核有脱落的趋势,出现大量空泡。而抗性品系NC99R在感染72 h后才开始往两侧移动,细胞核逐渐变大;在感染96 h后,上皮细胞仍较为整齐,细胞比例仍正常,但是细胞核出现膨大现象(图4)。
2.5 BmNPV不同时期表达基因在DZ和NC99R品系中转录水平分析
杆状病毒感染宿主细胞,其基因表达具有级联调控的特征,早期基因表达转录激活晚期基因的表达[17]。为了进一步探究BmNPV在抗性品系NC99R中被抑制表达的特征,本研究选择BmNPV立即早期基因、早期基因、晚期基因和极晚期基因为鉴定不同时期被抑制的标记基因。RT-PCR显示DZ品系在BmNPV感染后,随着感染时间的增加相应基因表达水平逐步上升。而抗性品系NC99R在口服感染和体腔注射后,不同时期基因均在24 h后开始下调表达,其中立即早期基因在口服感染48 h后几乎检测不到转录,结合体腔注射后24 h就检测不到基因的转录,推测BmNPV在个体中完成第一轮复制后,没有开始完整的生活周期(图5)。以上结果初步阐述了是抗性品系NC99R导致了BmNPV在侵染后阻断其完整的生活周期。

图4 家蚕品系DZ和NC99R感染BmNPV后中肠病理学变化分析

图5 BmNPV不同时期表达基因在DZ和NC99R品系中转录水平分析
3 讨论
本研究采用半致死剂量、组织切片和荧光定量等技术,分析了抗性品系NC99R和对照组DZ在BmNPV感染过程中的差异特征,初步阐述了NC99R品系抑制BmNPV侵染路径,这些研究结果为进一步阐述抗性品系NC99R抑制BmNPV复制机制的解析提供了思路,为家蚕抗病品系抗病机制解析提供了参考。
目前,国内外筛选到不同抗性特征的家蚕品系,其抗病毒能力也不尽相同。对家蚕抗病毒品系NC99R抗病毒能力鉴定,确定其半致死剂量达1.8×106多角体/头,相比一般实用品系抗病毒能力提高10多倍,相比敏感品系抗性提高近1 000倍。并且,家蚕抗病毒品系NC99R能够显著延迟死亡时间1–2 d,在生产中同样能够降低发病率,说明桂蚕N2亲本品系具有较高的育种价值。先前研究通过RNAi干涉、转基因过表达或CRISPR/Cas9基因编辑等技术均能显著提高家蚕品系抗病毒能力,最高能够提高抗病毒能力近1 000倍[18-25]。桂蚕N2在两广地区以其产丝量高、综合性能好,具有广泛的推广应用市场,如果结合传统育种的优点,并利用分子育种手段,直接对实用品种进行转基因操作,这样不仅能够保持实用品系本身的优点,同样能够进一步提高实用品系的抗病毒能力。
先前遗传规律进行分析发现,NC99R可能具有多个抗性位点,数量性状特征突出,与抗病材料NB和871C在定位克隆上有显著差异,推测它们可能由不同的抗病基因控制或不同的调控机制调控[4,5,15,26-27]。为了确定这一推测,本研究分析了抗性品系NC99R和对照组DZ死亡率和BmNPV DNA,结果显示体腔注射和口服感染BmNPV都表现为明显延迟病毒感染和提高抗病毒能力,BmNPV 48 h前没有显著的下调,说明NC99R品系对病毒的口服感染和第1轮病毒复制增殖过程抑制不显著,可能在第2轮复制过程进行了抑制,结合体腔注射24 h后,BmNPV就开始显著下调表达,说明NC99R品系对BV感染过程抑制效果更明显。这和871C和NB的抗病毒过程并不一样,先前研究表明871C和NB是口服感染过程直接抑制BmNPV复制的,这可能是NC99R品系抗病毒能力不如其他两个的原因。BmNPV基因的表达是级联调控模式,通过鉴定不同时期基因的表达可以准确分析不同品系中BmNPV基因复制情况,RT-PCR结果说明BmNPV早期基因在感染24 h后就明显下调表达,这一结果同先前研究苹果蠹蛾(L)抗性品系抗苹果蠹蛾颗粒体病毒(granulovirus,CpGV) 特征相似,同样是在病毒复制早期抑制其感染,间接阐述了不同昆虫抗病毒特征具有相关性[28-29]。
家蚕抗病毒品系NC99R具有显著的抗病毒能力,半致死剂量达1.8×106多角体/头;从BmNPV复制早期就开始抑制病毒DNA复制。下一步将集中研究BmNPV第一轮复制结束后,是否产生缺陷型病毒粒子,筛选抗BmNPV关键的宿主基因,完善家蚕抗病毒品系抗BmNPV机制。
4 结论
通过半致死剂量分析、组织病理学和荧光定量分析显示家蚕品系NC99R具高抗病毒能力,主要抑制病毒早期基因表达,为完善家蚕抗病品系机制研究提供了思路。
[1] Mao FX, Lei JH, Enoch O, et al. Quantitative proteomics ofafter BmNPV challenge. J Proteomics, 2011, 81: 142–151.
[2] Chen TT, Tan LR, Hu N, et al. Specific genes related to nucleopolyhedrovirus insusceptible and near-isogenic resistant strains through comparative transcriptome analysis. Insect Mol Biol, 2019 Jan 10. doi: 10.1111/imb.12566.
[3] Chen TT, Hu N, Tan LR, et al. Resistant silkworm strain block viral infection independent of melanization. Pestic Biochem Physiol, 2019, 154: 88–96.
[4] Lu RH, Shi MN, Bi LH, et al. A preliminary investigation on the resistance of the silkworm variety resources in Guangxi to BmNPV. Sci Sericult, 2007, 33(1): 117–120 (in Chinese). 陆瑞好, 石美宁, 闭立辉, 等. 广西地区家蚕品种资源对BmNPV抵抗性的初步调查. 蚕业科学, 2007, 33(1): 117–120.
[5] Lekha G, Gupta T, Awasthi AK, et al. Genome wide microarray based expression profiles associated withNPV resistance and susceptibility in Indian silkworm races of. Genomics, 2015, 106(6): 393–403.
[6] Cai KY, Chen KP, Liu XY, et al. Differential expression of haemolymph proteome of resistant strain and susceptible strain for BmNPV inL. Chin J Biotech, 2008, 24(2): 285–290 (in Chinese).蔡克亚, 陈克平, 刘小勇, 等. 家蚕抗BmNPV品系与感性品系血淋巴液蛋白质组的差异分析. 生物工程学报, 2008, 24(2): 285–290.
[7] Mikhailov VS, Zemskov EA, Abramova EB. Protein synthesis in pupae of the silkwormafter infection with nuclear polyhedrosis virus: resistance to viral infection acquired during pupal period. J Gen Virol, 1992, 73: 3195–3202.
[8] Kang LQ, Shi HF, Liu XY, et al. Arginine kinase is highly expressed in a resistant strain of silkworm (,): Implication of its role in resistance tonucleopolyhedrovirus. Comp Biochem Physiol B Biochem Mol Biol, 2011, 158(3): 230–234.
[9] Qin LG, Xia HC, Shi HF, et al. Comparative proteomic analysis reveals that caspase-1 and serine protease may be involved in silkworm resistance tonuclear polyhedrosis virus. J Proteomics, 2012, 75(12): 3630–3638.
[10] Lv P, Xia HC, Gao L, et al. V-ATPase is involved in silkworm defense response againstnucleopolyhedrovirus. PLoS ONE, 2013, 8(6): e64962.
[11] Liu XY, Yao Q, Wang Y, et al. Proteomic analysis of nucleopolyhedrovirus infection resistance in the silkworm,(:). J Invertebr Pathol, 2010, 105(1): 84–90.
[12] Liu XY, Chen KP, Yao Q, et al. Proteomic analysis of differentially expressed proteins involved in BmNPV resistance in the fat body of silkworm,. Z Naturforsch C, 2010, 65(11/12): 713–718.
[13] Chen KP, Lin CL, Wu DX, et al. Resistance of preserved silkworm species to nuclear polyhedrosis. Sci Sericult, 1991, 17(1): 45–46 (in Chinese).陈克平, 林昌麒, 吴冬秀, 等. 家蚕保存种对核型多角体病的抗性. 蚕业科学, 1991, 17(1): 45–46.
[14] Li G, Qian HY, Luo XF, et al. Transcriptomic analysis of resistant and susceptiblestrains following BmNPV infection provides insights into the Antiviral mechanisms. Int J Genomics, 2016, 2016: 2086346.
[15] Gao R, Li CL, Tong XL, et al. Insight into genetic basis ofresistant strains with resistance to BmNPV by molecular linkage analysis. Sci Agric Sin, 2017, 50(1): 195–204 (in Chinese). 高瑞, 李春林, 童晓玲, 等. 分子连锁分析探讨家蚕高抗BmNPV品系的抗性遗传基础. 中国农业科学, 2017, 50(1): 195–204.
[16] Dong ZQ, Jiang YM, Pan MH. Screening and identification of candidate proteins interacting with bmhsp60 in the silkworm (). Sci Agric Sin, 2019, 52(2): 376–384 (in Chinese). 董战旗, 蒋亚明, 潘敏慧. 家蚕热休克蛋白BmHSP60相互作用蛋白筛选和鉴定. 中国农业科学, 2019, 52(2): 376–384.
[17] Friesen PD, Miller LK. The regulation of baculovirus gene expression. Curr Top Microbiol Immunol, 1986, 131: 31–49.
[18] Dong ZQ, Chen TT, Zhang J, et al. Establishment of a highly efficient virus-inducible CRISPR/Cas9 system in insect cells. Antiviral Res, 2016, 130: 50–57.
[19] Dong ZQ, Dong FF, Yu XB, et al. Excision of nucleopolyhedrovirus form transgenic silkworm using the CRISPR/Cas9 system. Front Microbiol, 2018, 9: 209.
[20] Dong ZQ, Huang L, Dong FF, et al. Establishment of a baculovirus-inducible CRISPR/Cas9 system for antiviral research in transgenic silkworms. Appl Microbiol Biotechnol, 2018, 102(21): 9255–9265.
[21] Dong Z, Hu Z, Qin Q, et al. CRISPR/Cas9-mediated disruption of the-0 and 2 as a therapeutic approach tonucleopolyhedrovirus in transgenic silkworm. Insect Mol Biol, 2019, 28(1): 112–122.
[22] Zhang P, Wang J, Lu Y, et al. Resistance of transgenic silkworm to BmNPV could be improved by silencingandgenes. Gene Ther, 2014, 21(1): 81–88.
[23] Isobe R, Kojima K, Matsuyama T, et al. Use of RNAi technology to confer enhanced resistance to BmNPV on transgenic silkworms. Arch Virol, 2004, 149(10): 1931–1940.
[24] Yang HJ, Fan W, Wei H, et al. Transgenic breeding of anti-L. nuclear polyhedrosis virus silkworm. Acta Biochim Biophys Sin, 2008, 40(10): 873–876.
[25] Subbaiah EV, Royer C, Kanginakudru S, et al. Engineering silkworms for resistance to baculovirus through multigene RNA interference. Genetics, 2013, 193(1): 63–75.
[26] Ribeiro LFC, Zanatta DB, Bravo JP, et al. Molecular markers in commerciali () hybrids susceptible to multiple nucleopolyhedrovirus. Genet Mol Res, 2009, 8(1): 144–153.
[27] Zhang Y, Xia DG, Zhao QL, et al. Label-free proteomic analysis of silkworm midgut infected bynuclear polyhedrosis virus. J Proteomics, 2019, 200: 40–50.
[28] Eberle KE, Jehle JA. Field resistance of codling moth againstgranulovirus (CpGV) is autosomal and incompletely dominant inherited. J Invertebr Pathol, 2006, 93(3): 201–206.
[29] Sauer AJ, Fritsch E, Undorf-Spahn K, et al. Novel resistance togranulovirus (CpGV) in codling moth shows autosomal and dominant inheritance and confers cross-resistance to different CpGV genome groups. PLoS ONE, 2017, 12(6): e0179157.
Mechanism analysis of Anti-BmNPV resistant strain NC99R
Zhanqi Dong1,2*, Xuejiao Lei1*, Qi Qin1, Xinling Zhang1, Liang Tang3, Meining Shi3, and Minhui Pan1,2
1 State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China 2 Key Laboratory for Sericulture Functional Genomics and Biotechnology of Agricultural and Rural Affairs Ministry, Southwest University, Chongqing 400716, China 3 Guangxi Zhuang Autonomous Region Silkworm Technology Promotion Station, Nanning 530007, Guangxi, China
is a lepidopteran insect with important economic value.nucleopolyhedrovirus (BmNPV) causes huge economic loss to silkworm industry in China every year. The objective of this study is to determine the anti-BmNPV mechanism ofstrain NC99R, and to provide a basis for understanding the molecular mechanism of the silkworm resistance strain. The normal control Dazao (DZ) strain and the NC99R resistant strain were fed with occlusion bodies (OB). The median lethal dose (LD50) analysis of the DZ and NC99R showed that the LD50 of DZ was 1.2×105OBs/larva, while NC99R was 1.8×106OBs/larva. The LD50 of the NC99R was about 15 times higher than the DZ. The mortality of DZ and NC99R were analyzed, which were fed with 1×106OBs/larva and injection with 1×106BVs/larva. The results showed that the death peak of DZ was concentrated in the 4th to 6th day. And the death peak of NC99R was concentrated in the 6th to 8th day, with a delay of 1–2 days compared with the control. The BmNPV DNA copy number showed that the BmNPV genome in DZ proliferated rapidly. The copy number of BmNPV DNA in NC99R were increased slowly after oral infection and body injection. HE staining showed that midgut tissue has no significant difference between DZ and NC99R in the early stage of oral infection. At 96 h p.i., the nucleus of DZ midgut became larger and shedding. The NC99R had enlarged nuclei, but the cells were still arranged neatly. Finally, the expression of virus genes in different periods were analyzed by RT-PCR. The results indicated that the immediate early geneexpression levelsbegan to down-regulate after 24 h p.i.. The early, late, and extremely late genes were also down-regulated, and finally maintained at a lower expression level.
, BmNPV, resistance, NC99R
董战旗, 雷雪蛟, 秦琪, 等. 家蚕抗性品系NC99R抗BmNPV作用机制分析. 生物工程学报, 2020, 36(1): 100–108.
Dong ZQ, Lei XJ, Qin Q, et al. Mechanism analysis of Anti-BmNPV resistant strain NC99R. Chin J Biotech, 2020, 36(1): 100–108.
April 30, 2019;
May 31, 2019
Supported by: National Natural Science Foundation of China (Nos. 31872427, 31902214), China Agriculture Research System (No. CARS-18), Natural Science Foundation of Chongqing (No. cstc2019jcyj-msxm2371).
Minhui Pan. Tel/Fax: +86-23-68250716; E-mail: pmh047@126.com
*These authors contributed equally to this study.
10.13345/j.cjb.190170
国家自然科学基金 (Nos. 31872427, 31902214),国家蚕桑产业技术体系 (No. CARS-18),重庆市自然科学基金 (No. cstc2019jcyj-msxm2371) 资助。
2019-06-18
http://kns.cnki.net/kcms/detail/11.1998.Q.20190617.1050.003.html
(本文责编 郝丽芳)
