平衡常数在高中化学平衡理论教学中的应用
2020-03-11孙慧丽祝可一
罗 平,孙慧丽,祝可一
(新疆师范大学附属中学,新疆 乌鲁木齐 830054)
化学平衡常数是用于定量表征化学反应限度的热力学常数。它在课标中提出了如下的要求:“知道化学平衡常数的含义,能利用化学平衡常数计算反应的转化率”。高考考试大纲中的要求是:“了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算”。在教学中用平衡常数分析问题和解决问题不仅符合课程标准理念,而且满足高考考试大纲中的能力要求。
1 理解关于平衡移动的口诀

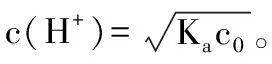
用水解平衡常数(Kh)也可以帮助理解“越稀越水解”这一口诀。
2 理解溶质粒子同时存在电离和水解时溶液的酸碱性
当溶液中的溶质粒子同时存在电离和水解时,溶液的酸碱性取决于电离程度和水解程度的相对强弱。单纯的记忆给学生的认知带来困惑,对学生记忆带来负担。引入平衡常数同样可以帮助学生很好理解。
2.1 混合溶液
例题1.在浓度均为0.1mol/L的醋酸和醋酸钠混合溶液中溶液的c(CH3COOH)_____c(CH3COO-)。(填“<”、“>”或“=”,下同),例题2.在浓度均为0.1mol/L的HCN和NaCN混合溶液中溶液的c(HCN)_____c(CN-)。
在浓度均为0.1mol/L的醋酸和醋酸钠混合溶液中存在着醋酸的电离平衡和醋酸根离子的水解平衡:

由此可以得出如下结论:
(1)在同浓度的醋酸和醋酸钠混合溶液中是以醋酸的电离为主,溶液显酸性。
(2)由HCN的Ka≈10-6,可推知CN-的Ka≈10-4,水解程度强于电离程度,混合溶液显碱性。
(3)在同浓度的氨水和氯化铵混合溶液中是以NH3·H2O的电离为主,溶液显碱性。
2.2 弱酸酸式盐溶液
(1)查表可知,碳酸的电离平衡常数为:Ka1=4.3×10-7,Ka2=4.3×10-11
在NaHCO3溶液中


水解程度强于电离电离程度,NaHCO3溶液呈碱性。
(2)同理可知,在NaHSO3溶液中电离平衡常数Ka2=1.02×10-7,水解平衡常数Kh=6.5×10-13,电离程度强于水解程度,NaHSO3溶液呈酸性。

3 理解分布曲线图
很多习题借助物质的量分数(δ)与溶液 pH曲线来综合考察学生,从平衡常数的角度能很好地分析并解决问题。如下题:
例题3:常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是( )


B.在0.1mol/LNaHA溶液中,各离子浓度大小关系为:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)

D.将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
对于此类题目,如能了解用平衡常数表示分布系数的方法,就变得很直观了。
对于题给弱酸H2A(c0代表H2A的分析浓度)存在如下的两步电离。
(1)
(2)
在H2A溶液随着pH变化的过程中始终存在着如下物料守恒:
c0=c(H2A)+ c(HA-)+c(A2-)
(3)
同理可得:
通过以上的推导分析,可以得出如下结论:
ⅠδH2A+δHA-δ(A2-)=1,分布系数(δ)决定于该酸碱物质的性质和溶液的pH,而与其总浓度(或分析浓度c0)无关。
Ⅱ两步电离的Ka相差较大的时候,所有物料形式共存不明显。
ⅢpH=pKa1时,溶液中c(H2A)=c(HA-),pH=pKa2时,c(HA-)=c(A2-)。
结合上述分析,例题3中D项描述错误。
4 分析特殊反应
实验室吸收和检验H2S气体的优良试剂是硫酸铜溶液,能发生如下反应:
CuSO4+H2S=CuS↓+H2SO4。在这个反应中出现了弱酸(H2S)制强酸(H2SO4)的反常情况。可以从平衡常数的角度来分析该反应,帮助学生理解。
溶液中存在这个平衡:Cu2++H2S=CuS↓+2H+
查表可知(25℃)Ka1=9.5×10-8,Ka2=1.3×10-14,Ksp=1.27×10-36。
代入数据可知上述反应的平衡常数K=9.7×1014≥105,反应非常彻底。
从上面的分析可以看出,在教学中引入平衡常数可以为学生提供理性分析的思维“支架”,降低学习难度,还能体现化学研究的过程与方法,有助于实现新课程提升学生核心素养的宗旨。
