分析化学综合设计实验:和州组灰岩中钙、镁含量分析
2020-03-11刘红瑜王冠宇毛元廷
刘红瑜,王冠宇,毛元廷
(1.化学国家级实验教学示范中心(中国科学技术大学),安徽 合肥 230026;2.中国科学技术大学地球和空间科学学院,安徽 合肥 230026 )
中国科学技术大学分析化学实验Ⅱ中开设大量的综合探究型和设计型实验。设计型实验能够充分调动学生的实验兴趣和积极性 ,提高学生对所学知识的综合利用能力和解决实际问题的能力,加深学生对所学理论知识的理解 ,对学生综合素质的提高有着积极的推动作用。让学生掌握从样品采集、处理、分析方法的选择以及数据处理全过程。这样既有利于加深学生对理论知识的理解, 又能用所学的理论知识及时指导实践,培养学生获取综合知识的能力。我们介绍一个与生活相关的自主设计实验,该实验紧密结合学生的专业,让学生充分利用所学的分析化学知识解决实际问题。
灰岩,俗称石灰岩,是一种沉积岩。几乎由纯的方解石(碳酸钙)构成,其它成分的总含量常在5%以下,其中较为常见的是粘土矿物、石英粉砂、铁质微粒、海绿石、有机质等。在与砂岩过渡的灰岩中可含较多陆源碎屑,白云石化也可使白云石(含镁)含量增加。和州组,原称“和州灰岩”。属早石炭世晚期地层,按岩性特征可分为上、下两部分,下部:深灰、灰黑色中薄至厚层生物碎屑白云质灰岩、泥质类岩;上部:灰、微带肉红色中厚层至厚层亮晶及微晶生物碎屑灰岩,底部为粗结晶灰岩,顶部为炉渣状灰岩。通过测定其中的钙、镁含量,可推测其中白云质成分含量,从而估计所取标本在该岩层中的产出位置的其他地质学方面的性质,具有重要意义[1]。
1 实验目的
(1)初步了解自主设计实验的基本思路。
(2)会利用所学的分析化学理论知识和实验操作完成实际样品的分析。
(3)分析不同滴定方式的适用情况和误差来源。
(4)学会根据具体情况选择合适的实验方法。
(5)培养小组分工合作的精神。
2 实验原理
待分析样品主要成分为碳酸钙(可能含有少量白云石),定量称取后,经粉碎、酸溶、过滤、稀释、定容等操作,即可得标本中钙、镁离子的“标准”溶液,将该溶液使用EDTA在不同pH下,可分别滴定钙镁总量以及单独的钙含量,同时另取等量溶液,用高锰酸钾法可测量其中钙含量,比较两种方法所测结果,并分析可能原因[2]。
EDTA法中,pH值≈10时,Ca2+、Mg2+均与EDTA配位,按化学计量比1∶1反应:


可得Mg、Ca总量;pH值≈12时,Mg2+全部沉淀,加入少量糊精防止Mg(OH)2沉淀吸附钙,此时再次使用EDTA滴定,可得Ca含量;根据上述数据,可计算出Mg含量。
滴定时以铬黑T为指示剂,指示剂与金属离子络合生成紫红色配合物,滴定到化学计量点时,游离出指示剂使溶液显蓝色。
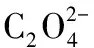
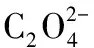
对两种方法所测Ca2+含量进行比较,分析配位滴定和氧化还原的区别以及不同滴定方法中可能的误差来源,并依此进一步了解不同的滴定方法究竟适合什么情况的待测样品和分析目的。
3 实验仪器、试剂
(1)实验仪器:滴定管、烧杯、锥形瓶、玻璃棒、长颈漏斗、量筒、研钵、表面皿、移液管、试剂瓶、容量瓶。
(2)实验试剂:盐酸(分析纯)、氨水(分析纯)、EDTA(分析纯)、碳酸钙(分析纯)、高锰酸钾(分析纯)、草酸钠(分析纯)、硫酸(分析纯)、草酸铵(分析纯)、甲基橙(分析纯)、氢氧化钠(分析纯)、铬黑T(分析纯)、钙指示剂(分析纯)。
4 实验步骤
4.1 样品预处理及配制所需试剂
将样品敲碎后取1-1.1g、研磨、1∶1HCl酸溶、(过滤、)稀释,定容至250mL后即可得包含样品中钙镁成分的待测液;配置0.02mol·L-1EDTA、0.02mol·L-1KMnO4、pH值=10氨性缓冲溶液、4%草酸铵溶液、1∶2硫酸、1∶1氨水等;
4.2 EDTA法测定钙、镁含量
4.2.1 标定EDTA
称取1.00~1. 10g基准碳酸钙用盐酸溶解,定容至250mL,移取10mL,加80~90mL水,5%氢氧化钠溶液10mL、少量钙指示剂,用EDTA滴至紫红色变为纯蓝色,平行三次实验,计算EDTA浓度。
4.2.2 测定样品
移取10mL待测液,加水80~90mL,加入pH值≈10氨缓冲溶液10mL、铬黑T指示剂,用EDTA滴定至紫红变为纯蓝,平行三次,计算其中钙、镁总量。
另取等量待测液、加入80~90mL水及5%氢氧化钠溶液10mL(调节pH约为12)、再加入钙指示剂、用EDTA滴定,计算其中的钙含量。
4.3 KMnO4法测定钙含量
4.3.1 标定KMnO4
称取0.13~0.15g基准草酸钠,150mL水溶解、加热近沸,加入1∶2硫酸10mL,保持加热(不低于60℃)条件下用KMnO4滴定,平行三次、计算KMnO4浓度。
4.3.2 测定样品
取25mL待测液,加入120mL水,加入30mL 4%草酸铵,加热近沸,加入甲基橙指示剂,搅拌下滴加1∶1氨水,至溶液由红变黄,静置,倾注法过滤,洗涤,将沉淀转入烧杯,加入1∶2硫酸10mL ,加热(75~80℃)条件下用KMnO4滴定(记得转入滤纸),平行三次,计算其中钙含量。
5 实验数据
5.1 实验预处理部分
称取1.0944g样品,配成250.00mL溶液。
5.2 EDTA法测定钙、镁含量
5.2.1 标定EDTA数据
标定EDTA数据见表1。
称取标准碳酸钙:0.5890g。
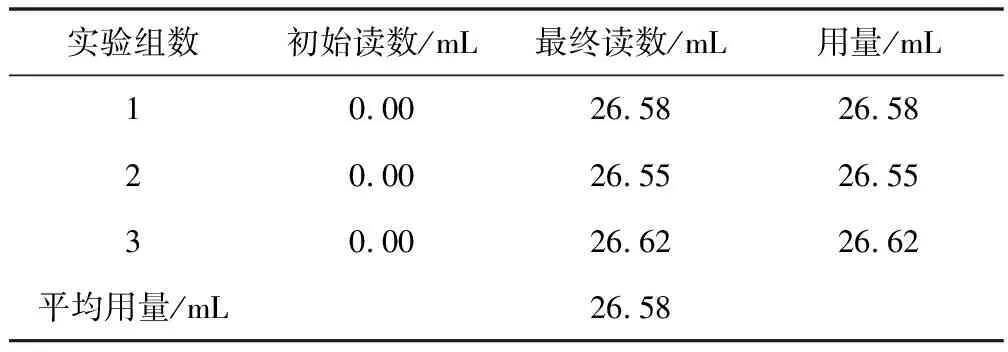
表1 标定EDTA数据
5.2.2 钙、镁总量测定数据
钙、镁总量测定数据见表2。
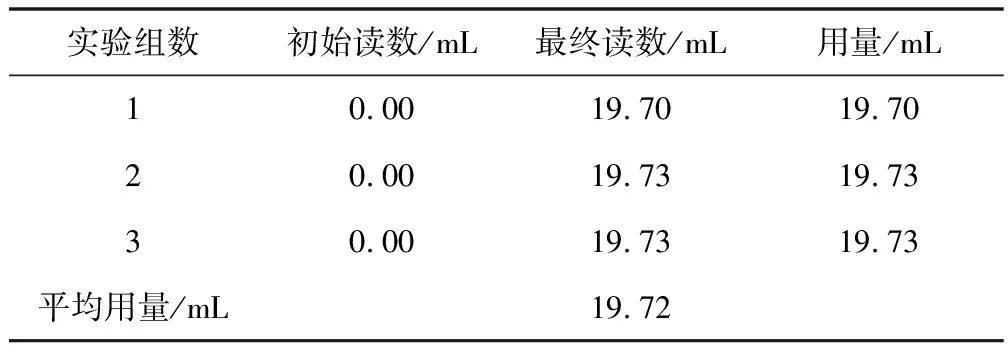
表2 测定钙镁总量数据
5.2.3 钙含量测定的数据
钙含量测定的数据见表3。
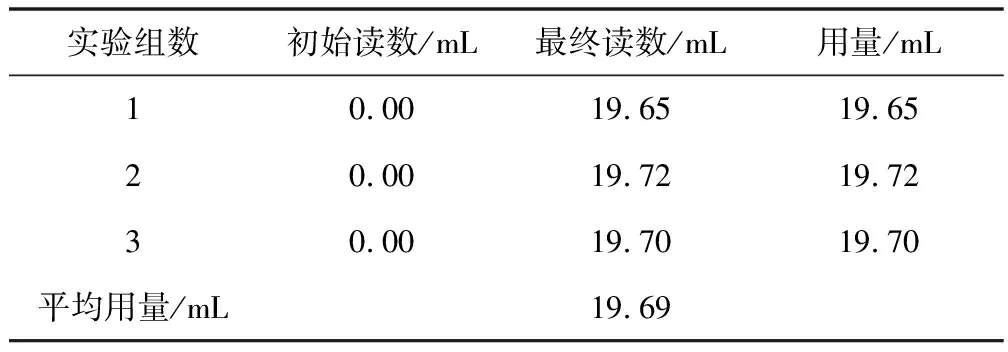
表3 测定钙镁总量数据
5.3 KMnO4法测定钙含量
5.3.1 KMnO4的标定数据
KMnO4的标定数据见表4。
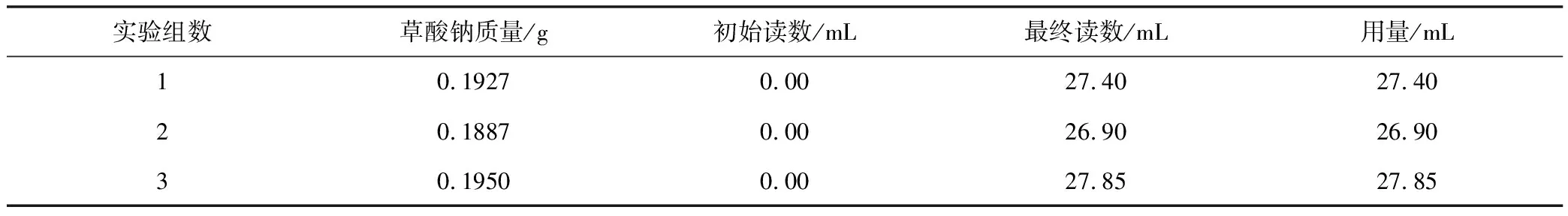
表4 KMnO4的标定数据
5.3.2 样品中钙含量测定数据
样品中钙含量测定数据见表5。
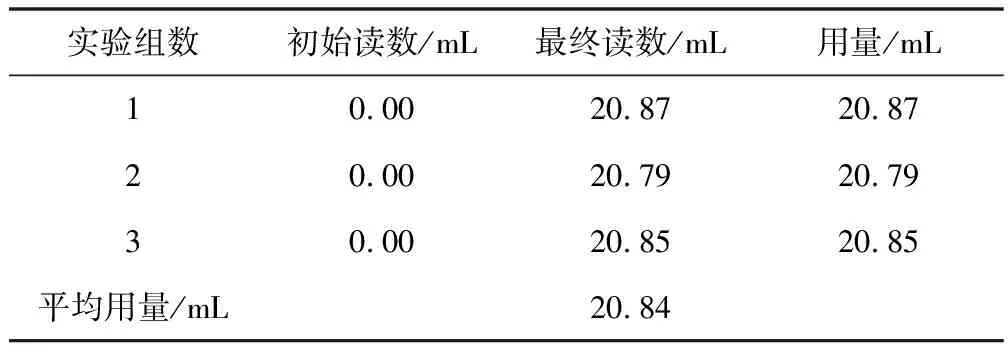
表5 样品中钙含量测定数据
6 数据处理
6.1 EDTA法测定钙、镁含量
6.1.1 标定EDTA
对三组滴定数据,有:
滴定过程中,有1EDTA~1Ca2+(Mg2+),故:
从而EDTA标准溶液的浓度为:
6.1.2 测定样品中的钙含量
对三组滴定数据,有:
对样品中钙,有1EDTA~1Ca2+,从而
mCa=nCa×MCa=MCa×CEDTA×VEDTA×25
带入实验所测数据,计算得:
mCa=40.078×0.02214×19.69×10-3×25=0.4368(g)
考虑实际情况,样品中Ca以CaCO3形式存在,则:

6.1.3 测定样品中钙、镁的总量
根据实验数据,滴定钙镁总量时,有:
较前单独滴定钙时的情况,有:
两者相差:△V=19.72-19.69=0.03(mL)
从而:d=0.03/19.72=1.521‰
两者相差极小,误差甚至属于正常滴定误差范围内,因此认定样品中不含Mg,故不做Mg含量的计算,同时钙含量计算同上。
综上所述,EDTA法中,所测标本(质量1.0977g)中,含有1.0908g碳酸钙(钙元素质量0.4368g),碳酸钙质量分数为99.37%,与资料中该灰岩碳酸钙含量大于98%相符,不含白云质成分(Mg元素)。
6.2 KMnO4法测定钙含量
6.2.1 KMnO4的标定
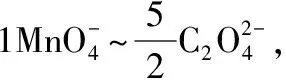
代入所测实验数据,三组结果分别如下:
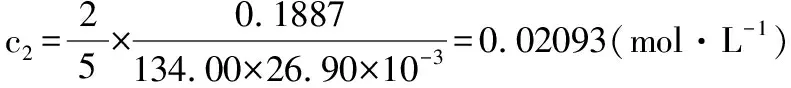
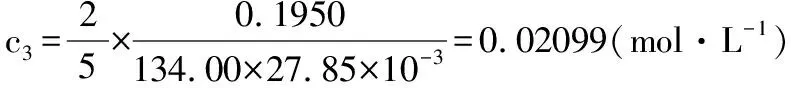
从而KMnO4标准溶液浓度为:
6.2.2 待测样品中钙含量测定
对三组滴定数据,有:
代入数据:
ωCaCO3=mCaCO3/m样品=1.0919/1.0977=99.48%
因此KMnO4法所测该样品中含碳酸钙1.0919g,质量分数为99.48%,与EDTA法所测结果1.0908g(质量分数99.37%)相符,具体误差分析和结果讨论部分见下。
7 误差分析
7.1 EDTA法测定钙、镁含量
7.1.1 标定EDTA
7.1.2 测定钙镁的总量
7.1.3 测定钙的含量
较上总量部分
两者相差:△V=19.72-19.69=0.03(mL)
从而:d=0.03/19.72=1.521 ‰
因此认为待测样品中不含镁,可进行下一步KMnO4法测定钙含量。
7.2 KMnO4法测定钙含量
7.2.1 KMnO4的标定
7.2.2 钙含量的测定
两种方法所测数据分别为1.0908g与1.0919g,相对误差为1.01‰,位于正常范围内,因此认为所测值即为样品中CaCO3含量。
8 误差来源及注意事项
(1)实验中配位滴定的主要操作误差来源在于对终点的判断;氧化还原滴定的误差来自沉淀洗涤操作所剩余的草酸根离子。操作时着重注意这两点,实验结果误差也较小,符合预期。
(2)在实验设计上,EDTA滴定的误差来源在于杂质离子对被滴金属离子的干扰和其他金属离子对指示剂的影响。氧化还原反应要求反应速度快,无其他还原剂干扰等,这些在实验设计上通过样品恰当地选择,处理和洗涤,以及滴定时加热的办法都得到了解决。
9 实验结论
(1)根据上述所测结果,该标本成分基本全为CaCO3,含量>99%,测定结果表明该标本不含镁,即不含白云质成分,另外,该标本外观显肉红色,含有明显亮晶碎屑,因此判定,该标本样品产自和州组岩层上部。
(2)两种滴定方法表现了较为良好的统一性。虽然各自方法中系统误差的来源不同,但在结果上体现不出显著的区别。
10 教学建议
(1)本实验是一个涉及到原理选择、实验条件设计、实验结果评价的综合设计实验,面向化学院及地球和空间科学学院2年级本科生开设。该实验已开设2年。该实验集设计和探究于一体,因此应该分小组合作完成。建议2~3位同学一组,分两次课完成,每次课大概需要6小时。
(2)建议第一次课让学生讲解自己的设计方案以及实验过程中可能出现的情况,通过全班讨论完善报告,同时能增强学生沟通交流的能力。
(3)实验报告中需要详细记录实验现象,特别是样品预处理以及滴定过程中的溶液颜色的变化。重点在于解决实验中遇到的问题、并学会对实验结果进行系统有针对性的分析。提升学生分析和解决问题的能力。
11 结束语
学习分析化学不仅要使学生掌握各种分析方法, 更重要的是使学生了解整个分析过程和有关操作,并学会对实验结果进行分析和评价。设计性实验中, 通过查阅文献学生自主确定实验课题、 设计实验方案 、预答辩课实验方案、课后完善课题、实施实验方案、记录实验数据、处理实验结果、ppt答辩、撰写小论文。设计型实验不仅体现了跨学科、多技能的综合训练,同时与化学热点研究和实际应用相结合,进行创新性研究,而且让学生真正感受到化学家或化学工作者从事化学研究工作的氛围。该综合设计实验值得推广。
