血清NSE、HIF-1α在热性惊厥性脑损伤患儿中检测的临床意义
2020-03-11傅俊建施艳赵龙薛勇李玉书
傅俊建,施艳,赵龙,薛勇,李玉书>
(1.南通大学附属建湖县人民医院 儿科,江苏 建湖;2.建湖县人民医院 检验科,江苏 建湖)
0 引言
热性惊厥(Febrile Seizures)多见于6个月至5岁小儿,发病率约3%~5%,是儿科常见的危急重症之一[1]。热性惊厥常分为单纯性热性惊厥(SFS)和复杂性热性惊厥(CFS),热性惊厥能否导致脑损伤,如何判断惊厥性脑损伤程度,仍然是临床关注的热点问题。目前的研究证实,神经元特异性烯醇化酶(NSE)作为神经元损伤的敏感而特异性的血清生化指标,其表达水平与早期脑损伤病情严重程度密切相关[2]。低氧诱导因子-1α(HIF-1α)是一种重要的缺氧感受因子,其分布和作用非常广泛,国内外文献报道HIF-1α在脑出血、缺氧缺血性脑病、肿瘤发生、心血管等疾病中发挥重要作用[3]。有资料显示,HIF-1α较为广泛地参与了细胞对缺氧产生的特异性应答反应,在各种氧含量降低的状态下(包括全身缺氧、全脑缺氧及局灶性脑缺氧),脑组织都会有HIF-1α的激活表达,并具有一定的时相性[4],提示HIF-1α水平变化可能与脑损伤程度相关。为此,本研究通过对FS患儿惊厥后不同时间点血清NSE、HIF-1α的水平测定,探讨血清NSE、HIF-1α表达水平与热性惊厥性脑损伤发病的关系,以期为热性惊厥性脑损伤的防治提供新的理论依据。
1 资料和方法
1.1 一般资料
选择2016年3月至2019年2月在我院诊断为热性惊厥的住院患儿62例,其中SFS 34例,CFS 28例,诊断均符合热性惊厥的判断标准[5]。排除先天性心脏病、近期有过手术、严重感染、有神经系统疾病或损伤的患儿。另选取同期在我院治疗的上呼吸道感染患儿30例作为对照组;入选对象在性别、年龄、病程等资料上差异无统计学意义(P>0.05),具有可比性。本研究通过我院伦理委员会批准,所有患儿家长签署知情同意书。
1.2 标本采集
热性惊厥患儿分别于惊厥后24 h、48 h、72 h、96 h采取外周静脉血2 mL,静置后经高速离心机3000 rmp/min离心10 min,取上清液置于EP管,标记后保存于-80 ℃冰箱待测(溶血标本除外);对照组儿童在入院后24 h、48 h、72 h、96 h分别采取外周静脉血2 mL,标本处理方法与惊厥患儿相同。
1.3 检测方法
血清NSE、HIF-1α的测定采用ELISA法,试剂盒购自上海颖心实验室设备有限公司,操作均由同一检验师完成,严格按照试剂盒说明书操作步骤进行检测。
1.4 统计学方法
2 结果
2.1 NSE测定水平
(1)在 惊 厥 后24 h、48 h、72 h、96 h,SFS组 血 清NSE表达水平略高于对照组,但各点比较,差异无统计学意义(P>0.05);(2)CFS患儿血清NSE表达水平明显高于对照组,各点比较,差异有统计学意义(P<0.05);并且CFS患儿血清NSE表达水平在不同时间点分别明显高于SFS组(P<0.05),见表1。
表1 各组别不同时间点NSE表达水平

表1 各组别不同时间点NSE表达水平
注:与对照组比较,*P<0.05,☆P>0.05;与SFS组比较,#P<0.05;CFS组内各时间点NSE水平与48 h比较,★P<0.05。
组别 n不同时间点NSE测定水平f P 24 h 48 h 72 h 96 h CFS组 28 21.15±2.85*#★ 39.49±4.63*# 32.65±4.66*#★ 27.03±3.87*#★ 154.1300.000 SFS组 34 13.78±3.35☆ 15.41±4.07☆ 14.17±3.45☆ 14.13±4.07☆ 2.326 0.056对照组 30 12.56±3.42 13.66±4.11 13.89±3.91 12.97±3.24 1.548 0.192 f 90.449 534.028 303.281 176.281 P<0.05 <0.05 <0.05 <0.05
2.2 HIF-1α测定水平
(1)在惊厥后24 h、48 h、72 h、96 h,SFS组血清HIF-1α表达水平略高于对照组,但各点比较,差异无统计学意义(P>0.05);(2)CFS患儿血清HIF-1α表达水平明显高于对照组,各点比较,差异有统计学意义(P<0.05),并且CFS患儿血清HIF-1α表达水平在不同时间点分别明显高于SFS组(P<0.05),见表2。
表2 各组别不同时间点HIF-1α表达水平
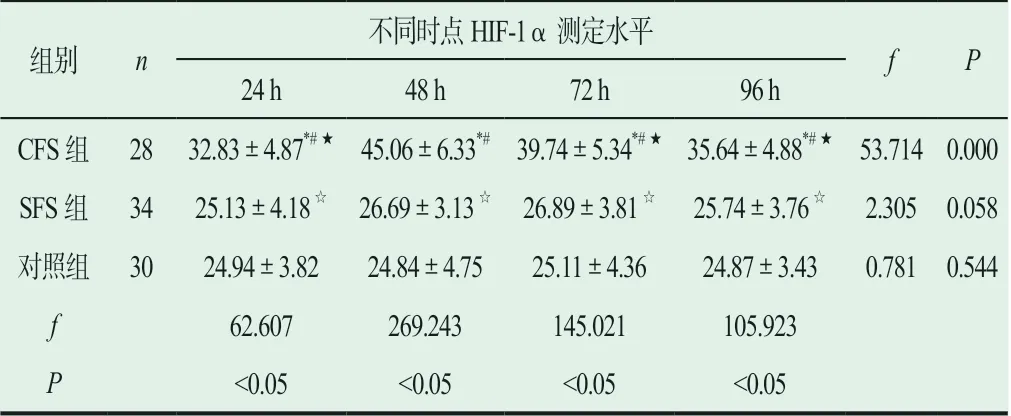
表2 各组别不同时间点HIF-1α表达水平
注:与对照组比较,*P<0.05,☆P>0.05;与SFS组比较,#P<0.05;CFS组内各时间点NSE水平与48 h比较,★P<0.05。
组别 n不同时点HIF-1α测定水平f P 24 h 48 h 72 h 96 h CFS组 28 32.83±4.87*#★ 45.06±6.33*# 39.74±5.34*#★ 35.64±4.88*#★ 53.714 0.000 SFS组 34 25.13±4.18☆ 26.69±3.13☆ 26.89±3.81☆ 25.74±3.76☆ 2.305 0.058对照组 30 24.94±3.82 24.84±4.75 25.11±4.36 24.87±3.43 0.781 0.544 f 62.607 269.243 145.021 105.923 P<0.05 <0.05 <0.05 <0.05
3 讨论
热性惊厥(FS)是指发热状态下出现的惊厥发作,无中枢神经系统感染及导致惊厥的其他原因,既往没有无热惊厥病史[6]。多数学者认为大部分SFS预后好,终生发作次数一般<5次,不遗留神经系统后遗症,不影响认知和智力,无需药物特殊干预。而CFS及部分SFS有反复发作、发展为癫痫的风险,但对智力、认知及行为影响的研究差异较大,是否进行预防性用药、用药指征及用药方法仍存在争议[7]。研究显示,CFS患儿发展成为癫痫以及导致惊厥性脑损伤的风险较大,部分患儿可出现智力降低和癫痫病[8]。由于严重频发的FS可导致惊厥性脑损伤,遗留智力低下及行为异常,甚至可转为癫痫,因此,FS的预后研究为家长及临床医生所关注[9]。
NSE是一种存在于神经元和脑胶质细胞中的糖酵解酶,脑损伤时细胞坏死溶解,NSE可通过被破坏的血脑屏障进入脑脊液和血液中,可使血液中的NSE浓度明显增加。大量动物试验及临床试验表明,检测NSE是判断颅内神经元损伤或坏死的客观指标,其升高程度与脑损伤程度及预后有密切关系[10]。
近年来,国内外已经有多篇关于热性惊厥患儿惊厥发作后或多种原因引起脑损伤后脑脊液或血液NSE水平变化的文献报道,所得出的结论有一定的差异,可能是因为采样时间或判断的标准不一样。但大多数学者认为,SFS至少不会引起脑脊液或血清NSE浓度的严重升高[11]。本实验结果显示,SFS惊厥后不同时间点的NSE表达水平分别为24 h(13.78±3.35)ng/mL,48 h(15.41±4.07)ng/mL,72 h(14.17±3.45)ng/mL,96 h(14.13±4.07)ng/mL,对照组各对应的时间点分别为(12.56±3.42)ng/mL,(13.66±4.11)ng/mL,(13.89±3.91)ng/mL,(12.97±3.24)ng/mL;表 明SFS发 作后NSE水平与对照组比较无明显升高(P>0.05),提示SFS患儿惊厥发作不会引起NSE明显增高和脑损伤,这与前述文献报道基本一致[12]。从本研究结果来看,CFS组患儿惊厥后不同时间点NSE表达水平分别为24 h(21.15±2.85)ng/mL,48 h(39.49±4.63)ng/mL,72 h(32.65±4.66)ng/mL,96 h(27.03±3.87)ng/mL,各时间点浓度较相应时间点SFS组的NSE浓度明显增高,差异有统计学意义(P<0.05)。由NSE的测定结果可以推测,CFS组患儿可能存在一定程度的惊厥后脑损伤。
低氧诱导因子-1(HIF-1)是近年发现的一种重要的缺氧感受因子,由α、β两个亚基组成,HIF-1α仅在缺血细胞的细胞核中存在,HIF-1β则在正常细胞和缺氧细胞的细胞核和细胞质中均有表达,当细胞缺血缺氧时,HIF-1α的降解途径被阻断,HIF-1α表达就开始增高,作为转录调节因子,其介导多种效应基因的表达,参与缺血缺氧反应过程,能调节细胞适应低氧状态下的能量代谢和氧的运输,并维持体内细胞内氧平衡。HIF-1α的下游靶基因涉及细胞能量代谢、离子代谢、血管形成、红细胞生成、细胞凋亡和增殖、细胞迁移等多个方面,在许多生理和病理过程,尤其是缺氧缺血性疾病的发生发展中具有重要作用。
大脑神经元对缺氧十分敏感,任何因素所导致的氧含量降低都可导致HIF-1α表达水平的增高;从已知的研究结果来看,惊厥性脑损伤主要是由于惊厥后不同程度的大脑神经元缺氧缺血所导致。本资料中,SFS组血清HIF-1α浓度无明显增高,与对照组比较,差异无统计学意义(P>0.05);而CFS组不同时间点血清HIF-1α浓度分别为24 h(32.83±4.87)pg/mL,48 h(45.06±6.33)pg/mL,72 h(39.74±5.34)pg/mL,96 h(35.64±4.88)pg/mL,明显高于对照组和SFS组各点的表达水平(P<0.05),此测定结果也证实了上述观点;同时也提示,SFS组患儿无明显HIF-1α的异常表达。研究表明,缺氧是最主要的HIF-1α表达的调节因子,HIF-1α表达增强的机制可能与低氧状态下细胞线粒体产生大量的活性氧簇以及与缺血/再灌注后产生的OH-有关,它们能够稳定HIF-1α,使HIF-1α免于被迅速降解。HIF-1α蛋白有一个非血红素结合铁的降解中心,缺乏肿瘤抑制蛋白与其结合,介导HIF-1α蛋白的分解,钴离子和铁离子螯合物可以阻碍肿瘤抑制基因(VHL)和HIF-1α蛋白非血红素结合铁的结合,导致HIF-1α和VHL的分离,使HIF-1α在胞内聚集[13]。本研究结果显示,CFS患儿惊厥后HIF-1α表达水平显著高于其他两组,提示CFS患儿存在一定程度的惊厥性脑损伤,符合文献报道[14]。
综上所述,NSE和HIF-1α可能参与了脑缺氧缺血性损伤的早期反应,NSE和HIF-1α表达水平的测定对FS特别是CFS患儿脑损伤的判断具有重要临床意义。
