MiR497HG靶向miR-588调控肺癌细胞增殖、迁移侵袭和凋亡的机制研究
2020-03-10徐红艳楚晓飞葛茂功何世阳杨霞白卫云
徐红艳 楚晓飞 葛茂功 何世阳 杨霞 白卫云
肺癌是世界上第二位常见癌症,死亡率居首位。虽然吸烟等环境风险因素对肺癌的发展有重要贡献[1],但也存在遗传因素。肺癌的主要类型有小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)[2],其中NSCLC的两个主要亚型是肺腺癌(LUAD)和肺鳞状细胞癌(LUSC), LUAD和LUSC占绝大多数新报告的肺癌病例,而SCLC仅包括一小部分(约15%)[3]。这些亚型在肺内的位置以及起源的细胞类型方面不同[4],因此可能具有不同的潜在疾病病因。 LUAD是研究最多的肺癌亚型,研究已经确定了基因组改变和可行的突变[5-6]。研究显示,长链非编码RNA (LncRNAs)在肺癌中的异常与癌症的恶化程度具有密切的相关性[7]。然而,最近发现的LncRNA MiR497HG在肺癌中的功能和分子机制仍然未知。本研究拟以肺癌细胞NCI-H1975为研究对象,检测其中LncRNA MiR497HG、miR-588在其中的表达,观察抑制MiR497HG、过表达miR-588对NCI-H1975细胞增殖、迁移、侵袭及凋亡的影响,揭示其机制与MiR497HG靶向调控miR-588有关,将为肺癌的治疗提供新靶点。
资料与方法
一、实验材料
正常肺上皮细胞BEAS-2B、肺癌细胞NCI-H1975、NCI-H460、A549(ATCC);DMEM培养基、胎牛血清、MTT、胰蛋白酶(美国Sellect公司);LipofectamineTM2000、BCA蛋白定量试剂盒、逆转录试剂盒(大连Takara公司);PVDF膜(德国罗氏诊断有限公司);SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液(碧云天生物技术公司);双荧光素酶报告基因检测试剂盒(美国Promega公司);Matrigel基质胶(美国BD);Transwell小室(美国Coming公司);Annexin V- FITC / PI凋亡检测试剂盒(北京索莱宝)。
二、实验方法
1 细胞的培养 将正常肺上皮细胞BEAS-2 B、肺癌细胞NCI-H1975、NCI-H460、A549,在37 ℃、5 % CO2的恒温培养箱的条件下,用含10 %胎牛血清的DMEM培养基进行常规的细胞培养,并进行传代。
2 细胞的转染与分组 将肺癌细胞NCI-H1975随机分成blank组(不做任何处理)、si-NC组(转染si-NC)、si-MiR497HG组(转染si-MiR497HG)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-588组(转染anti-miR-588)、miR-NC组(转染miR-NC)、miR-588组(转染miR-588 mimics)、si-MiR497HG+anti-miR-NC组(共转染si-MiR497HG和anti-miR-NC)、si-MiR497HG+anti-miR-588组(共转染si-MiR497HG和anti-miR-588),按LipofectamineTM 2000转染试剂盒说明书要求操作,转染48 h,用qRT-PCR法检测转染效率。转染成功后用于qRT-PCR实验、MTT实验、Transwell实验、流式细胞术实验。
3 qRT-PCR法检测细胞中MiR497HG、miR-588表达 Trizol法提取细胞中总RNA,用Nano-Drop 2000微量分光光度计进行RNA定量。逆转录反应采用逆转录试剂盒方式,操作按照试剂盒说明书进行,合成模板链cDNA。按照反应体系进行,每个样品重复3次,取平均值,反应结束后通过比较Ct值,以U6作为内参,计算2-△△Ct的值,测定MiR497HG、miR-588的相对表达水平。
4 MTT法检测细胞增殖 将各组细胞制成混悬液,调整密度至104个/mL,然后接种至96孔板,取适量1.2.2各组细胞,每孔加MTT溶液(5 mg/mL)20 μL,孵育4 h,丢弃上清,加150 μL 的DMSO,震荡,溶解结晶,在OD490 nm波长下检测细胞吸光值(A)。
5 Transwell小室检测细胞的迁移侵袭 将 Transwell小室置于孔上,放入细胞培养箱平衡30 min。然后将各组细胞消化,用纯RPMI 1640培养基配制成5×105个/mL的细胞悬液。每个小室加入200 μL细胞悬液,即每孔细胞约为1×105个。每组设置3个复孔,将24孔板放入37℃、5% CO2培养箱中培养24 h后,小心移出上室,用棉签擦去上室膜下表面的迁入细胞,PBS洗2次,甲醇固定30 min。晾干后,用结晶紫染液(1g/L)染色20 min,再用双蒸水冲洗。取出晾干,置于倒置显微镜下拍照,选取5个不同视野,拍照计数,取平均值。
将转染成功的对数期细胞进行Transwell侵袭实验。将基质胶和培养基按1 ∶8稀释后(60 μL)铺于培养小室上,风干后备用,其他步骤同Transwell体外迁移实验。
6 Annexin V/ PI双染色流式细胞术检测细胞凋亡 将各转染组细胞,用 500 μL 的Binding Buffer悬浮细胞,分别加入5 μL的 Annexin V- / FITC避光反应20 min后再加入5 μL的PI避光反应20 min,用300目铜筛过滤,上流式细胞仪进行检测。凋亡率(%)= 早期凋亡率+晚期凋亡率。
7 双荧光素酶报告基因检测实验检测细胞中MiR497HG与miR-588的结合力 将MiR497HG -WT(含MiR497HG片段)和MiR497HG-MUT(含MiR497HG突变体)的荧光素酶报告载体,采用LipofectamineTM2000与miR-588、miR-NC共转染,24 h后,按双荧光素酶报告基因检测试剂盒技术操作手册要求进行检测荧光强度,记录萤火虫荧光素酶和海肾荧光素酶的荧光活性,以两者的比值表示MiR497HG与miR-588的结合能力。
结 果
一、MiR497HG、miR-588在肺癌中的表达
与BEAS-2B组相比,NCI-H1975组、NCI-H460组、A549组细胞中MiR497HG表达均显著升高,miR-588表达显著降低(P<0.05)(见表1)。
表1 MiR497HG、miR-588在肺癌细胞中的表达
注:与BEAS-2B组比较,*P<0.05
二、抑制MiR497HG对肺癌细胞增殖、迁移侵袭及凋亡的影响
与si-control组相比,si-MiR497HG组NCI-H1975细胞中MiR497HG表达显著降低,48、72 h时细胞增殖显著降低,迁移细胞数和侵袭细胞数均显著降低,细胞凋亡率显著升高(P<0.05)(见表2,图1)。

图1 抑制MiR497HG的肺癌细胞凋亡图

表2 抑制MiR497HG对肺癌细胞增殖、迁移侵袭及凋亡的影响
注:与si-NC组比较,*P<0.05
三、 MiR497HG靶向miR-588
通过生物信息学在线预测网站(http://mircode.org/)预测到miR-588与MiR497HG之间存在8个互补的结合位点(图2);双荧光素酶报告基因检测实验结果显示,与miR-NC组相比,miR-588组WT-MiR497HG细胞中荧光活性显著降低(表3);与anti-miR-NC组相比,anti-miR-588组细胞中MiR497HG表达显著升高,与miR-NC组相比,miR-588组细胞中MiR497HG表达显著降低(表4,P<0.05)。
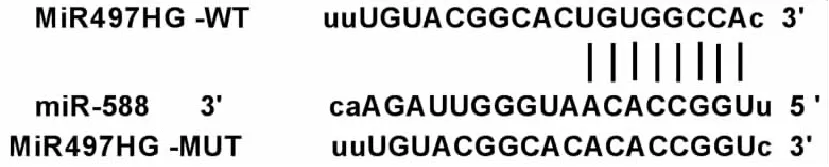
图2 miR-588与MiR497HG的靶向结合位点

表3 双荧光素酶报告基因检测实验结果
注:与miR-NC组比较,*P<0.05

表4 miR-588对HMBOX1表达的影响
注:与anti-miR-NC组比较,*P<0.05, 与miR-NC组比较,#P<0.05
四、过表达miR-588对肺癌细胞增殖、迁移侵袭及凋亡的影响
通过MTT实验、Transwell实验、流式细胞术。与miR-NC组相比,miR-588组NCI-H1975细胞miR-588表达显著升高,48、72 h时细胞增殖显著降低,迁移细胞数和侵袭细胞数均显著降低,细胞凋亡率显著升高(P<0.05)(见表5,图3)。
五、抑制miR-588对抑制MiR497HG的肺癌细胞增殖、迁移侵袭抑制及凋亡促进作用的影响
与si-MiR497HG+anti-miR-NC组相比,si-MiR497HG+anti-miR-588组NCI-H1975细胞中MiR497HG表达显著升高,48、72 h时细胞增殖显著升高,迁移细胞数和侵袭细胞数均显著升高,细胞凋亡率显著降低(P<0.05)(见表6,图4)。

图3 过表达miR-588的肺癌细胞凋亡图

表5 过表达miR-588对肺癌细胞增殖、迁移侵袭及凋亡的影响
注:与miR-NC组比较,*P<0.05
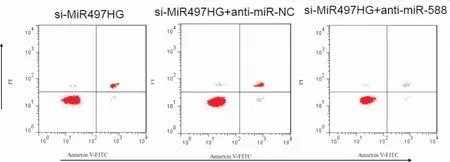
图4 抑制miR-588并抑制MiR497HG的肺癌细胞凋亡图

表6 抑制miR-588对抑制MiR497HG的肺癌细胞增殖、迁移侵袭抑制及凋亡促进作用的影响
注:与si-MiR497HG+anti-miR-NC组比较,*P<0.05
讨 论
最近,LncRNA正在成为各种流行癌症(如肺癌)中肿瘤抑制和致癌功能的重要因素[8-9]。 LncRNAs是长度在200 nt到100 kb,缺乏明显的开放阅读框架,因此,它们不能作为蛋白质合成的模板[10]。 尽管如此,LncRNA可能是多种类型癌症中肿瘤发生的主要原因[11]。 例如,lncRNA转移相关的肺腺癌转录物1(MALAT1)被认为通过影响运动相关基因的表达来增强体外非小细胞肺癌细胞的细胞迁移[12]。Eissa等[13]在膀胱癌的研究中报道,Lnc RNA miR-497-HG具有较高的诊断膀胱癌的准确度,对膀胱癌的诊断和靶向治疗具有巨大的潜力。Ding等[14]在原发性肺癌的乳腺癌中发现,MiR497HG的表达异常升高。我们推测MiR497HG在肺癌中可能也会出现异常表达,并对肺癌细胞的细胞表型具有一定的调控作用。为了验证这一猜测,本研究运用qRT-PCR法检测了肺癌细胞中MiR497HG的表达,发现MiR497HG异常升高,这与其在膀胱癌中的高表达和Ding的实验结果相吻合,证实了MiR497HG在肺癌细胞中的异常上调;进一步研究发现,抑制MiR497HG可抑制肺癌细胞的增殖、迁移侵袭,促进凋亡,这些结果为探索MiR497HG在肺癌中的功能提供更充分的理论依据;深入研究,通过生物信息学、双荧光素酶报告基因检测实验和Western blot实验验证MiR497HG可靶向负调控miR-588,提示MiR497HG在肺癌中的功能可能与调控miR-588相关。
miRNA被认为是一类非编码RNA,通过抑制靶基因的3′UTR区域的mRNA,调节基因的表达[15]。研究表明,miRNA在细胞过程中具有至关重要的作用,包括增殖、凋亡和细胞能动性。miRNAs的失调已在多种类型的肿瘤中得到证实,包括肺癌、乳腺癌和结肠癌,调控肿瘤的发生[16-18]。在这些miRNA中,miR-588在前列腺癌中高表达,与预后差相关[19],其在胃癌、乳腺癌中均低表达,发挥抑癌功能[20-21]。Qian等[22]在研究中报道,miR-588在肺鳞癌组织中的表达明显的低于非肿瘤组织,并与肿瘤的分期、淋巴结侵袭呈负相关,并且其还可靶向颗粒体蛋白前体(GRN)抑制肿瘤细胞的迁移和侵袭,揭示了GRN参与miR-588介导的肺鳞癌进展中的抑制功能。本研究运用qRT-PCR法检测了肺癌细胞中miR-588的表达发现,miR-588的表达异常降低,并且过表达miR-588可抑制肺癌细胞的增殖、迁移侵袭,促进凋亡,这些实验结果与Qian在肺鳞癌中的研究结果相一致,再次证实miR-588在肺癌中的抑癌功能,为深入探索miR-588在肺癌中的潜在治疗价值奠定基础;进一步研究发现,过表达miR-588可逆转MiR497HG对肺癌细胞的增殖、迁移侵袭的抑制和凋亡的促进作用,这说明不仅MiR497HG可靶向调控肺癌细胞中miR-588的表达,相反,miR-588也可逆向负调控MiR497HG的表达和功能。这为MiR497HG、miR-588在肺癌中的功能探索提供更充分的理论参考。在前人研究的基础上,我们推理发现MiR497HG/miR-588/GRN信号通路在肺癌的增殖、迁移和侵袭过程中发挥重要作用,由于miR-588在胃癌中还可靶向EIF5A2调控癌细胞的迁移侵袭[20],我们猜测miR-588在肺癌中有很大可能也可靶向EIF5A2调控肺癌的进展。本课题后续将继续探讨肺癌中miR-588下游的靶蛋白基因的调控机制,为肺癌的精准治疗提供更充分的理论支持。
综上所述,长链非编码RNA MiR497HG可抑制肺癌细胞的增殖、迁移侵袭,促进凋亡,其机制与靶向负调控miR-588有关,为肺癌的治疗提供新的治疗靶标。
