板栗外生菌根细胞结构及其细胞壁组分的变化
2020-03-09张昊琳孙芝林王溢洋赵永廉李虎臣曹庆芹
李 晓,张昊琳,孙芝林,王溢洋,孙 岩,赵永廉,李虎臣,c,秦 岭,c,曹庆芹,c *
(1a.北京农学院植物科学技术学院/农业应用新技术北京市重点实验室/北京林果业生态环境功能提升协同创新中心,1b.北京农学院生物与资源环境学院/农业农村部华北都市农业重点实验室,1c.北京林木分子设计育种高精尖创新中心,北京102206;2. 北京市怀柔区板栗试验站,北京 101405)
板栗是中国重要的生态经济林树种,坚果产量位居世界第一[1],由于其优良的适应性和抗病虫害能力,成为栗属植物育种的重要资源[2-3]。
外生菌根是菌根真菌侵染植物根系后与植物互惠共生的一种结构,主要由菌套、哈蒂氏网、外延菌丝三部分组成。外生菌根真菌的菌丝大部分附着在幼嫩侧根的表面形成菌套,一部分会进入到根系外皮层细胞间隙形成哈蒂氏网。附着在根系表面的菌丝类似于根毛的作用,由此增加根系的吸收面积。外生菌根的形成能促进植物对土壤水分与营养物质的吸收,提高共生植物的抗逆性[4]。赵敏对樟子松幼苗接种不同菌种发现,菌种不同的菌根结构存在差异,有棒状、爪状、二叉状结构等,但以棒状和二叉状结构居多[5]。杨小明在松树根系内观察到同时存在内外生菌根[6]。秦岭等对板栗外生菌根真菌类型进行调查,确认优势菌种[7]。Chen等对菌根磷转运蛋白基因进行研究,得出CmPT4为板栗菌根磷转运蛋白基因的结论[8]。有关栗属植物的菌根细胞结构在国内外鲜见报道。
Luo等发现杨树外生菌根的形成会改变根系细胞结构[9]。纤维素是一种天然的可再生资源,作为细胞壁的主要成分,使细胞壁具有一定的刚性。胼胝质在细胞壁中的含量相对较少,主要累积在筛管分子的细胞质内,逆境条件下,会生成大量的胼胝质堵塞筛孔,这不仅增强细胞壁的结构还减少有害物质的侵入[10]。病原体感染植物时胞间连丝会有胼胝质的积累,如当病毒感染高粱[11]、马铃薯[12]时,发现在其胞间连丝处胼胝质增多。Van等发现,在铝胁迫下南瓜根细胞壁纤维素含量增加[13]。这些研究表明,逆境时纤维素和胼胝质含量会增多,而外生菌根的形成使植物抗性增强,且可以改变根系的细胞结构,由此研究板栗根系及外生菌根细胞壁纤维素和胼胝质的变化具有重要的科学意义。有关板栗根系细胞壁相关成分的变化未见报道。本试验研究了板栗外生菌根不同发育阶段的细胞结构变化,采用荧光染料标记细胞壁[14]的纤维素和胼胝质成分,为菌根形成的机制研究提供试验依据。
1 材料与方法
1.1 试验材料
试验材料取自北京市怀柔板栗试验站‘燕山红栗’。选用两种试验材料,一种是7月雨季过后采集田间无菌套和菌套明显的板栗根系,分别称为田间非菌根、田间菌根;根据根系细胞结构的横切图,将田间非菌根称为时期Ⅰ,田间菌根依据外皮层细胞间隙无哈蒂氏网、个别外皮层细胞间隙有哈蒂氏网、外皮层细胞间隙均有哈蒂氏网,分别称为时期Ⅱ、时期Ⅲ、时期Ⅳ。另一种为板栗果实完全成熟时,采集板栗果实用于离体培养板栗苗获取根系,称其为组培根。
1.2 试验方法
1.2.1 石蜡切片法 将采集的根系切成约0.5 cm的根段,经FAA固定液固定过夜。依次用50%、70%、80%、95%、100%、100%无水乙醇对材料逐级脱水,时间分别为30、30、30、30、15、15 min。将脱水后的材料依次置于1∶1的二甲苯乙醇溶液、纯二甲苯、二甲苯中处理,依次处理60、30、30 min。加入石蜡碎屑至饱和,并于42 ℃恒温箱内过夜。12 h后将材料置于60 ℃恒温箱内,二甲苯蒸发60 min,将原液倾去,4.5 h内换纯蜡2次(每隔1.5 h换纯蜡1次)。将浸好蜡的材料与石蜡一起倒入叠好的纸盒内,冷却凝固成蜡块。
刀片与石蜡约为15°,切片为7 μm。载玻片上滴1滴粘片剂,涂抹均匀后,滴1滴清水,40 ℃烘片机预热,用镊子夹取一截蜡带,将蜡带光亮平整的一面向下贴于载玻片上。待蜡带展开后用吸水纸吸去多余水分,在烘片机上烘至没有气泡后置于37 ℃恒温箱内烘干。二甲苯溶液浸泡2次,每次15 min,1∶1的二甲苯和乙醇混合液浸泡15 min达到脱蜡目的。
依次用100%、100%、95%、85%、70%、50%乙醇进行复水,复水各5 min。用1%的番红37 ℃放置2 d。洗染液,依次用50%、60%、70%、70%、85%、95%、95%乙醇各2 min,0.5%固绿2 min,95%乙醇洗色,用95%、100%、100%乙醇各5 min再次脱水。1∶1的二甲苯乙醇溶液5 min,二甲苯5 min 2次。通风橱内风干,显微镜观察拍照。
1.2.2 离体条件板栗苗的培养 选取健康饱满的板栗种子,剥皮并将种子切成边长为1.5 cm的类正方体,在超净工作台75%乙醇消毒2 min、3% NaClO消毒15 min、灭菌水冲洗5~6次。切割材料露出新鲜切面,胚尖朝下接种在WPM培养基中,25 ℃暗培养3 d。下胚轴2~3 cm时,25 ℃(16 h光照8 h黑暗)培养诱导侧根的发生,7 d左右采集根系固定用于切片,将此根系称为组培根。
1.2.3 根系细胞结构数据的测量 依据板栗外生菌根在细胞结构上的差异,使用IPP软件测量菌套厚度、外皮层细胞的径向长度和横向宽度,每张图随机选取3个测量点,共重复3次。
1.2.4 板栗根系细胞壁中纤维素、胼胝质的标记及观察 石蜡切片后的根用Calcofluor White Stain(SIGMA公司)和苯胺蓝(SIGMA公司)染料分别避光孵育10、30 min,蒸馏水冲洗后置载玻片于正置荧光显微镜(Olympus BX51)下,在405 nm激发光的同一荧光强度下用彩色CCD照相机(Olympus DP72)采集图像。
1.2.5 数据分析 采用Excel 2007绘制图表,IPP软件用于测量荧光数据,SPSS软件单因素分析荧光数据。
2 结果与分析
2.1 板栗菌根田间形态观察及分析
田间样本纵切观察发现(图1),田间非菌根外皮层细胞间隙无哈蒂氏网;田间菌根根系切片可见厚的菌套结构,且外皮层细胞间隙有明显的哈蒂氏网,这说明已经形成外生菌根,哈蒂氏网是外生菌根的典型特征。

图1 田间板栗外生菌根纵切图Fig.1 Longitudinal cutting of Chinese chestnut ectomycorrhiza in the field
田间样本进行横切观察发现(图2),时期Ⅰ,即田间非菌根化的根系,外皮层细胞呈圆形和椭圆形,横向宽度大于或等于径向长度,细胞之间无挤压;菌根形成的初期、中期,即时期Ⅱ、时期Ⅲ根系外形相似,均可观察到厚的菌套,外皮层细胞间隙无哈蒂氏网、个别外皮层细胞间隙有哈蒂氏网,且外皮层细胞径向长度更长,细胞之间相互挤压。菌根形成的后期,即时期Ⅳ,外围包被厚的菌套,且在整个外皮层细胞间隙均可见哈蒂氏网,外皮层细胞径向伸长明显,其径向长度明显大于横向宽度。

图2 田间板栗外生菌根横切图Fig.2 Cross-section of Chinese chestnut ectomycorrhiza in the field
田间样本进行横切后,对时期Ⅰ至时期Ⅳ的菌套厚度、外皮层细胞径向长度以及横向宽度进行测量(图3)。时期Ⅰ至时期Ⅳ,随着菌根的发育,外皮层细胞的径向长度呈直线上升趋势,在时期Ⅳ径向长度达最大值为41.61 μm。菌套厚度呈现总体上升的趋势,但时期Ⅱ的增加量最大为19.5 μm,相比而言,时期Ⅲ至时期Ⅳ的走势最缓慢,说明菌套的形成在时期Ⅱ就已完成。外皮层细胞的横向宽度整体在变短,但在时期Ⅲ有少许增加,横向宽度最小值体现在时期Ⅳ上,最小值为12.25 μm。图4可见在侧根尖端分为两个近似等大的新一级侧根,这是一个较典型的外生菌根二分叉结构剖面图。

图3 板栗不同时期外生菌根细胞结构变化Fig.3 Changes of cell structure in different periods of ectomycorrhiza of Chinese chestnut
2.2 板栗根系细胞壁中相关物质的标记
2.2.1 不同类型板栗根系细胞壁中纤维素含量的差异 为检测菌根形成过程中纤维素含量变化,用纤维素荧光染料进行标记。由图5、图6可知,组培根与田间非菌根的各项指标均无显著差异,田间菌根与田间非菌根的外皮层细胞纤维素含量差异显著,前者比后者增加了43.4%,两者的中柱细胞纤维素含量具有显著性,田间菌根比田间非菌根增加了39.3%。田间菌根三个测量指标菌套、外皮层和中柱,其中菌套纤维素含量最高。
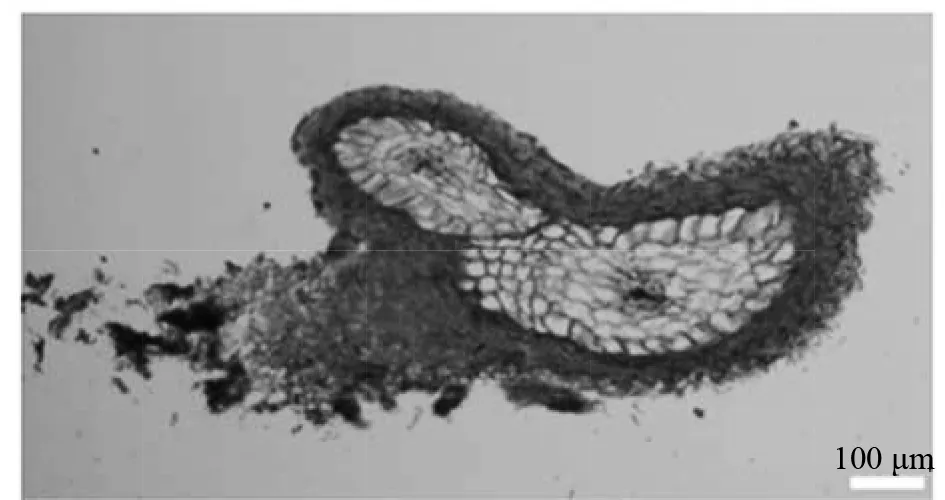
图4 板栗外生菌根二分叉结构Fig.4 Bifurcation structure of Chinese chestnut ectomycorrhiza

图5 板栗根系细胞壁中纤维素的标记(bar 100 μm)Fig.5 Marking of cellulose in the cell wall of Chinese chestnut roots (bar 100 μm)
2.2.2 不同类型板栗根系细胞壁中胼胝质含量的差异 为检测菌根形成过程中胼胝质含量变化,用胼胝质荧光染料进行标记。组培根与田间非菌根的胼胝质含量在外皮层和中柱细胞这两者上具有显著差异,尤其在中柱细胞,田间非菌根是组培根的1.95倍。田间菌根与田间非菌根的胼胝质含量在中柱和外皮层细胞上差异显著,在中柱细胞上,田间菌根胼胝质含量比田间非菌根降低了21.6%。在外皮层细胞上,田间非菌根胼胝质含量虽高于田间菌根,但其差异并不明显(图7,图8)。
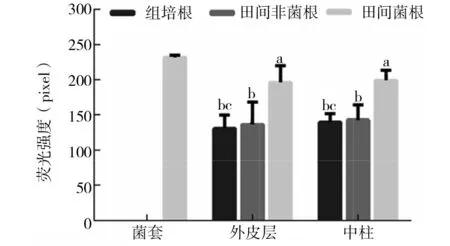
图6 板栗根系细胞壁中纤维素标记的荧光强度比较Fig.6 Comparison of fluorescence intensity of cellulose markers in the cell wall of Chinese chestnut roots
3 讨 论
板栗非菌根化的根系结构观察发现,外皮层附近观察不到菌丝体,无菌套结构,外皮层细胞径向长度与横向宽度大小一致,细胞之间无挤压;对于菌根化的板栗根系,可见厚的致密菌套,外皮层细胞间隙均可见明显的哈蒂氏网,外皮层细胞径向长度显著大于横向宽度,且细胞与细胞的分界线呈曲线状,这可能是由于菌丝的侵入影响外皮层细胞的纵向长度,观察表明菌丝多数是从细胞间隙由外而内侵入,菌丝占据细胞间隙的位置,造成外皮层细胞横向宽度的缩短、径向长度的变长,细胞整体轮廓表现出被挤压的状态。Luo等发现,真菌P.involutus与杨树根形成典型的外生菌根结构,如菌套、哈蒂氏网,而且外生菌根的形成改变了根的细胞构造,与非外生菌根细胞相比,外生菌根外皮层细胞肿胀,导致每个细胞的横截面积增大约3~4倍[9]。

图7 板栗根系细胞壁中胼胝质的标记(bar 100 μm)Fig.7 Markers of enamel in the cell wall of Chinese chestnut roots (bar 100 μm)

图8 板栗根系细胞壁中胼胝质标记的荧光强度比较Fig.8 Comparison of fluorescence intensity of enamel markers in the cell wall of Chinese chestnut roots
板栗根系细胞壁纤维素的荧光标记表明,菌根在菌套、外皮层的纤维素含量显著高于非菌根,但与中柱差异不显著,这是由于纤维素同时也是真菌细胞壁的组成成分,真菌的侵入使根外皮层细胞纤维素含量增加,而菌丝很少侵入中柱。田间非菌根中柱的胼胝质含量显著高于菌根的胼胝质含量,这是因为对于抗性强的植物,胼胝质形成的少,而菌根的形成会提高植物的抗逆性[15],相比于田间菌根,田间非菌根胼胝质含量更高。Luo等发现外生菌根的形成改变细胞壁的组分,而且Luo已经证实这种改变的原因,即果胶甲酯酶的减少,扩展蛋白和纤维素合成酶转录物的增加[9]。这与本研究中外生菌根的形成使纤维素含量增加的结果一致。
