高亚麻酸油菜3种不饱和脂肪酸含量的遗传分析
2020-03-08练景龙张笑晗代春艳王晓丽弓琼于澄宇
练景龙 张笑晗 代春艳 王晓丽 弓琼 于澄宇


摘要:用高亚麻酸亲本YH25005与中亚麻酸亲本Z9、高亚麻酸亲本R8Q10与中亚麻酸亲本D636配制2个杂交组合,采用主基因+多基因混合遗传分离分析方法,对甘蓝型油菜的6个世代遗传群体(P1、P2、F1、B1、B2、F2)的脂肪酸含量进行统计分析。结果表明:油酸在YH25005×Z9中受2對加性-显性-上位性主基因+加性-显性-上位性多基因控制,主基因遗传力为30.23%;油酸在R8Q10×D636中受2对加性-显性-上位性主基因控制,主基因遗传力为56.63%。亚油酸在YH25005×Z9中受2对等效加性主基因控制,主基因遗传力为1.43%;在R8Q10×D636中受2对加性-显性-上位性主基因控制,主基因遗传力为82.21%。亚麻酸在2个组合衍生群体中都符合加 性- 显性-上位性多基因模型,YH25005×Z9、R8Q10×D636中多基因遗传力分别为37.04%和58.77%。
关键词:油菜;高亚麻酸;脂肪酸;遗传分析;混合遗传模型
中图分类号:S634.303 文献标志码:A 文章编号:1002-1302(2020)21-0084-09
油菜是我国本土种植的第一大油料作物,但是随着人口增长和生活水平提高,我国油菜生产难以满足需求,从而转变为油料进口大国,尤其是高质量菜籽油较为缺乏[1]。菜籽油主要由7种脂肪酸组成,低芥酸菜籽油主要含油酸(C18 ∶ 1)、亚油酸(C18 ∶ 2)、α-亚麻酸(ALA,C18 ∶ 3),油酸是亚油酸合成底物,亚油酸是亚麻酸合成底物,三者含量密切相关,合计占脂肪酸总含量的90%左右[2]。三者均为不饱和脂肪酸,分别属于单不饱和脂肪酸、双不饱和脂肪酸、三不饱和脂肪酸。不饱和脂肪酸具有目前国际医学界和营养界公认的重要生理功能[3-4],尤其是ω-3类的α-亚麻酸,是人体自身无法合成的必需脂肪酸,更是合成人体必需的另外2种ω-3脂肪酸EPA(二十碳五烯酸)和DHA(二十二碳六烯酸)的前体物质。DHA被称为“脑黄金”,是大脑和视网膜的重要构成成分,能够促进婴幼儿的大脑和视力发育、神经修复;EPA俗称血管清道夫,能增加血管弹性,降低血液黏稠度[5]。鉴于我国居民膳食中海产品较缺乏,我国居民体内不缺油酸而对ω-3类摄入严重不足,以及我国食用植物油存储时间短、消费周转快、高温煎炸用油量比例少,对α-亚麻酸营养需求远大于对加工稳定性的需求,李殿荣等认为目前双低油菜育种中亚麻酸含量(9%左右)不但不应该降低,还应适当提高,育成的α-亚麻酸比例15%~20%的高亚麻酸材料开创了油菜品质改良的新方向[6-7]。
深入研究脂肪酸含量的遗传规律,是油菜脂肪酸改良的重要理论基础。油菜脂肪酸含量属于数量性状,除了受少数主基因控制外,还受大量微效多基因控制,同时基因与环境的互作效应、基因表达水平修饰等也会对脂肪酸的含量和比例产生影响[8]。盖钧镒等提出基于主基因+多基因混合遗传理论的遗传分离分析方法,实现了利用不同的遗传群体材料分析主基因数量及其遗传效应[9-10]。该遗传分析方法已广泛应用于作物农艺、品质、抗性等重要数量性状的遗传研究[11-13]。有关油菜脂肪酸含量的遗传研究相对较少,研究结果也不尽相同。
由于不同分离世代鉴定效率在作物数量性状主基因+多基因遗传模型分析中存在差异,使用单个分离世代的遗传信息鉴定主基因和多基因存在一定的局限性,多个世代联合分析的方法可以克服个别分离世代的不足,从而更全面地鉴定其遗传效应[14]。因此,本研究分别选用高亚麻酸品种和低亚麻酸品种杂交构建群体材料,深入研究甘蓝型油菜部分脂肪酸含量的遗传规律,不仅为甘蓝型油菜主要脂肪酸含量的遗传改良提供理论指导,也为数量性状位点(QTL)定位和相关基因的克隆奠定基础。
1 材料与方法
1.1 材料
本研究的亲本材料YH25005和R8Q10是西北农林科技大学通过种内杂交和多年定向选择得到的低硫苷、低芥酸、高亚麻酸种质,其亚麻酸比例大于15%,最高株系平常年份可达17%~20%,D636和Z9分别是从品种杂油66、中双9号选择而来的中亚麻酸双低品系。配制R8Q10×D636、YH25005×Z9杂交获得F1,F1自交获得F2,F1和双亲分别回交获得B1、B2世代种子。
1.2 方法
2018年9月下旬在西北农林科技大学试验田播种6个世代遗传群体材料。其中,P1、F1、P2各种植10行,每行播100粒,后期间苗至每行15株,行长2 m,行距40 cm,四周设保护行,栽培管理与当地生产一致。成熟后,各世代按单株收获、单株脱粒,种子精选去杂待测。利用FOSS 5500近红外仪测定种子品质指标,包括7种脂肪酸组分的比例。
1.3 数据分析
以盖钧镒等提出的主基因+多基因混合遗传模型作为多世代联合遗传分析方法,具体分析步骤:先计算遗传模型的极大似然函数值(MLV,maximum likehood value)和Akaike信息准则(AIC,akaike information criterio)值,初步选择AIC值较小的3个模型为备选模型;然后对入选的3个模型进行适合性检验,包括U21、U22、U23、nW2和Dn 5个统计量;在此基础上,根据模型AIC值较小和6个世代30个统计量P<0.05的个数较少的原则选择最优遗传模型;最后依据最优模型的各成分分布参数,采用最小二乘法估计各基因效应值、方差等遗传参数。主基因遗传力和多基因遗传力计算公式如下:
主基因遗传力h2mg=σ2mg/σ2p×100%;
多基因遗传力h2pg=σ2pg/σ2p×100%。
式中:σ2mg、σ2pg和σ2p分别表示主基因方差、多基因方差和表型方差。数据分析采用章元明教授研发的R语言软件包分离分析(SEA,segregation analysis),用Microsoft Excel软件估算平均数、标准差、遗传参数等,用SPSS软件制作次数分布图。
2 结果与分析
2.1 各世代脂肪酸含量的表型分布
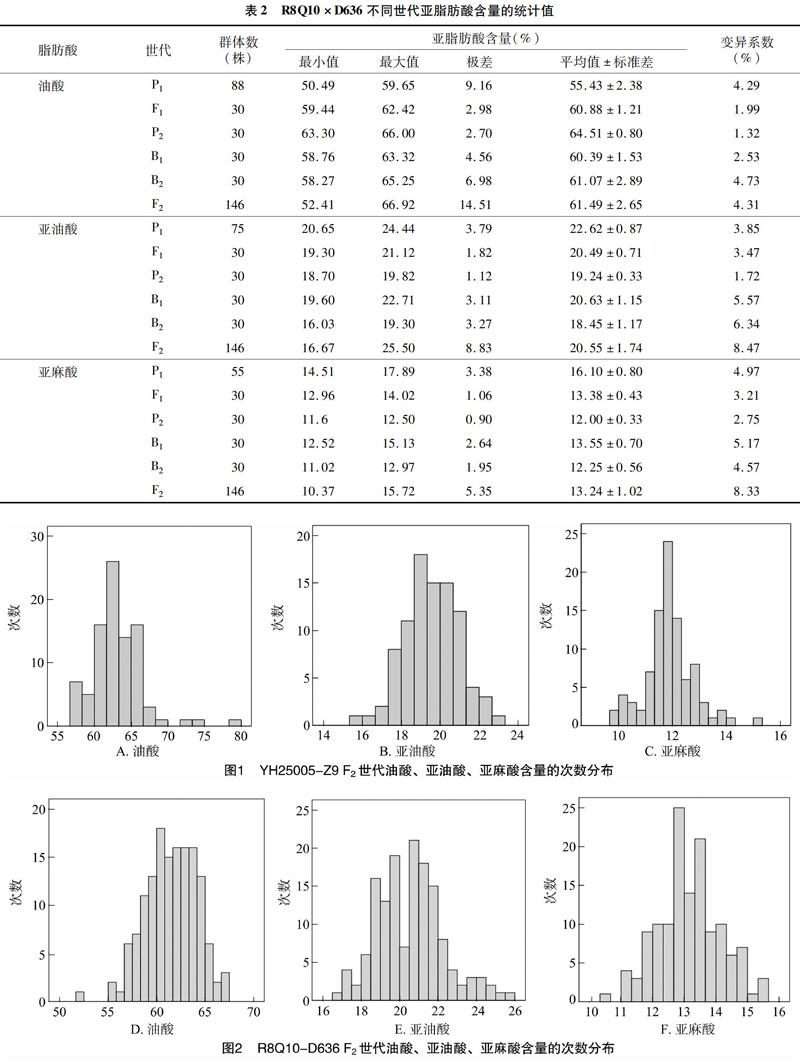
YH25005×Z9、R8Q10×D636不同世代油酸、亚油酸、亚麻酸含量的统计值分别见表1、表2。从中可以看出,不论是组合YH25005×Z9还是组合R8Q10×D636,P1和P2脂肪酸含量均存在显著差异。F1脂肪酸含量介于双亲之间。B1和B2 2个回交世代脂肪酸酸含量也均介于双亲之间,但含量均值更偏向于回交亲本。F2世代脂肪酸含量均值也介于双亲之间。从变异系数看,P1、P2、F1不分离世代亚麻酸含量的变异度较小,B1、B2、F2世代亚麻酸含量的变异度较大。此外,从后代极值可以看出,仅有少数脂肪酸低于或高于亲本且幅度较小,整体上不存在明显的超亲优势。
F2代脂肪酸含量的次数分布见图1、图2。从中可以看出,油酸、亚油酸、亚麻酸含量的次数分布符合数量性状的分布特征,部分F2世代呈非正态分布。表明脂肪酸组分的遗传除了受多基因控制外,可能还存在主基因遗传。
2.2 最优遗传模型选择
共获得24种遗传模型的MLV和AIC值(表3、表4)。首先根据AIC值较小的原则进行模型初选,选择3个AIC值较小的模型作为备选模型,对被选模型进行适合性检验(表5、表6)。根据模型AIC值较小和6个世代30个统计量P<0.05的个数较少的原则最终选择最优遗传模型。最后确定最优遗传模型,YH25005×Z9的油酸、亚油酸、亚麻酸分别为MX2-ADI-ADI、2MG-EA、PG-ADI;R8Q10×D636的油酸、亚油酸、亚麻酸分别为 2MG-ADI、2MG-ADI、PG-ADI。
2.3 遗传参数
表7给出了YH25005×Z9最佳遗传模型的遗传参数估计值。油酸含量符合MX2-ADI-ADI(2对加性-显性-上位性主基因+加性-显性-上位性多基因),第1、第2对主基因加性效应值和显性效应值均为负数,说明主基因对油酸含量有负效应;2对基因的加性效应间互作、显性效应间均为2.96,互作(l)为2.96,表明2对基因之间存在明显互作,对该组合油酸含量影响较大;主基因遗传力为30.23%,这些结果表明该组合油酸含量主要受到2对主基因和环境的影响。亚油酸含量最优遗传模型为2MG-EA(2对等加性主基因),2对主基因加性效应值均为0.471 7,说明2对主基因对亚油酸含量产生相等正效应但主基因遗传力仅为1.43%,环境影响较大。亚麻酸符合PG-ADI(加性-显性-上位性多基因)遗传模型,表型方差(σ2p)和多基因方差(σ2pg)分别为0.79和0.29,计算出多基因遗传力为37.04%;结果表明该群体亚麻酸主要受到多基因和环境的共同影响。
从表8可见,R8Q10×D636后代油酸含量符合2MG-ADI(2对加性-显性-上位性主基因),第一、第二主基因加性效应值均为负数,说明主基因对油酸含量产生负效应;2对主基因显性效应间互作为-1.87,加性×显性互作、显性×加性互作分别为1.47和3.08,表明2对基因之间存在着明显互作,且对该组合油酸影响较大;主基因遗传力为56.63%,表明油酸主要受2对主基因和环境的影响。亚油酸含量最优遗传模型也为2MG-ADI(2对加性-显性-上位性主基因),第一、第二主基因加性效应值分别为2.14、-0.45,说明第一对主基因的加性效应大于第二对主基因的绝对值且为正效应,2对主基因显性效应均为负数,2对主基因的加性效应间互作(i)为-0.49,显性效应间互作(l)为1.77,加性和显性之间的互作效应(jab和jba)分别为-0.47和1.55,表明2对基因之间存在着明显互作;主基因遗传力为82.21%,表明该组合亚油酸主要受到主基因的影响。亚麻酸符合PG-ADI(加性-显性-上位性多基因)遗传模型,表型方差(σ2p)和多基因方差(σ2pg)分别为1.04和0.61,多基因遗传力为58.77%,结果表明该群体亚麻酸主要受到多基因的影响。
3 讨论与结论
国内外对油料作物脂肪酸含量的遗传调控研究较为广泛和深入,但由于亲本、群体、方法、试验环境不同,前人做出了许多QTL定位但是结果并不一致,而利用数量性状主基因+多基因遗传模型研究相对较少。对于油菜的油酸,索文龙等认为油酸含量是由2对主基因+多基因共同影响的,表现出上位效应和部分的显性效应[15]。张洁夫等在N8和N13连锁群上各检测到1个控制油酸含量的QTL,对油酸的贡献率分别达到11.7%和27.1%[16]。钦洁等在DH群体的N5连锁群上重复检测到油酸的1个主效QTL,解释遗传变异率为84.63%,由此推测油酸是由1对主基因控制,且受环境影响较小[17]。郭世星认为油酸受2对加性-显性-上位性主基因加性-显性-上位性多基因遗传系统控制,主基因遗传力为67.69%~86.84%,多基因遗传力为0.03%~9.89%,表明油酸的遗传以主基因为主[18]。杨庆勇等利用SJDH群体,对油菜种子中油酸含量进行QTL定位,结果表明控制油酸含量的主效QTL位于甘蓝型油菜的A5连锁群上,QTL解释了89%的遗传变异[19]。本文结果显示油酸在YH25005×Z9中受2对加性-显性-上位性主基因+加性-显性-上位性多基因控制,主基因遗传力为30.23%;在R8Q10×D636中油酸受2对加 性- 显性-上位性主基因控制,遗传力为56.63%,这与索文龙等的研究[15-16]基本一致。
关于亚油酸,张洁夫的研究表明油菜亚油酸由2对加性-显性-上位性主基因+加性-显性-上位性多基因控制,主基因的加性效應大于显性效应,上位性效应中以加加上位和显显上位为主[16]。郭世星也认为,亚油酸符合2对加性-显性-上位性主基因+加性-显性-上位性多基因模型,并且亚油酸受环境影响相对较大[18]。本研究表明,在YH25005×Z9中受2对等位加性主基因控制,2对主基因加性效应一致,主基因遗传力为1.43%;在R8Q10×D636中受2对加性-显性-上位性主基因控制,主基因遗传力为82.21%,2个群体中主基因的遗传效率差异较大,应该是不同群体的主基因不一致,其与控制油酸的两对主基因是否一致还须要进一步深入的研究,如通过QTL定位来确定。
对于亚麻酸,由于以前没有高亚麻酸油菜种质,大都是通过中亚麻酸与低亚麻酸材料杂交后代来分析的。张洁夫等的研究表明,亚麻酸含量由2对加性-显性-上位性主基因+加性-显性-上位性多基因所遗传控制,但主基因遗传力并不高(≤5%),多基因具有相对较大的遗传贡献率(34.2%~75.7%)[16]。Zhao等在甘蓝型油菜N14连锁群上检测到1个与亚麻酸含量有关的QTL,解释了约28%的遗传变异[20]。钦洁等在DH群體中重复检测到3个与亚麻酸有关的QTL,其中2个主效的QTL分别定位在N4和N14连锁群上,贡献率分别为59.00%和23.52%[17]。杨庆勇等在甘蓝型油菜A4和C4连锁群上定位到的2个有关亚麻酸含量的QTL,对亚麻酸表型变异的贡献率分别为31%和60%[19]。本研究通过6世代群体联合分析,结果表明,2个组合都符合加性-显性-上位性多基因控制,这也说明亚麻酸的遗传机制比较复杂,YH25005×Z9中F2世代多基因遗传力为37.04%;在R8Q10×D636中F2世代多基因遗传力为58.77%,与前人研究结果不同,可能是由于不同的研究群体与环境的差异造成的,但又由于主基因和多基因是一个相对的概念,在不同的群体和环境中基因的贡献率有一定的差异,主基因与多基因可能发生转换,张洁夫等的研究中显示多基因贡献率为34.2%~75.7%,主基因贡献率则较低(≤5%),可能就是这个原因。
参考文献:
[1]刘 成,冯中朝,肖唐华,等. 我国油菜产业发展现状、潜力及对策[J]. 中国油料作物学报,2019,41(4):485-489.
[2]刘后利. 油菜的遗传和育种[M]. 上海:上海科学技术出版社,1985:128-141.
[3]Goyal A,Sharma V,Upadhyay N,et al. Flax and flaxseed oil:an ancient medicine & modern functional food[J]. Journal of Food Science and Technology,2014,51(9):1633-1653.
[4]高建芹,浦惠明,龙卫华,等. 甘蓝型油菜籽粒产量和品质性状对氮肥用量的响应[J]. 江苏农业学报,2019,35(3):602-611.
[5]范文洵. α-亚麻酸及其代谢产物EPA和DHA[J]. 生理科学进展,1988(2):110-113.
[6]李殿荣,陈文杰,于修烛,等. 双低菜籽油的保健作用与高含油量优质油菜育种及高效益思考[J]. 中国油料作物学报,2016,38(6):850-854.
[7]于澄宇,练景龙,任莉锁,等. 一种高亚麻酸油菜供体及其应用CN 201811207490.7[P]. 2018-10-17.
[8]张秀英. 油菜高油酸性状的QTL定位与分析[D]. 长沙:湖南农业大学,2009.
[9]盖钧镒. 植物数量性状遗传体系的分离分析方法研究[J]. 遗传,2005,27(1):130-136.
[10]王金社,赵团结,盖钧镒. 回交自交系(BIL)群体4对主基因加多基因混合遗传模型分离分析方法的建立[J]. 作物学报,2013,39(2):198-206.
[11]刘 霞,张冰冰,马 兵,等. 甘蓝型油菜株高及其相关性状的主基因+多基因遗传分析[J]. 西北农业学报,2018,27(4):528-536.
[12]刘新春,冯宗云. 大麦籽粒阿拉伯木聚糖的主基因+多基因遗传模型分析[J]. 华北农学报,2018,33(3):119-128.
[13]刘雅辉,王秀萍,李 强,等. 棉花苗期耐盐性主基因和多基因混合遗传分析[J]. 西北农业学报,2015,24(8):57-61.
[14]盖钧镒,王建康. 利用回交或F2 ∶ 3家系世代鉴定数量性状主基因-多基因混合遗传模型[J]. 作物学报,1998,24(4):402.
[15]索文龙,戚存扣. 甘蓝型油菜油酸含量的主基因+多基因遗传分析[J]. 江苏农业学报,2007,23(5):396-400.
[16]张洁夫. 甘蓝型油菜无花瓣和脂肪酸的遗传与分子标记[D]. 南京:南京农业大学,2007:4-21.
[17]钦 洁. 甘蓝型油菜种子油酸和亚麻酸含量的遗传及其基因定位[D]. 武汉:华中农业大学,2009:1-13.
[18]郭世星. 甘蓝型油菜含油量等重要品质性状的遗传分析与QTL定位[D]. 雅安:四川农业大学,2011:1-20.
[19]杨庆勇. 油菜种子高油酸低亚麻酸的遗传控制及等位基因特异标记开发[D]. 武汉:华中农业大学,2012:1-93.
[20]Zhao J Y,Dimov Z,Becker H C,et al. Mapping QTL controlling fatty acid composition in a doubled haploid rapeseed population segregating for oil content[J]. Molecular Breeding,2007,21(1):115-125.王 斌,何文寿,耿世杰. 粉垄耕作对土壤水分利用效率和马铃薯产量的影响[J]. 江苏农业科学,2020,48(21):93-96.
