外引玉米自交系禾谷镰孢茎腐病抗性鉴定及抗性遗传初步分析
2020-03-08肖明纲张擘赵北平郑福余王玉杰
肖明纲 张擘 赵北平 郑福余 王玉杰

摘要:从2015—2017年连续3年对43份来自美国、法国、俄罗斯和德国的玉米资源进行抗禾谷镰孢茎腐病人工接种鉴定,筛选到高抗玉米禾谷镰孢茎腐病材料14份,占鉴定总材料的比例为32.6%。利用F2群体对14份高抗材料进行禾谷镰孢茎腐病抗性遗传分析,抗病、感病植株分离比例和适合性测验证明,自交系A01、A04、A18、A24、A28、F02、F03、F05、R01和G03对禾谷镰孢菌的抗性可能是由1对显性基因控制的。该研究结果可为今后我国玉米禾谷镰孢茎腐病抗性种质的引进及改良提供重要参考。
关键词:玉米自交系;禾谷镰孢茎腐病;抗性评价;遗传分析
中图分类号:S435.131 文献标志码:A 文章编号:1002-1302(2020)21-0123-05
玉米茎腐病(stalk rot,简称SR)是一种危害较重的土传病害,分布于世界各玉米种植区,在我国各大玉米主产区均有不同程度的发生。一般年份,田间有10%~20%的病株率,严重时病株率可达60%~100%,显著影响玉米产量[1-2]。玉米茎腐病致病菌组成复杂,受地理环境、气候条件及土壤微生态等因素影响[3-4]。拟轮枝镰孢(Fusarium verticillioides)、禾谷镰孢(F. graminearum)、肿囊腐霉菌(Pythium inflatum)和玉蜀黍色二孢(Diplodia maydis)是美国玉米茎腐病的主要致病菌。腐霉菌[5-7]和镰孢菌[8-10]是我国玉米茎腐病主要致病菌,而东北地区玉米茎腐病主要由镰孢菌侵染引致。随着秸秆还田技术推广、免耕、连作等耕作栽培制度的变化以及玉米生长后期适宜的温湿度条件,近几年玉米茎腐病在我国各玉米主产区加重发生,已成为玉米减产的主要病害之一[11-16]。2016年,黑龙江前期高温干旱,后期低温多雨,导致玉米茎腐病严重发生,一些生产上主推品种产量减少21.11%~44.30%[17]。2016年以来,气候条件异常、病原菌大量积累、感病品种及其相似品种大面积推广种植等因素,造成玉米茎腐病连续重度发生,严重影响我国玉米产业健康发展[18]。
最近十几年来,我国学者通过人工接种鉴定不同的玉米种质资源,发现一些对腐霉茎腐病抗性良好的材料。宋燕春等采用人工接种方法评价了287份玉米自交系对肿囊腐霉的抗性,结果发现了43份高抗自交系[19]。段灿星等2006—2009年对 836份玉米种质进行了抗腐霉茎腐病鉴定与评价,筛选出高抗种质81 份[20]。段灿星等对1 647份玉米种质和227份玉米新品种进行抗肿囊腐霉茎腐病鉴定,筛选出高抗茎腐病种质564份;对227份玉米新品种鉴定结果表明,2009—2013年间中抗以上的育成品种所占比例先呈现明显上升趋势,后呈现下降趋势[21]。杨洋等2013—2016年从1 213份玉米种质资源中筛选到207份高抗肿囊腐霉茎腐材料,且研究表明,自交系中高抗种质资源更为丰富[22]。同时,国内外学者对镰孢菌茎腐病抗性评价也做了一些有益工作,人工接种和自然发病相结合,多年多点重复鉴定。Afolabi等从50份玉米自交系中筛选到4份高抗镰孢茎腐病且抗性稳定的材料[23]。岳辉等2016—2017年通过人工接种镰孢菌混合菌种的方法,对50份辽宁省生产上主推玉米品种的亲本进行抗茎腐病鉴定,筛选出沈3336、DH25等9份高抗玉米自交系[24]。施艳等对2015—2017年河南省456份区域试验玉米品种抗镰孢菌鉴定,结果表明,玉米镰孢茎腐病抗性种质资源相对较多,抗病品种比率也呈逐年上升趋势[25]。但秸秆还田的大力推广致使土壤中病原菌的积累量持续增加、高密度品种的大面积推广种植和氮肥的大量使用,原有品种资源面对巨大的病害压力,因此,引进、鉴定和利用新的抗病种质资源具有重要意义[4]。
玉米对茎腐病的抗性存在质量性状和数量性状2种方式,针对不同致病菌,不同玉米材料具有不同抗性遗传特征。曹如槐等首次证明,玉米对肿囊腐霉菌青枯病的遗传方式因自交系而异,有的自交系具有数量性状遗传特点,有的则具有质量性状遗传特点[26]。杨典洱等对1145、Y331及其F2群体和BC1F1群体接种鉴定并统计F2群体抗感分离情况,认为自交系1145对肿囊腐霉菌引起青枯病的抗性由显性单基因控制[27-28]。宋凤景利用 F2分离群体和F2:3家系研究了齐319和X178对腐霉菌茎腐病的抗性,发现齐319和X178对腐霉菌的抗性均受显性基因控制[29]。而陈永欣的研究则表明,玉米对腐霉茎腐病的抗性呈数量性状遗传,且加性效应强于显性效应[30]。玉米对禾谷镰孢菌茎腐病的抗性遗传也存在质量性状和数量性状2种方式[31-35]。
有效控制玉米病害、减少产量损失的主要途径是培育和种植抗病品种,而优异抗性资源的发掘则是进行玉米抗病育种的材料基础。目前,玉米茎腐病在我国各玉米区发生越来越普遍,危害也逐年加重,针对这种情况,本研究利用人工接种方法,对43份引自美国、德国、法国和俄罗斯的玉米种质资源进行抗禾谷镰孢菌鉴定和评价,为我国玉米抗禾谷镰孢茎腐病育种提供抗性材料;利用 F2 群体对高抗禾谷镰孢茎腐病材料进行初步的抗性遗传分析,为进一步定位和利用其抗性基因奠定基础。
1 材料与方法
1.1 供试自交系
43份外引玉米自交系中美国30份、法国6份、俄罗斯4份、德国3份;自交系齐319(HR)和掖478(HS)为抗感对照[36]。
1.2 供試病原菌
禾谷镰孢(Fusarium graminearum)分离自黑龙江省发病玉米植株。
1.3 抗病鉴定圃设置
玉米抗禾谷镰孢茎腐病鉴定圃设在黑龙江省农业科学院生物技术研究所民主试验基地。鉴定材料顺序排列,双行种植,行长5 m,行距0.65 m,每行留25~30株,株距略小于大田生产,田间正常管理。2016年和2017年对2015年鉴定得到的抗病材料进行重复鉴定,以探究其真实抗性。
1.4 人工接种及抗性评价
1.4.1 玉米禾谷镰孢茎腐病人工接种方法 将禾谷镰孢菌菌种接种于经高压灭菌的玉米粒上,25 ℃条件下黑暗培养5~7 d,至菌丝布满玉米粒。待玉米10叶期时,扒开玉米根系一侧土壤,将病原菌培养物20~30 g接种在露出的根系处,然后覆土并进行田间浇灌,保证病原菌侵染所需要的土壤湿度条件。乳熟后期进行抗性调查[36]。
1.4.2 玉米禾谷镰孢茎腐病抗性评价 每份材料逐株调查,调查重点部位为茎基部节位,茎节明显变褐或用手指捏近地表茎节感到变软的植株,即为发病植株。分别记载调查总株数、发病株数,计算和记载发病株率。发病株率0~5.0%为1级(HR),发病株率5.1%~10.0%为3级(R),发病株率10.1%~30.0%为5级(MR),发病株率30.1%~40.0%为7级(S),发病株率40.1%~100%为9级(HS)[36]。
1.5 高抗禾谷镰孢茎腐病材料抗性遗传初步分析
用14份高抗外引材料分别与感病自交系掖478杂交,产生F2分离群体,在玉米10叶期时人工接种相应的F2 群体和感病对照掖478,乳熟后期调查每个F2单株发病状况[36]。计算各群体抗、感个体的分离比例,用SAS 8.2软件(SAS Institute,Raleigh,NC,USA)计算分离比例的χ2值和概率值,进行分离比例的适合性测验。
2 结果与分析
2.1 引进材料对禾谷镰孢茎腐病抗性评价
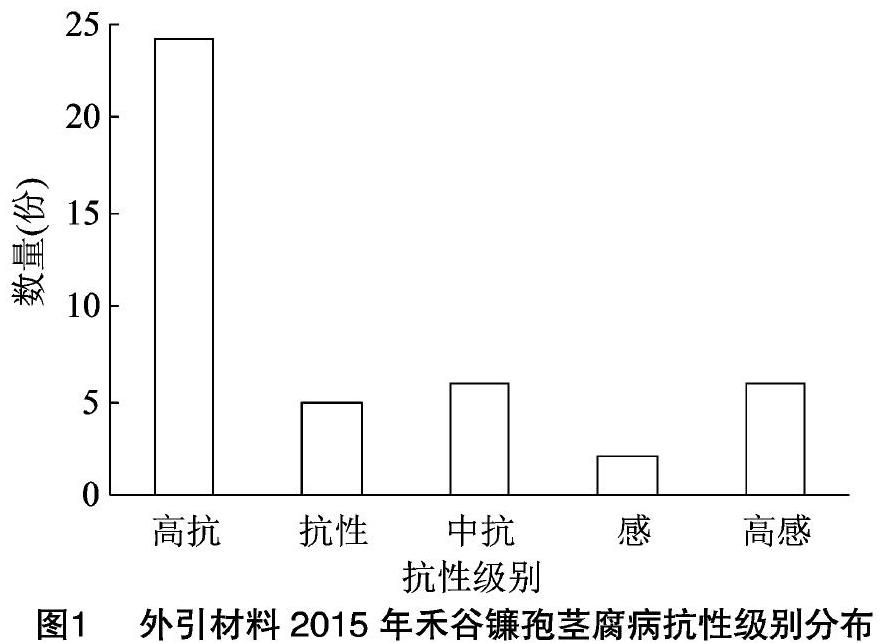
2015年利用根埋法对43份玉米资源进行抗禾谷镰孢茎腐病人工接种鉴定,抗病鉴定对照齐319发病株率为3.3%,掖478发病株率为86.7%,抗感对照抗病性差异显著,能够有效区分待鉴定材料的真实抗性,表明人工接种鉴定結果有效。2015年,在43份鉴定材料中,共筛选出24份高抗种质,占鉴定材料总数的55.8%;抗性材料5份,分别为自交系A05、A07、A16、F04和R04,占鉴定材料总数的11.6%;中抗材料6份,分别为自交系A03、A12、A21、A27、F01和R02,占鉴定材料总数的14.0%;抗病种质占比为81.4%。筛选出感病材料8份,占鉴定材料的18.6%,其中A06和A15对禾谷镰孢茎腐病表现为感病,A10、A13、A17、A22、A26和A29共6份材料高感禾谷镰孢茎腐病,而A10的发病株率达到了100%,A17(52.9%)、A26(65.0%)和A29(63.6%)的发病株率均超过了50%(图1)。
从上述鉴定结果可以看出,引进的43份国外资源,在禾谷镰孢茎腐病抗性方面具有广泛变异,高抗材料发病率为0,而高感材料发病率则达100%,其中的抗性材料对丰富我国玉米抗禾谷镰孢茎腐病种质资源、拓宽其遗传基础具有重要利用价值。
2.2 外引材料抗玉米禾谷镰孢茎腐病重复鉴定
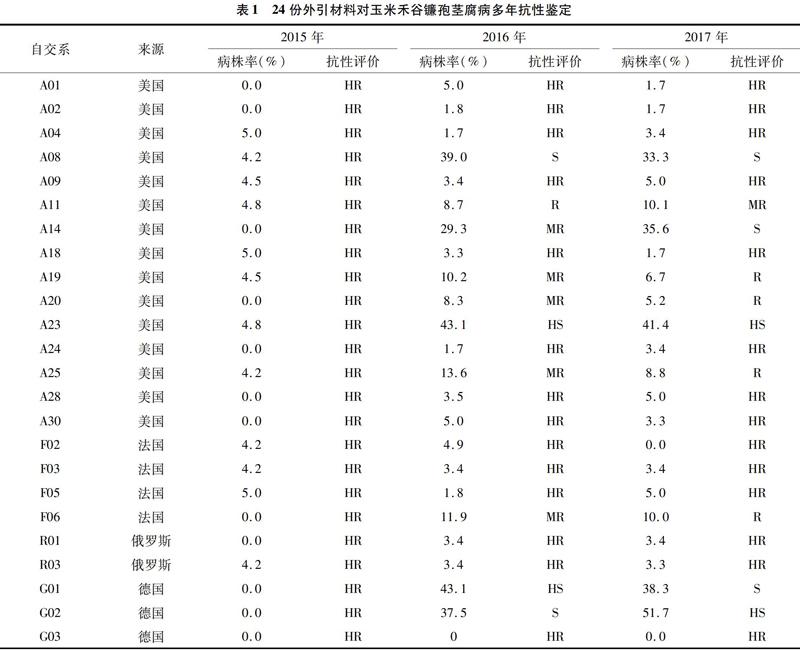
2016年和2017年对24份高抗禾谷镰孢茎腐病材料又进行了连续2年的重复鉴定,感病对照掖478发病株率分别为90%和88.1%,抗病对照齐319发病株率分别为3.3%和1.7%,抗感对照充分发病,人工接种鉴定有效。结果发现,A01、A02、A04、A09、A18、A24、A28、A30、F02、F03、F05、R01、R03和G03共14份材料年际间禾谷镰孢茎腐病抗性表现稳定,反映了其真实抗病性,具体鉴定结果如表1所示。这些材料可作为重要的抗茎腐病资源,用于改善我国玉米抗禾谷镰孢茎腐病种质遗传基础狭窄的现状。
2.3 高抗禾谷镰孢茎腐病材料抗性遗传初步分析
14份供试自交系对禾谷镰孢菌的反应型均表现为高抗,而感病亲本掖478则为高感。根据各供试材料与掖478配制的杂种 F2 植株对禾谷镰孢菌的反应型,掖478/A01、掖478/A04、掖478/A18、掖478/A24、掖478/A28、掖478/F02、掖478/F03、掖478/F05、掖478/R01、掖478/G03这些 F2 群体抗病、感病植株比例都符合3 ∶ 1的分离比,而掖478/A02、掖478/A09、掖478/A30、掖478/R03的F2群体抗病、感病植株比例不符合3 ∶ 1的分离比(表2),说明A01、A04、A18、A24、A28、F02、F03、F05、R01和G03对禾谷镰孢菌的抗性可能受1对显性单基因或少数主效基因控制。
3 讨论与结论
玉米青枯病人工接种方法主要有4种,即牙签法[37]、注射法[38]、打孔法[39]和根埋法[39-40],根埋法符合玉米茎腐病发生发展规律,鉴定结果较为准确和客观,能反映待鉴定材料的真实抗性水平[41]。但玉米茎腐病属于系统侵染性病害,前期侵染,后期显症,发病易受到环境条件的影响,因此该病害的人工接种鉴定应多年重复鉴定才能得到材料的真实抗性。
连续3年人工接种鉴定,筛选到A01、A02、A04、A09、A18、A24、A28、A30、F02、F03、F05、R01、R03和G03共14份高抗禾谷镰孢茎腐病材料,这些材料年际间抗性表现稳定。自交系A04株型清秀,其最大特点是后期脱水快,适宜直收,且年际间抗性稳定,3年平均病株率3.4%;F02和F05轴细粒深,其最大特点是株高矮,穗位较低,抗倒伏能力强,3年平均病株率分别为3%和3.9%;R01的3年平均发病株率为2.3%,抗低温能力较强。以病情级别为唯一标准,对A04、F02、F05和R01进行抗性遗传分析,结果表明,A04、F02、F05和R01对禾谷镰孢茎腐病的抗性受1对显性单基因控制(表2)。对A04、F02、F05和R01进行抗大斑病鉴定和抗性遗传分析表明,A04、F02、F05和R01高抗大斑病且抗性也受1对显性单基因控制[43]。A24具有配合力高、耐密植等优点,3年平均发病株率为1.7%,抗性稳定,对禾谷镰孢菌的抗性受1对显性基因控制,同时兼抗大斑病[42]。G03属于硬粒型材料,秆韧性好,抗倒性极强,3年人工接种鉴定平均发病株率为0,抗性非常稳定。人工接种鉴定,F2群体抗感分离比为3 ∶ 1,其对禾谷镰孢菌的抗性受1对显性单基因控制。G03可作为抗病抗倒的基础材料。掖478/A01、掖478/A18、掖478/A28和掖478/F03 F2群体抗、感植株比例均符合3 ∶ 1的分离比,A01、A18、A28和F03对禾谷镰孢菌的抗性均受1对显性单基因控制控制。对A01、A04、A18、A24、A28、F02、F03、F05、R01和G03携带的抗病基因精细定位,开发与抗病基因紧密连锁的分子标记,利用辅助选择及回交转育等手段,提高我国当前玉米生产上常用种质抗病性的同时,也可改善目标材料的抗倒性、脱水性、耐冷性,对于培育高产广适品种和资源创制具有重要指导意义。
A02、A09和A30叶片上冲,株型紧凑,具有耐密植、配合力高等优点,高抗禾谷镰孢茎腐病且抗性稳定,2015—2017年际间发病株率分别为0、1.8%、1.7%,4.5%、3.4%、5.0%和0、5.0%、3.3%;R03是极早熟材料,高抗禾谷镰孢茎腐病且抗性稳定,2015—2017年际间发病株率分别为4.2%、3.4%和3.3%(表1)。以病情级别为指标,掖478/A02、掖478/A09、掖478/A30和掖478/R03的F2群体抗病、感病植株比例既不完全符合3 ∶ 1的分离比,也不符合15 ∶ 1的分离比例(表2)。如果综合考虑病情级别、茎基部颜色变褐深度、茎基部软化程度,A02、A09、A30和R03对玉米禾谷镰孢茎腐病的抗性很有可能受数量性状控制,其抗性遗传规律有待做进一步的深入研究,以期发掘具有持久抗性且耐密、早熟的玉米优异资源。
连续3年通过人工接种对43份外引玉米资源进行禾谷镰孢茎腐病抗性鉴定,筛选到抗玉米茎腐病自交系35份。利用F2群体对14份高抗禾谷镰孢茎腐病材料进行抗性遗传初步分析,结果表明,自交系A01、A04、A18、A24、A28、F02、F03、F05、R01和G03对禾谷镰孢茎腐病的抗性受1对显性基因控制,对这些材料携带的抗病基因做进一步的精细定位、克隆和功能验证,将对我国玉米抗禾谷镰孢茎腐病资源创制及抗病品种培育具有重要的应用价值。
参考文献:
[1]吕国忠,陈捷,刘伟成,等. 玉米茎腐病的病原菌与品种抗性[J]. 玉米科学,1995(3):47-51.
[2]王 波,汪光臨,张倩倩,等. 玉米新组合对茎腐病抗性及产量损失研究[J]. 安徽科技学院学报,2013,27(3):15-19.
[3]梅丽艳.玉米青枯病病原菌研究现状[J]. 黑龙江农业科学,2003(5):35-37.
[4]马传禹,姚丽姗,杜腓利,等. 玉米抗茎腐病研究进展[J]. 玉米科学,2018,26(2):131-137.
[5]夏锦洪,方中达. 玉米细菌性茎腐病病原菌研究[J]. 植物保护学报,1962,1(1):1-14.
[6]吴全安,梁克恭,朱小阳,等. 北京和浙江地区玉米青枯病病原菌的分离与鉴定[J]. 中国农业科学,1989,22(5):71-75.
[7]王晓鸣,吴全安,刘晓娟,等. 寄生玉米的6种腐霉及其致病性研究[J]. 植物病理学报,1994,24(4):343-346.
[8]白金铠,尹 志,胡吉成. 东北玉米茎腐病病原的研究[J]. 植物保护学报,1988,15(2):93-98.
[9]何 婧,王晓鸣. 玉米茎腐病病原菌的分离与鉴定[C]//中国植物病理学会学术年会,2009.
[10]陈 楠,潘晓静,姚 远,等. 东北地区玉米茎腐病镰孢菌EF-1α基因序列分析鉴定[J]. 玉米科学,2015,23(4):143-148.
[11]王振跃,施 艳,李洪连.不同营养元素与玉米青枯病发病的相关性研究[J]. 植物病理学报,2013,43(2):192-195.
[12]梁国忠. 嫩江县玉米青枯病的发生规律及防治技术[J]. 种子世界,2013(1):38-39.
[13]杨海龙,付 俊,张丽丽,等. 辽宁省鲜食玉米试验品种抗病性分析[J]. 农业科技通讯,2014(2):66-69.
[14]付家锋,闫海霞,赵月强,等. 漯河市玉米茎腐病的发生与综合防治技术[J]. 农业科技通讯,2014(5):152-154.
[15]张 洁. 滨州市玉米青枯病的发生与防治[J]. 现代农业科技,2016(6):144,146.
[16]谢丽华,陈明丽,冯 涛,等. 2014年黑龙江省玉米茎基腐病发生因素调研[J]. 现代化农业,2015(6):68-69.
[17]谢丽华,高 虹,陈明丽,等. 玉米茎基腐病对产量及构成因素的影响[J]. 现代化农业,2016(12):5-6.
[18]王振营,王晓鸣. 我国玉米病虫害发生现状、趋势与防控对策[J]. 植物保护,2019,45(1):1-11.
[19]宋燕春,裴二芹,石云素,等. 玉米重要自交系的肿囊腐霉茎腐病抗性鉴定与评价[J]. 植物遗传资源学报,2012,13(5):798-802.
[20]段灿星,朱振东,武小菲,等. 玉米种质资源对六种重要病虫害的抗性鉴定与评价[J]. 植物遗传资源学报,2012,13(2):169-174.
[21]段灿星,王晓鸣,武小菲,等. 玉米种质和新品种对腐霉茎腐病和镰孢穗腐病的抗性分析[J]. 植物遗传资源学报,2015,16(5):947-954.
[22]杨 洋,陈国康,郭 成,等. 玉米种质资源抗腐霉茎腐病鉴定[J]. 作物学报,2018,44(8):1256-1260.
[23]Afolabi C G,Ojiambo P S,Ekpo E,et al. Novel sources of resistance to fusarium stalk rot of maize in tropical Africa[J]. Plant Disease,2008,92(5):772-780.
[24]岳 辉,陈晓旭,王作英,等. 辽宁省抗玉米茎腐病骨干自交系的筛选与评价[J]. 农业科技通讯,2018(10):142-144.
[25]施 艳,燕照玲,王 珂,等. 河南省夏玉米品种对6种主要病害的抗性评价[J]. 河南农业科学,2019,48(6):95-98,105.
[26]曹如槐,王富荣,王晓玲,等. 玉米对青枯病抗性遗传规律的研究[J]. 遗传,1996,18(2):4-6.
[27]杨典洱,陈绍江,王岳光,等. 玉米抗青枯病基因的遗传分析[J]. 植物病理学报,2001,31(4):315-318.
[28]Yang D,Jin D M,Wang B,et al. Characterization and mapping of Rpi1,a gene that confers dominant resistance to stalk rot in maize[J]. Molecular Genetics and Genomics,2005,274(3):229-234.
[29]宋鳳景. 玉米对腐霉茎腐病抗病性研究[D]. 北京:中国农业科学院,2015:18-39.
[30]陈永欣. 玉米对茎腐病的抗性遗传研究[J]. 植物保护学报,1996,23(6):93-94.
[31]Pè M E,Gianfranceschi L,Taramino G,et al. Mapping quantitative trait loci (QTLs) for resistance to Gibberella zeae infection in maize[J]. Molecular & General Genetics,1993,241(1/2):11-16.
[32]陈绍江,宋同明. 玉米青枯病抗病性:一对基因控制的简单遗传[J]. 中国农业大学学报,1999,4(1):56.
[33]Yang Q,Yin G,Guo Y,et al. A major QTL for resistance to Gibberella stalk rot in maize[J]. Theoretical and Applied Genetics,2010,121(4):673-687.
[34]丰 光,王孝杰,吕春波,等. 玉米组合M9916×D472抗镰孢茎腐病的六世代联合数量遗传研究[J]. 玉米科学,2018,26(3):50-55.
[35]郭 成. 甘肃玉米镰孢菌茎腐病病原菌多样性及抗性基因挖掘[D]. 兰州:甘肃农业大学,2019:68-78.
[36]王晓鸣. 玉米病虫害田间手册[M]. 北京:中国农业科技出版社,2002:244-267.
[37]Young H J. The toothpic method of inoculating corn for ear and stalk rots[J]. Phytopathology,1949(33):16.
[38]Hooker A L. Association of resistance to several seeding root stalk and ear disease in corn[J]. Phytopathology,1956(46):379-384.
[39]宋佐衡,陈 捷,刘伟成,等. 关于玉米茎腐病接种方法的探讨[J]. 辽宁农业科学,1992(1):21-24.
[40]徐作珽,张传模,张柏松,等. 玉米对茎基腐病苗期抗病性的鉴定[J]. 植物病理学报,1988(4):224.
[41]刘春来. 中国玉米茎腐病研究进展[J]. 中国农学通报,2017,33(30):130-134.
[42]肖明纲,宋凤景,孙 兵,等. 玉米大斑病广谱抗性外引自交系的发掘与抗病基因初步鉴定[J]. 作物学报,2018,44(4):614-619. 王晓娥,王国军,郝兴顺,等. 稻秸还田与芽前除草剂投入对秦巴地区油菜田冬前杂草群落的影响[J]. 江苏农业科学,2020,48(21):128-132.
