左心室辅助装置抗栓治疗研究进展
2020-03-05雷白综述胡盛寿审校
雷白综述,胡盛寿审校
左心室辅助装置(LVAD)已成为目前终末期心力衰竭患者的重要治疗策略(表1)。在美国,目前接近30%的心脏移植患者植入LVAD[1];2018 年,我国食品与药品监督管理局批准国产LVAD 开展临床试验。但LVAD 植入后导致严重的出血和血栓事件发生率在成人患者中高达30%,在儿童患者中更高达50%,同时LVAD 植入后血栓和栓塞导致的脑卒中等不良事件也会严重影响患者的远期预后。

表1 左心室辅助装置的发展史
1 左心室辅助装置对凝血系统的影响
LVAD 对凝血系统的影响最早开始于植入后1~2 周,凝血因子包括因子Ⅺ、Ⅻ以及前激肽释放酶和纤维蛋白呈持续丢失状态[2];促凝物质如凝血酶原片段1.2、D-二聚体[3]、凝血酶-抗凝血酶、血浆酶和抗血浆酶混合物提示处于血栓形成和纤溶系统激活状态[4];这种状态持续6~12 个月后逐渐降至正常水平。有研究显示,与未植入LVAD 的患者相比,植入LVAD 者的内皮细胞呈激活状态,表现为循环中持续增多的组织因子、E-选择素以及循环内皮细胞的胞内黏附因子水平显著升高[5]。
对于LVAD植入是否诱发血小板激活尚存争议。由血小板激活的血浆标志物包括可溶的P-选择素和CD40 配合基。近期植入LVAD 的患者血小板表面表达P-选择素[6]。在植入LVAD 的患者中,通过凝血酶原酶测定检测到持续增多的血小板聚集和血栓激活[7]。
由于血管性假血友病因子的丢失,几乎所有植入LVAD 的患者都会出现血管性血友病症状。随着血管性血友病肽水平增高,血管性血友病蛋白同样高表达,但在装置撤除后就会缓解[8]。
2 左心室辅助装置的临床试验结果
随着外科植入技术和术后管理团队整体水平的提高,植入LVAD 的患者生存率显著提升,但是出血和血栓事件仍对患者造成较大的威胁(表2)。术后30 d 内出血导致二次手术仍然很常见,而血栓事件会导致一系列的不良事件,包括缺血性脑卒中、短暂性脑缺血发作(TIA)、动脉栓塞或LVAD 机械故障,其中缺血性脑卒中的发生率为7%~8%,动脉栓塞发生率为4%~7%。目前能够提示LVAD 血栓形成的临床标志是溶血和功耗增加。临床上,大约2%的患者被证实存在装置内血栓,但最新报告显示,HeartMate Ⅱ系统(Thoratec,美国)植入术后24 个月血栓形成的发生率高达12%[9],这一事件直接导致了HeartMate Ⅲ(Thoratec,美国)的研发。最近磁悬浮技术应用于机械循环辅助的多中心临床研究——MOMENTUM 3 研究结果显示,与HeartMate Ⅱ相比,HeartMate Ⅲ显著降低植入2 年后进展期心力衰竭患者的再次手术和脑卒中发生风险,显然无轴承的设计更能降低装置内血栓形成的发生率[10]。

表2 美国左心室辅助装置的临床试验结果
与成人相比,LVAD 应用于儿童和青少年时出血和血栓之间的平衡更难控制。目前,通过FDA认证、可用于儿童的LVAD 是Berlin Heart EXCOR(Berlin Heart,德国)[8]。最早关于Berlin Heart EXCOR 的前瞻性研究纳入了48 例等待心脏移植的患儿。有学者指出,体外膜肺氧合(ECMO)联合主动脉内球囊反搏可显著降低重症患者的死亡率[11],但是其辅助措施较多,术后并发症以及撤机时间难以把握,所以与ECMO 相比,LVAD 辅助的心脏移植患儿术后生存率明显高于ECMO 辅助的心脏移植患儿(96% vs 67%~75%),LVAD 在术后30 d 内心功能恢复方面表现更佳。而来自Berlin Heart EXCOR数据库的一项分析显示,204 例儿童患者LVAD 植入术后12 个月生存率达75%,缺血性脑卒中是导致死亡的首要原因,其次是呼吸衰竭和出血性脑卒中[12]。
3 植入左心室辅助装置的早期抗栓治疗策略
尽管国际心肺移植协会于2013 年完善了循环辅助的抗凝推荐策略,但是由于患者因素、LVAD血栓风险以及医疗机构的差异,成人患者中抗凝方案和抗凝强度差异很大。目前,国际心肺移植协会对机械循环辅助的抗栓策略有明确推荐。
3.1 围术期抗栓策略
有血栓、心房颤动、缺血性心脏病病史的患者在植入LVAD 前,通常要接受抗凝和抗血小板治疗。在心脏移植的过渡治疗研究中,LVAD 植入前50%~60%的患者接受肝素抗凝,30%的患者接受阿司匹林。此外心力衰竭继发的肝肾功能异常会进一步恶化受损的凝血系统。在LVAD 植入后,30%的患者存在正性肌力药物依赖,36%的患者呈逐渐恶化状态,14%的患者仍处于心原性休克状态[13]。植入LVAD 时需要正中开胸、体外循环,制作腹腔囊袋。由于上述外科手术的额外创伤以及术前存在的凝血功能异常,出血成为LVAD 植入围术期最常见的并发症,与之相对应的抗栓方案也需要及时调整。
3.2 术后短期抗凝策略
体外循环结束后,通常采用鱼精蛋白中和肝素,使活化凝血时间降至正常范围,监测血栓弹力图可以更加敏感地发现肝素残留[8]。阿司匹林通常在术后24~72 h 开始应用。肝素的抗凝推荐从术后第一天开始,最终目标是使活化部分凝血活酶时间延长[14]。胸管拔除之后开始口服华法林。尽管推荐肝素作为华法林的过渡治疗,但是29%植入HeartMate Ⅱ的患者并没有应用肝素。应用或未应用肝素的患者术后3 d 内血栓和出血事件的发生率无显著差异;而未应用治疗量肝素者的输血比例较应用治疗量肝素的患者显著下降(16% vs 32%),但两类患者中需要手术解决的严重出血事件发生率无明显差异[15]。
4 植入左心室辅助装置的长期抗凝策略
长期以来,以华法林为代表的维生素K 拮抗剂是LVAD 患者长期抗凝的标准治疗方案[14]。目前各研究中维生素K 拮抗剂抗凝治疗的目标值存在很大差异,但是指南建议的国际标准化比值(INR)一般应维持在2.0~3.0。两个单中心研究由于报道了较高的出血风险,使得INR 降至2.0 以下,然而另一家中心因为血栓事件,INR 升至1.5~2.5[16],最近部分中心报道INR 处于2.5~3.5[17]。部分学者提议用HAS-BLED 评分系统评价华法林的抗凝效果,2017年Acharya 等[18]提出HAS-BLED 评分≥3 分提示对华法林不敏感。临床试验允许不同医疗机构基于其具体情况,实行不同的抗凝强度,造成了目前临床中抗凝强度各异的现状。
同时,在植入LVAD 的患者中,抗凝治疗的管理也存在新的挑战。在长期接受华法林治疗的LVAD 植入术后患者中,在无其他医疗干预的情况下54%的患者华法林剂量需要随时调整,平均每周剂量不同者的比例占22%(8%~44%),而其中大部分患者需要减少剂量[19]。此外,在华法林抗凝治疗过程中,个体差异同样不可忽视。研究显示,植入LVAD 的患者常规只需31%~51%的时间即可达到治疗窗内时间,抗凝时间较接受华法林治疗的总体人群显著减少。
5 植入左心室辅助装置的抗血小板治疗
在植入LVAD 的患者中,针对是否应用抗血小板治疗以及采用何种治疗强度,各家医学中心的观点仍不一致。有单中心研究显示,全组23 例植入HeartMate Ⅱ系统的患者未接受抗血小板治疗,其中仅2 例(0.059/人年)发生缺血性脑卒中,未发生其他血栓事件[19]。2015 年4 月在欧洲开展的一项队列研究评估了植入HeartMate Ⅱ的患者中低剂量的抗凝和抗血小板治疗的结果:大部分试验和医疗机构报道阿司匹林剂量为81~325 mg,符合专家推荐的阿司匹林抗血小板治疗剂量[13]。一项关于HeartWare HAVD(HeartWare,美国)的连续随访研究显示,脑卒中发生率为0.089/人年,随着阿司匹林剂量从81 mg 增加到325 mg,脑卒中发生率降至0.047/人年,并且更换LVAD 的血栓风险也降低了55%。
6 儿童左心室辅助装置植入术后的抗栓治疗
埃德蒙顿方案是目前较为公认的儿童LVAD 植入术后抗栓治疗方案(表3),在此方案中血栓弹力图被常规用来校正抗血小板疗效[20]。普通肝素在术后24~48 h 开始应用,剂量滴定为抗Ⅹa 水平为0.35~0.5 U/ml。术后早期开始监测血栓弹力图,此后每24 h 检测一次。抗Ⅹa 目标调整为获得Kaolin R时间为8~15 min(Kaolin R 时间指开始检测至第一块纤维蛋白凝块达到2 mm 振幅所用的时间,平均5~10 min,R 值延长表示低凝,R 值缩短表示高凝)。如果患者临床状态稳定且满足标准的实验室参数,那么术后48 h 潘生丁起始剂量为4 mg/(kg·d)。花生四烯酸抑制率<70 %时开始应用阿司匹林,阿司匹林起始剂量1 mg/(kg·d);一旦稳定下来,抗凝治疗则由普通肝素转变为依诺肝素(3 个月内,1.5 mg/kg,1 次/12 h;3 个月后,1 mg/kg,1 次/12 h),使抗Ⅹa 水平介于0.6~1.0 U/ml。1 岁以上儿童推荐长期使用华法林,起始剂量0.2 mg/(kg·d),维持INR 在2.7~3.5[21]。据报道,仅小部分患者治疗窗内时间缩小至71%~82%。
7 植入左心室辅助装置后抗凝并发症的处理
7.1 出血
本团队开展的临床研究发现,出血事件可以定义为早期出血事件和延迟出血事件,早期出血事件即LVAD 植入术后30 d 内出现的非医疗因素干预下需要二次手术或者胸管引流增多造成的不良事件,以胃肠道出血和血管性血友病症状多见;延迟出血事件即LVAD 植入术后6 个月内由于抗凝策略异常、患者本身因素以及仪器故障等因素引起的颅内出血、心脑血管异常事件、出血性脑卒中等严重血液系统并发症。以下几项监测指标具有重要提示作用:患者术后乳酸脱氢酶(LDH)> 500 IU/L 并持续增高无下降趋势,高度提示存在出血事件;术后需要持续输注超过4 个单位浓缩红细胞、并且血红蛋白不能维持在稳定水平;血液检查明确缺少血友病高分子量多聚合体;其他由于容量不足导致循环不稳定的因素。
由于出血导致的贫血可以考虑输注浓缩红细胞,但须权衡心脏移植供体带来同种免疫排斥的风险[22]。全球范围内的移植医学都面临胃肠道出血这一大难题,往往移植之后能够得到解决[23]。对于较严重的胃肠道出血,推荐内镜下评估和控制出血[24]。研究显示,一组7 例植入LVAD 伴有慢性胃肠道出血的患者应用奥曲肽可以缩短住院时间[24]。对于顽固性胃肠道出血,可以考虑采用综合处理策略包括外科手术、LVAD 速度调节、加强血管性血友病治疗以及提高心脏移植等级等手段[25]。另外,男性和老年患者是胃肠道出血的高危因素[26]。右心功能障碍和植入LVAD 术后左心室射血分数> 30%会导致胃肠道出血发生率升高。Wilson 等[27]开展的一项有关LVAD 植入术后颅内出血的回顾性研究显示:重新开始使用华法林平均10.5 d 和阿司匹林6 d 后未发生血栓事件,但该研究未提及何时启用肝素。
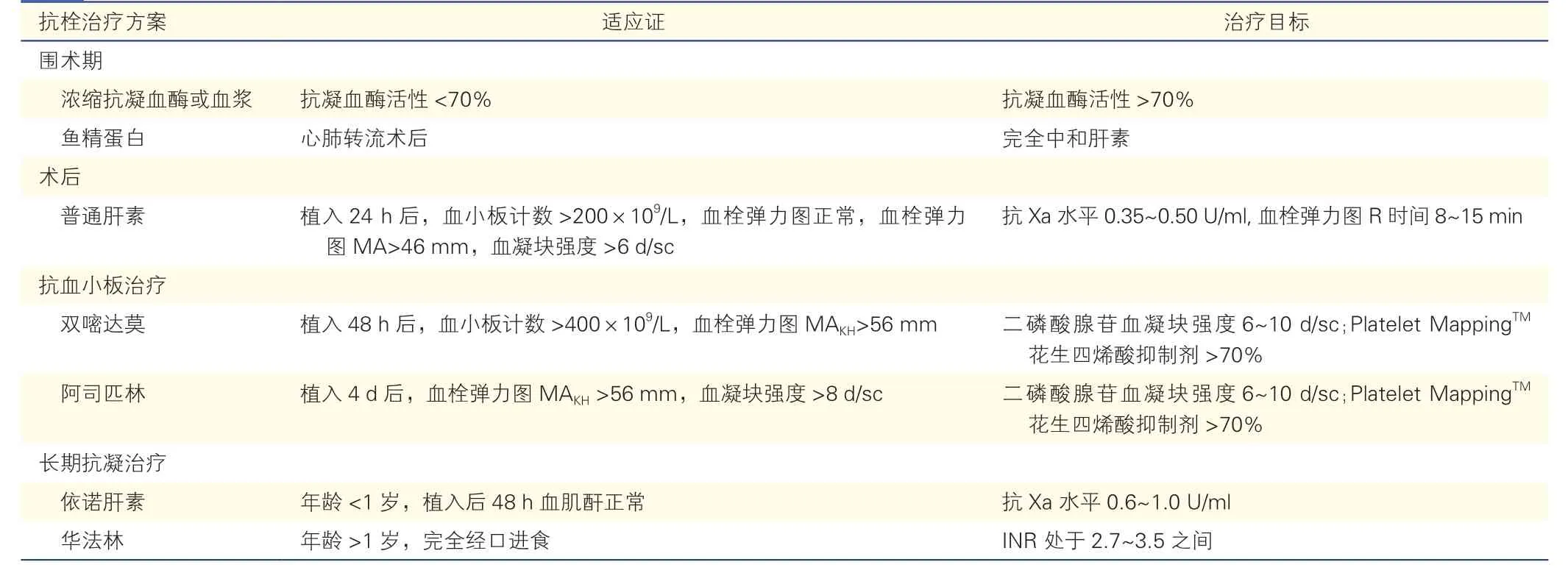
表3 儿童左心室辅助装置植入术后的抗栓治疗方案(埃德蒙顿方案)
7.2 血栓
据报道,HeartMate Ⅱ植入术后3~6 个月血栓发生率分别为2.9%和4.8%[28]。一般而言,LVAD术后血栓可以由一系列溶血相关实验室指标和装置流量以及能源异常等综合判断。LVAD 的流入道和流出道梗阻以及异位需要外科纠正,当患者血浆LDH>1 000 IU/L 时需要更换装置。术后装置血栓形成时可以考虑溶栓治疗,也可以采用静脉途径抗凝方案(普通肝素或凝血酶抑制剂),还可以选择静脉抗血小板治疗方案(如依替巴肽)。
我中心在国内率先开展LVAD 临床试验,主要采用术前低分子肝素抗凝、围术期肝素抗凝、继而华法林联合阿司匹林策略,累计完成16 例患者。术后出血1 例,发生率6.25%,通过外科止血纠正;术后平均随访7 月,出血或血栓发生率为0,主要为轻微出血事件,通过调整抗凝强度可解决。
目前有学者回顾对比了HeartMate Ⅱ系统植入后的血栓发生情况,发现植入后装置内血栓总共可分为三种类型:急性突发血栓、亚急性血栓以及无症状性溶血。对于各类装置内血栓来说,从植入术后到发现确定的装置内血栓的间隔时间是不同的,突发血栓无症状的时间很短,平均只有27.5 d,而无症状溶血则高达257 d;出现血栓的患者血液中LDH 平均水平是未出现装置内血栓患者的2.5 倍;在第一次溶血至第一次发现症状以及第一次发现症状至首先确定装置内血栓这两个时间节点,突发血栓患者的LDH 水平显著高于其他两类血栓患者。
8 小结
LVAD 显著提高了终末期心力衰竭患者的生存率,与此同时,LVAD 的植入也带来出血和血栓形成两大并发症,其中胃肠道出血的病理生理学和血栓启动是该领域长期悬而未决的问题。尽管目前抗凝治疗被常规用于预防LVAD 植入术后脑卒中和装置内血栓,相对于其他需要抗栓治疗的患者,植入LVAD 的患者在治疗策略上存在更多变数。埃德蒙顿方案在植入LVAD 的儿童患者中的成功应用,为解决成人患者的抗栓治疗方案提供了良好的经验,尤其以HAS-BLED 评分为代表的科学评估系统的应用,将会为未来植入LVAD 的患者的最佳个体化抗栓治疗方案的建立提供重要依据。
利益冲突:所有作者均声明不存在利益冲突
