类球红细菌XR12的分离、鉴定及其解毒效果研究
2020-03-04曹海鹏张书萌虞晶晶
曹海鹏 张书萌 虞晶晶 安 健
(1. 上海海洋大学,国家水生动物病原库, 上海 201306; 2. 上海海洋大学上海水产养殖工程技术研究中心, 上海 201306; 3. 上海海洋大学水产动物遗传育种中心上海市协同创新中心, 上海 201306; 4. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306; 5. 连云港市海洋与渔业发展促进中心, 连云港 222000)
敌百虫, 又名马佐藤, 属于水产养殖常用的有机磷驱杀虫剂, 主要通过抑制寄生虫乙酰胆碱酯酶而使乙酰胆碱在突触处积累, 引起寄生虫的神经功能紊乱而死亡[1]。近年来, 随着养殖规模的扩大和鱼类寄生虫病防控需求的增强, 敌百虫的用药量逐渐增加, 被广泛用于体外寄生吸虫、肠内寄生蠕虫以及甲壳动物引起的鱼类寄生虫病的防治[2]。然而,据研究报道[3—5], 养殖水体中的敌百虫会通过呼吸、摄食进入水产动物体内对机体产生副作用, 轻者会影响水产动物的免疫因子活性, 重者会直接导致水产动物急性中毒。因此, 敌百虫的长期大量使用对环境造成的污染不容忽视[6], 养殖水体中敌百虫的解毒研究对水产养殖健康生产和水体环境保护具有重要的意义。目前, 敌百虫的生物降解法以
其环保、高效、成本低廉等优点深受研究者的青睐[7,8]。许多研究表明[6,8,9], 假单胞菌(Pseudomonassp.)、节杆菌(Arthrobactersp.)、青霉菌(Penicilliumsp.)、利氏链霉菌(Streptomyces levis)、鞘氨醇杆菌(Sphingobiumsp.)、特基拉芽孢杆菌(Bacillus tequilensis)、聚多曲霉(Aspergillus sydowii)等微生物对敌百虫均展现出了良好的降解效果, 对环境中敌百虫的解毒和污染治理具有潜在的应用价值, 但有关类球红细菌(Rhodobacter sphaeroides)对敌百虫的解毒研究却鲜有报道。鉴此, 本实验从养殖污泥中分离筛选了一株敌百虫耐受菌(XR12), 综合生理生化特性和16S rRNA系统发育分析对其进行了鉴定,并分析了其药敏特性、安全性以及对敌百虫的解毒效果, 旨在丰富敌百虫污染治理的微生物资源。
1 材料与方法
1.1 实验材料
养殖污泥, 采集于上海青浦某养殖场; 斑马鱼(Danio rerio), 平均体重0.15 g, 健康无病伤, 购于上海汐灵生物科技有限公司; 标准稀释水, 根据《水质物质对淡水鱼(斑马鱼)急性毒性测定方法》(GB/T 13267—1991)[10]配制; 晶体敌百虫, 有效成分含量为90%, 购于湖北沙隆达股份有限公司; 营养琼脂、营养肉汤, 购于国药集团(上海)化学试剂有限公司; 以上培养基均在121℃灭菌20min, 冰箱保存备用。
1.2 敌百虫耐受菌株的分离、纯化及筛选
参照杜迅等[11]的方法, 将5 g养殖污泥加入到100 mL含敌百虫浓度为1000 mg/L的无菌营养肉汤中混匀, 于25℃摇床培养18h后再于含敌百虫浓度为1000 mg/L的无菌营养琼脂平板上进行划线分离与纯化, 25℃恒温培养24—48h后, 挑取单菌落进一步在含敌百虫浓度2000 mg/L的无菌营养琼脂平板进一步纯化。纯化后的菌株接种于营养琼脂斜面,25℃恒温培养24—48h后4℃冰箱保藏备用。
1.3 敌百虫耐受菌株对敌百虫的耐受性分析
采用陶树兴等[12]推荐的试管二倍稀释法测定敌百虫耐受菌株对敌百虫的耐受性。将1000 mg/mL敌百虫溶液分别加入含有2 mL无菌营养肉汤的试管中至终浓度为30720、15360、7680、3840、1920、960、480、240、120、60、30、15、7.5、3.75、1.88、0.94、0.47、0.24、0.12、0.06和0.03 mg/L, 同时以无菌营养肉汤作为空白对照, 然后分别接种耐敌百虫菌株的菌液至终浓度5.0×105cfu/mL,于25℃恒温培养24h后观察结果, 把无菌生长、稀释度最大的敌百虫的质量浓度作为敌百虫耐受菌株对敌百虫的最大耐受浓度(Maximum tolerance concentration, MTC)。每个处理设3个平行。
1.4 敌百虫耐受菌株的生理生化鉴定
参照黄志勇等[13]的方法, 采用生化微量发酵管对敌百虫耐受菌株进行生理生化鉴定。
1.5 敌百虫耐受菌株16S序列测定及系统发育分析
以敌百虫耐受菌株的基因组DNA为模板, 对其16S rRNA进行PCR扩增, 其中正向引物为27F: 5′-AGAGTTTGATCCTGGCTCAG-3′, 反向引物为1492R: 5′-GGTTACCTTGTTACGACTT-3′[14]。PCR的扩增条件为: 94℃ 3min; 94℃ 1min, 60℃1min, 72℃ 1min, 共35个循环。敌百虫耐受菌株的16S rRNA序列委托上海杰李生物技术有限公司完成, 并将其与GenBank中已知序列进行同源性比对后利用Mega 5.0软件通过邻接法构建系统发育树(Replications=1000, bootstrap值取百分比)。
1.6 敌百虫耐受菌株的耐药性分析
参照KB纸片扩散法[15]测定敌百虫耐受菌株的耐药性, 并根据杭州滨河微生物试剂有限公司提供的《纸片法药敏试验抑菌圈直径判断标准》, 确定敌百虫耐受菌株对抗菌药物的敏感性。
1.7 敌百虫耐受菌株对斑马鱼的安全性分析
试验设6个试验组和1个对照组, 每组健康斑马鱼10尾。试验组斑马鱼分别浸泡在终浓度为104—109cfu/mL敌百虫耐受菌株的标准稀释水中,对照组的标准稀释水中不添加敌百虫耐受菌株。试验周期为8d, 试验期间对鱼体反应能力、游动能力、呼吸能力等指标进行观察, 记录各组斑马鱼的死亡数目, 计算敌百虫耐受菌株对斑马鱼的半数致死浓度(LC50)。每个浓度设3个平行, 试验期间水温控制在24—26℃、DO>4 mg/L、pH 7.2。
1.8 敌百虫耐受菌株对敌百虫的解毒效果分析
参照《水质物质对淡水鱼(斑马鱼)急性毒性测定方法》(GB/T 13267—1991)[10]进行。试验设3个试验组、3个阳性对照组、1个阴性对照组和1个空白对照组, 每组健康斑马鱼20尾, 分别放置于规格为Φ225 mm×180 mm的圆形玻璃水族缸中。试验组在标准稀释水中加入敌百虫耐受菌株至终浓度1.0×106cfu/mL后立即加入终浓度为10、20和30 mg/L敌百虫, 阳性对照组在标准稀释水中仅加入敌百虫至终浓度10、20和30 mg/L, 阴性对照组在标准稀释水中仅加入终浓度为1.0×106cfu/mL的敌百虫耐受菌株, 空白对照组在标准稀释水中不添加任何物质, 然后在试验开始后的24h、48h、72h和96h对鱼体反应能力、游动能力、呼吸能力等指标进行观察, 记录各组斑马鱼的死亡数目, 计算敌百虫在敌百虫耐受菌株添加和不添加时对斑马鱼的LC50。每个处理设3个平行, 试验期间水温控制在24—26℃、DO>4 mg/L、pH 7.2。
1.9 数据处理与分析
所有实验数据采用SPSS11.0软件进行处理分析, 以平均值±偏差表示。
2 结果
2.1 敌百虫耐受菌优良菌株的分离与筛选
从养殖污泥中分离了6株敌百虫耐受菌, 分别暂命名为XR11、XR12、XR13、XR14、XR15和XR16, 通过进一步测定比较其对敌百虫的最大耐受浓度(图1), 最终筛选出了菌株XR12为敌百虫耐受菌的优良菌株, 其对敌百虫的最大耐受浓度达到了7680 mg/L, 分别是菌株XR11、XR13、XR14、XR15和XR16对敌百虫最大耐受浓度的3倍(P<0.05)、2倍(P<0.05)、1.5倍(P<0.05)、2.4倍(P<0.05)和1.2倍(P>0.05)。
2.2 敌百虫耐受菌优良菌株的鉴定
菌株XR12的生理生化鉴定结果(表1)表明, 菌株XR12能利用酒石酸钠、葡萄糖酸钠、柠檬酸钠、琥珀酸钠、苯甲酸钠、谷氨酸钠、精氨酸钠、乙酸钠、延胡索酸钠、乳酸钠、甲酸钠、丙酮酸、丙三醇、甘露醇、乙醇, 不能利用半乳糖醇、硫代硫酸钠, 与已报道[13,16]的类球红细菌的生理生化特性一致。此外, 菌株XR12的16S rRNA序列(登录号: MK156296)与GenBank中类球红细菌菌株的16S rRNA序列有98%—100%的同源性(表2),菌株XR12的系统发育树(图2)进一步表明, 菌株XR12与类球红细菌菌株RSF1 (登录号: KF606891)的亲缘关系最近。综合生理生化特性以及16S rRNA序列分析的结果, 判定菌株XR12为类球红细菌。

图1 分离菌株对敌百虫的最大耐受浓度Fig. 1 The maximum tolerance concentration of isolates against trichlorfon
2.3 敌百虫耐受菌优良菌株的耐药性
菌株XR12对18种抗生素的敏感实验结果表明(表3), 菌株XR12对卡那霉素、罗红霉素、吡哌酸、阿莫西林、氟苯尼考、多黏菌素B、新霉素、庆大霉素、氧氟沙星、恩诺沙星、诺氟沙星、链霉素、四环素、奈替米星等14种抗生素高度敏感,对多西环素中度敏感, 对杆菌肽、萘啶酸、磺胺异噁唑等3种抗生素耐药。
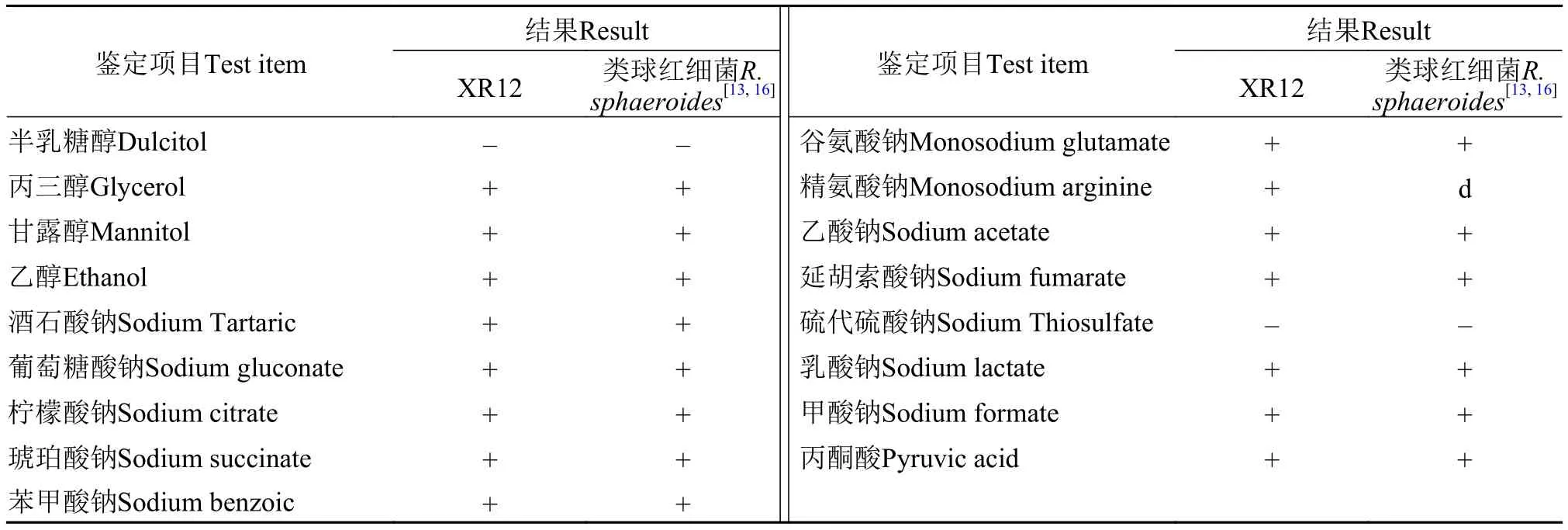
表1 菌株XR12的生理生化特征Tab. 1 Phenotypic characterization of strain XR12
2.4 敌百虫耐受菌株对斑马鱼的安全性
菌株XR12以终浓度为104—109cfu/mL连续浸泡斑马鱼8d, 斑马鱼均未出现鱼体反应迟钝、侧翻、游动和呼吸能力减弱以及死亡等不正常现象,均生长良好, 而且对照组中的斑马鱼也未出现任何不正常现象, 也生长良好, 说明菌株XR12对斑马鱼的LC50大于109cfu/mL。
2.5 敌百虫耐受菌株对敌百虫的解毒效果
表4表明, 空白对照和仅添加菌株XR12的阴性对照组中斑马鱼均未出现鱼体反应迟钝、侧翻、游动和呼吸能力减弱以及死亡等不正常现象, 均生长良好; 未添加菌株XR12的阳性对照组中10—30 mg/L敌百虫导致斑马鱼出现18.3%—58.3%的死亡率,根据概率单位图解法建立的死亡概率(Y)与敌百虫浓度(X)的关系曲线方程:Y=0.0559X+3.543, 敌百虫在未加入XR12时对斑马鱼的96h-LC50为26.06 mg/L; 而添加菌株XR12的试验组中敌百虫在终浓度为20和30 mg/L时分别导致斑马鱼出现13.3%和20.0%的死亡率, 根据概率单位图解法建立的死亡概率(Y)与敌百虫浓度(X)的关系曲线方程:Y=0.0285X+3.304, 敌百虫在加入菌株XR12时对斑马鱼的96h-LC50为59.51 mg/L, 是未添加菌株XR12时敌百虫对斑马鱼的96h-LC50的2.28倍, 说明菌株XR12能够显著降低敌百虫对斑马鱼的毒性, 对敌百虫具有良好的解毒效果。
3 讨论
3.1 类球红细菌的应用价值
类球红细菌是一种光合细菌, 具有广泛的代谢方式, 能够较好地利用低级脂肪酸、氨基酸和糖类等物质, 尤其是在厌氧、好氧、黑暗、光照条件下都能较好地生长[17]。因此, 类球红细菌是一种具有巨大开发潜力的水产益生菌[18]。目前, 类球红细菌作为一种处理农药残留污染的微生物, 已经得到了学术界的广泛认可。例如, 赵凯等[19]从土壤中分离了一株对敌敌畏具有良好降解效果的类球红细菌EBL0706, 其在pH 6.9—7.5、温度20—50℃条件下对400 mg/L敌敌畏的降解率达到了98%以上; 韩庆莉等[17,20]观察了类球红细菌CGMCC0645对敌敌畏暴露中鲫和斑马鱼的保护作用, 实验结果表明在20.0和35.0 mg/L敌敌畏暴露的养鱼水中添加类球红细菌(5×107cfu/mL)能够将鲫的96h死亡率从40.0%和100.0%分别降至0和15%, 在28.3和33.6 mg/L敌敌畏暴露的养鱼水中添加类球红细菌(5×107cfu/mL)能够将斑马鱼的96h死亡率从63.3%和96.7%降至0。这些类球红细菌优良菌株的获得极大地丰富了环境中农药残留生物处理的微生物资源。然而,从现有文献资料来看, 类球红细菌对敌百虫的解毒研究的详细报道却极为匮乏。鉴此, 本实验从养殖污泥中分离筛选了一株优良的敌百虫耐受菌——类球红细菌XR12, 确定了其分类地位, 分析了其药敏特性、安全性与解毒效果, 丰富了敌百虫污染治理的微生物资源。

表2 菌株XR12的16S rRNA序列与GenBank基因库中已知类球红细菌菌株16S rRNA序列同源性的比较Tab. 2 Homology comparison of 16S rRNA sequence of strain XR12 with the other R. sphaeroides strains in GenBank

图2 基于菌株XR12及相关菌株16S rRNA序列的系统发育树Fig. 2 The phylogenetic tree based on 16S rRNA sequences of strain XR12 and other related strains
3.2 类球红细菌的鉴定
目前, 在细菌分类鉴定方法上, 生理生化鉴定和16S rRNA序列分析方法是细菌分类鉴定最常用的有效方法, 但这二种方法依然存在部分缺陷[21]。因此, 细菌分类鉴定必须将16S rRNA序列分析和生理生化鉴定两种方法相结合, 以使鉴定方法更科学,鉴定结果更可靠、更准确。本实验在对菌株XR12进行分类鉴定时, 结合了生理生化特性和16S rRNA序列分析结果, 最终确定菌株XR12为类球红细菌。然而, 菌株XR12与黄志勇等[13]从渔场底泥中分离的类球红细菌菌株AS-32在葡萄糖酸钠利用上的特性有所不同, 而且与GenBank中同源性较高的类球红细菌菌株RSF1之间也存在一定的16S rRNA序列差异性, 这可能与类球红细菌菌株之间的地理差异以及生长环境条件不同有关[22]。
3.3 类球红细菌的安全性
近年来, 益生菌引起人菌血症、内膜炎、肝脓肿等病例的报道[23], 使益生菌潜在的安全性评价成为一个不容忽视的问题。耐药性是益生菌安全性评价内容的之一。为了避免益生菌在养殖环境中的生长受到限制, 所筛选的菌株应该对大部分抗生素敏感[24]。目前, 纸片扩散法是评价益生菌耐药性的常用方法之一。王晓琳等[24]采用纸片扩散法测定了芽孢杆菌益生菌BZ5的耐药性, 发现菌株BZ5对苯唑西林、头孢呋新、卡那霉素表现出耐药性; 窦春萌等[25]采用纸片扩散法分析了一株产消化酶能力强的夹膜红细菌的耐药性, 显示该菌株对青霉素、氨苄西林、卡那霉素、红霉素、麦迪霉素等抗生素耐药。本实验也采用纸片扩散法检测了菌株XR12的药敏特性, 结果表明菌株XR12对83.3%实验选用的抗生素敏感或中度敏感, 因而满足水产养殖用益生菌候选菌株关于药物敏感性的基本要求。此外, 小规模浸泡试验是评价潜在益生菌株对养殖动物安全性的良好方式[26]。王晓琳等[24]通过浸泡试验证实了芽孢杆菌BZ5和溶藻弧菌VZ5在浓度为106cfu/mL时对南美白对虾的安全性。本实验也通过浸泡试验确定了菌株XR12在浓度为109cfu/mL时对模式生物-斑马鱼的安全性。因此, 菌株XR12具备在水产养殖中应用的安全性。
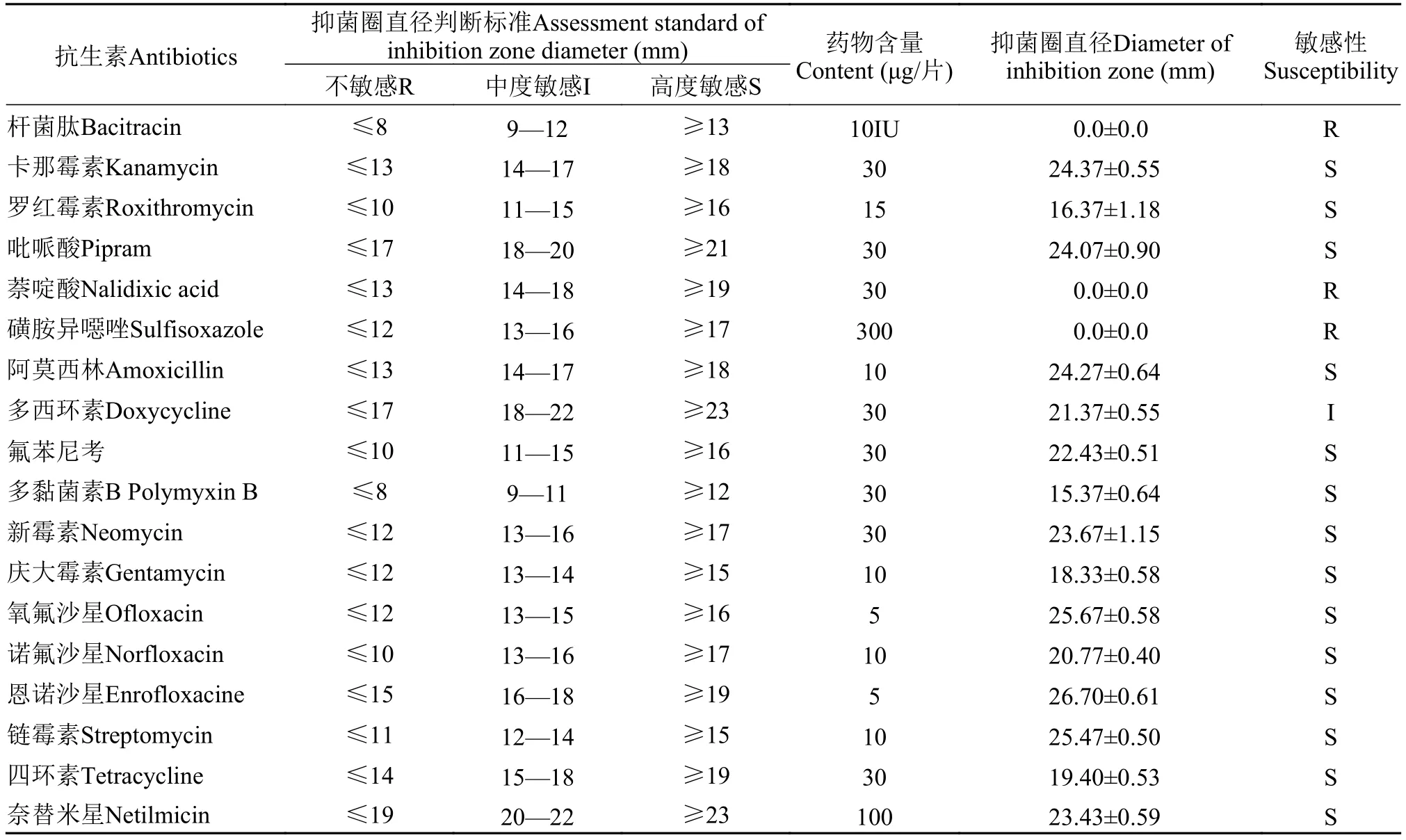
表3 菌株XR12的药敏特性Tab. 3 Antibiotic sensitivity of strain XR12
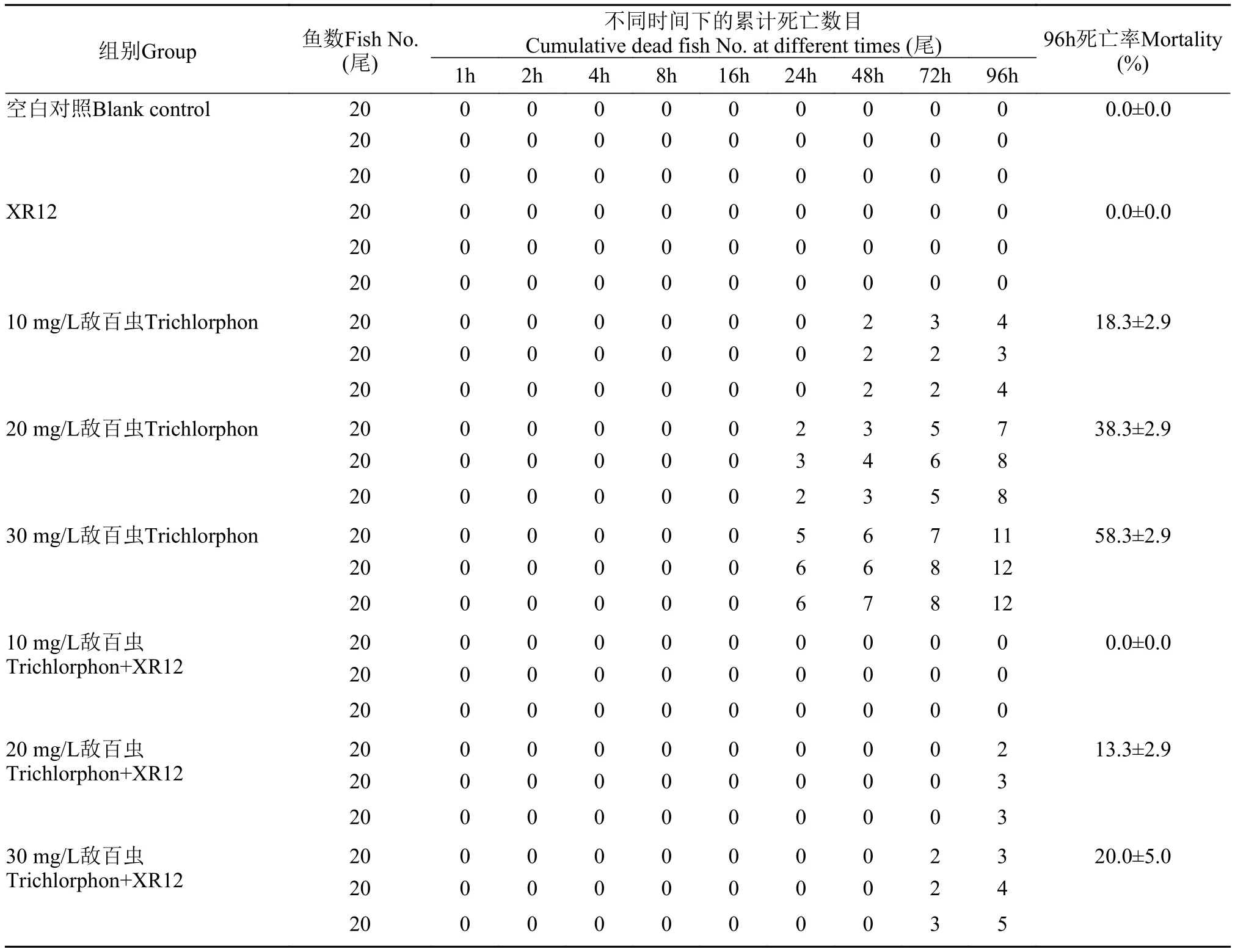
表4 敌百虫在添加和不添加菌株XR12时对斑马鱼的急性毒性Tab. 4 Acute toxicity of trichlorphon to zebra fish under the presence and absence of strain XR12
3.4 类球红细菌对敌百虫的解毒作用
敌百虫为胆碱酯酶抑制剂, 其对鱼类的主要致毒作用是通过机体吸收后与脑突触及肌肉神经接点的胆碱酯酶相结合, 形成不易水解的磷酰化胆碱酯酶, 从而抑制胆碱酯酶的活性, 导致乙酰胆碱在突触内蓄积, 致使神经突触传导中断, 引起神经功能紊乱, 诱发中毒症状[27]。汪鹏鹏等[27]研究发现,敌百虫对斑马鱼的96h-LC50为27.88 mg/L。本实验结果表明, 敌百虫对斑马鱼的96h-LC50为26.06 mg/L, 与汪鹏鹏等[27]的试验结果稍有差异, 可能与斑马鱼的种类、规格不同有关[28], 但根据生态毒理学危害性分级标准[29]: 极高,LC50≤1 mg/L; 高, 1<LC50≤10 mg/L; 中, 10<LC50≤100 mg/L; 低,LC50>100 mg/L, 上述研究均证实敌百虫对斑马鱼的危害等级属于中级, 这与敌百虫能够显著抑制斑马鱼头部乙酰胆碱酯酶活性有关[27]。此外, 敌百虫在酸性水体中可水解生成无毒的去甲基敌百虫, 在碱性水体中可水解为毒性更强的敌敌畏, 后者可进一步水解为对鱼类具有毒害作用的磷酸二甲酯和二氯乙醛[30,31]。本实验发现, 在试验水体pH (pH 7.2)没有变化的情况下, 敌百虫在添加菌株XR12时对斑马鱼的毒性显著降低, 由此推断菌株XR12能够降解水中敌百虫, 并且在解毒过程中没有积累有毒的代谢产物。
