右美托咪啶上调sirtuin3减轻小鼠肾缺血-再灌注损伤
2020-03-04武月玲曲海霞王俊星
武月玲,曲海霞,王俊星
(运城市中心医院/山西医科大学 第八临床医学院 麻醉科, 山西 运城 044000)
缺血-再灌注(ischaemia-reperfusion,I/R)可导致机体多种损伤。右美托咪啶(dexmedetomidine,DEX)可通过增高线粒体膜电位(△ψm),减轻I/R导致的线粒体损伤[1-2]。去乙酰化酶3(sirtuin3,SIRT3)主要位于线粒体,是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖的去乙酰化酶[3],其可通过脱乙酰化线粒体基质中的超氧化物歧化酶(superoxide dismutase 2,SOD2)及亲环素D(cycolphilin D,Cyp D)发挥线粒体保护作用[4-5]。SIRT3过表达可通过恢复线粒体动力学缓解I/R引起的包括急性肾损伤(acute kidney injury,AKI)在内的多种损伤[6-7],表明在I/R中DEX与SIRT3具有重要关系。但DEX是否通过上调SIRT3缓解I/R引起的AKI尚不清楚。本研究观察肾I/R时DEX是否通过上调SIRT3发挥对肾的保护作用。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级雄性C57 BL/6J小鼠50只,8周龄,23.5~26.5 g(山西医科大学实验动物中心,许可证号:SCXK2019-0004)饲养于相对湿度45%~55%、昼夜循环12 h的SPF级动物房,适应性饲养1周后进行实验。
1.1.2 试剂:抗SIRT3及acetylated lysine抗体(Santa Cruz公司);抗Cyt C抗体(Abcam公司);抗Cyp D抗体(Cell Signaling Technology公司);Protein G magnetic beads(Millipore公司);Tunel试剂盒和HE试剂盒(上海碧云天生物科技有限公司);SIRT3活性检测试剂盒(上海钰博生物科技有限公司)。
1.2 方法
1.2.1 慢病毒-SIRT3 siRNA的构建:慢病毒携带的SIRT3 siRNA由上海吉玛公司设计、鉴定并扩增。方法步骤简述,小鼠SIRT3(Gene ID: 64384)siRNA序列(5′-GCGTTGTGAAACCCGACAT-3′),并将其克隆至pCDH-CMV-MCS-EF1α-GFP-puro慢病毒载体中,经酶切及基因测序鉴定,将阳性表达载体共转染至HEK-293T细胞,收集上清液,并进行病毒滴度测定。
1.2.2 小鼠的分组及处理:将小鼠分为假手术(sham)组、siRNA+sham组、肾缺血-再灌注损伤(I/R)组、DEX+I/R组、siRNA+I/R组及siRNA+DEX+I/R组,每组至少6只小鼠。DEX+I/R组腹腔注射DEX(25 μg/kg),siRNA+sham组、siRNA+I/R组、siRNA+DEX+I/R组术前3 d尾静脉注射5×109TU/mL/kg慢病毒-si-SIRT3。
1.2.3 肾功能的检测:用奥林巴斯AU2700自动生化分析仪测定小鼠血清肌酐及血浆尿素浓度。
1.2.4 HE染色法检测肾组织形态学:小鼠肾脏组织常规处理后,再HE染色,显微镜观察。
1.2.5 Tunel染色法检测肾组织凋亡:小鼠肾脏组织经常规处理后,再Tunel染色,显微镜观察。
1.2.6 SIRT3试剂盒检测肾组织SIRT3活性:取小鼠肾脏组织,按SIRT3试剂盒说明书检测肾组织SIRT3活性。
1.2.7 ELISA检测血清胱抑素C(cystatin C,Cys C)和中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)的含量:取小鼠尾静脉血,分离血清,按ELISA试剂盒说明书检测血清中Cys C和NGAL的水平。
1.2.8 Western blot检测肾组织SIRT3、Cyp D、细胞色素C(cytochrome C,Cyt C) 及乙酰化Cyp D表达:通过RIPA裂解液取小鼠肾组织全蛋白,BCA法将各组蛋白样品定量至相同浓度。取15 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳,然后,湿转法将蛋白质转移至甲醇预活化的PVDF膜,转膜条件为恒压100 V 2 h后,5%脱脂牛奶室温下封闭1 h并以1∶2 000的稀释比例孵育Ⅰ抗体(SIRT3、Cyp D及Cyt C),4 ℃过夜。次日,以TBST洗涤后室温孵育相应的HRP标记的Ⅱ抗(1∶10 000稀释)1 h,以TBST洗涤后利用化学发光成像仪显影。乙酰化的Cyp D检测采用乙酰赖氨酸残基抗体包裹蛋白磁珠G 沉淀,95 ℃变性,SDS分离蛋白转移至膜上,抗体孵育及显影方法同前。
1.3 统计学分析
2 结果
2.1 右美托咪啶可缓解小鼠肾I/R损伤
与sham组比较,I/R组血清肌酐、NGAL、Cys C及血浆尿素水平均明显升高(P<0.05);与I/R组比较,DEX+I/R组上述指标均明显降低(P<0.05)(图1A~D)。I/R组肾小管扩张,腔内充血,上皮细胞呈空泡化且呈管状坏死;右美托咪啶处理可缓解I/R导致的病理变化(图1E,F)。
2.2 右美托咪啶可减轻I/R导致的肾损伤相关蛋白异常
与sham组比较,I/R组肾SIRT3水平明显降低,Cyt C及乙酰化Cyp D水平明显增高(P<0.05);与I/R组比较,DEX+I/R组肾SIRT3水平明显增高(P<0.05),Cyt C及乙酰化Cyp D水平明显降低(P<0.05)(图2)。
2.3 抑制SIRT3可减轻右美托咪啶缓解I/R肾损伤的作用
与DEX+I/R组比较,siRNA+DEX+I/R组血清肌酐、NGAL、Cys C及血浆尿素水平明显升高(P<0.05) (图3A~D)。与sham组比较,I/R组肾组织凋亡细胞数目明显增高(P<0.05);DEX处理后,DEX+I/R组凋亡细胞数目较I/R组减少(P<0.05),但在siRNA+DEX+I/R组,凋亡细胞数目明显高于DEX+I/R组(P<0.05)(图3E,F)。
2.4 抑制SIRT3减轻右美托咪啶对缓解肾损伤相关蛋白的作用
与sham组比较,I/R组肾SIRT3的活性明显降低(P<0.05);DEX处理后,DEX+I/R组SIRT3的活性较I/R组明显增高(P<0.05),但在siRNA+DEX+I/R组,SIRT3的活性明显低于DEX+I/R组(P<0.05) (图4B),SIRT3的蛋白水平也有相似的结果(图4A,C)。与DEX+I/R组比较,siRNA+DEX+I/R组肾Cyt C (图4A,E) 和乙酰化Cyp D (图 4A,D)水平明显增高(P<0.05)。
3 讨论
外界刺激引起线粒体损伤是AKI的病理基础,阻止线粒体损伤的发生可有效缓解AKI[8]。有报道[6-7, 9],SIRT3可通过抑制线粒体损伤来缓解I/R导致的心肌损伤及肾损伤。因此,本研究在肾I/R损伤模型中探讨DEX与SIRT3的关系。
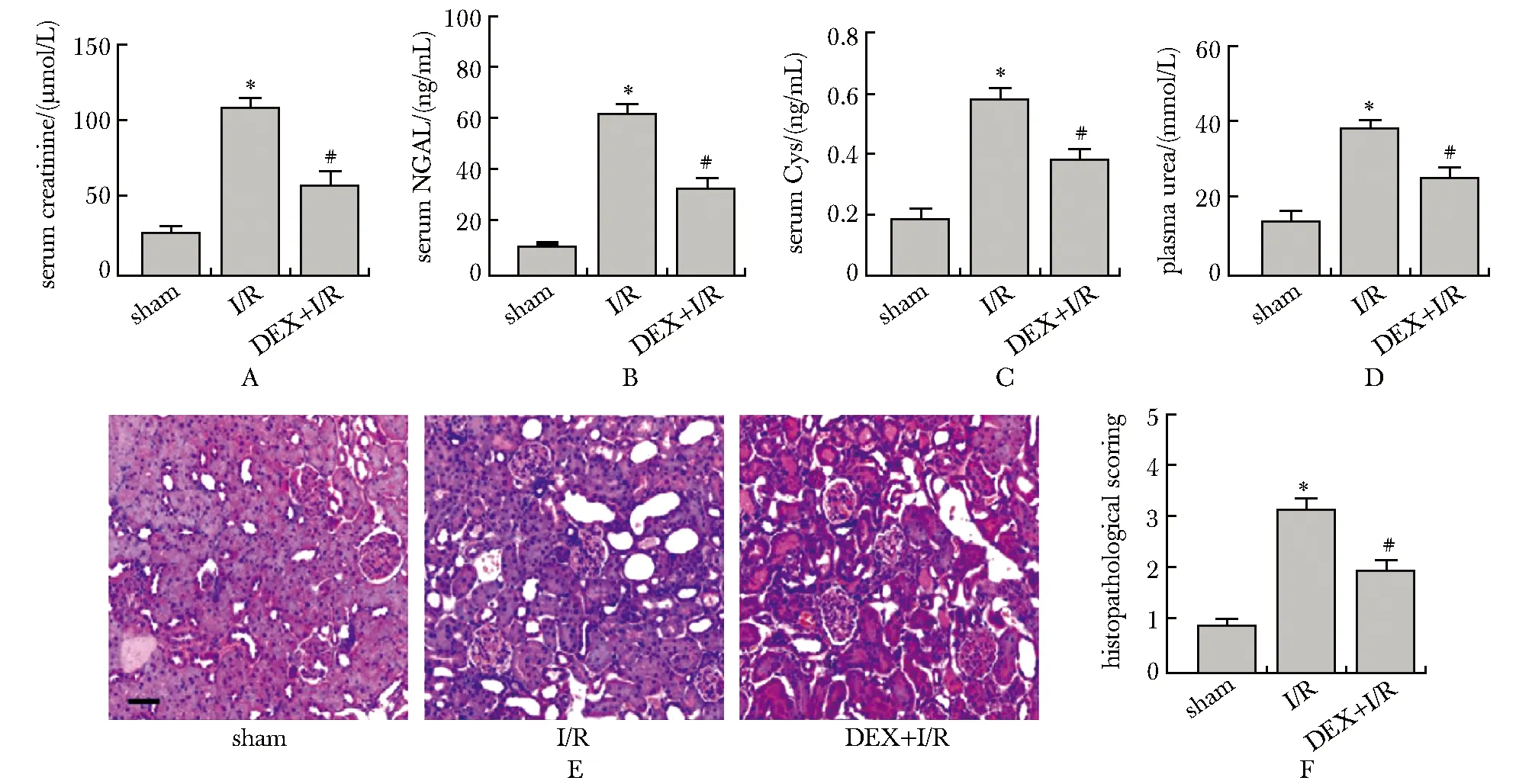
A.quantification of serum creatinine level; B.quantification of serum NGAL level; C.quantification of serum Cys C level; D.quantification of plasma urea level; E.representative HE staining images of renal tissues in sham, I/R and I/R+ DEX treatment groups (scale bar=100 μm); F.semi-quantification of tubular necrosis in each group; *P<0.05 compared with sham group;#P<0.05 compared with I/R group图1 右美托咪啶可缓解I/R导致的肾功能损伤及病理改变Fig 1 Dexmedetomidine alleviated renal impairment and pathological changes caused by n=6)

A.representative Western blot images of SIRT3, Cyp D and Cyt C in renal tissues of each group; B.quantification of expression of SIRT3 protein; C.quantification of expression of acetylated Cyp D protein; D.quantification of expression of Cyt C protein; *P<0.05 compared with sham group; #P<0.05 compared with I/R group图2 右美托咪啶可减轻I/R导致的肾损伤相关蛋白异常Fig 2 Dexmedetomidine alleviated kidney injury associated protein abnormalities caused by I/R n=6)

A.quantification of serum creatinine level; B.quantification of serum NGAL level; C.quantification of serum Cys C level; D.quantification of plasma urea level; E representative Tunel staining images of renal tissues in each groups (scale bar=100 μm); F.semi-quantification of Tunel staining in each group; *P<0.05 compared with sham group; #P<0.05 compared with I/R group; △P<0.05 compared with DEX+I/R group图3 抑制SIRT3可减轻右美托咪啶缓解肾I/R损伤的作用Fig 3 Inhibition of SIRT3 attenuated the improving effect of dexmedetomidine on renal I/R injury n≥6)
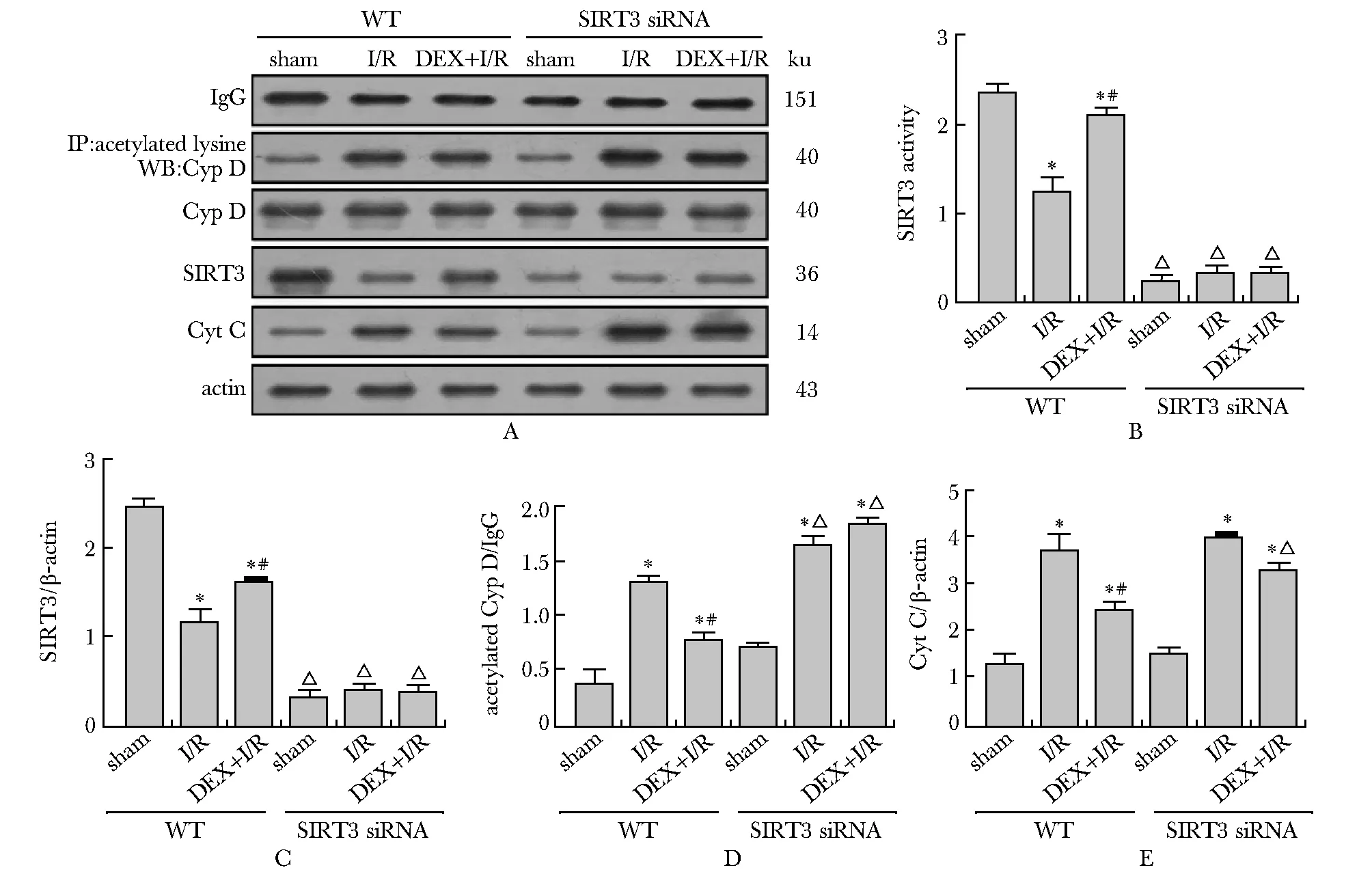
A.representative Western blot images of SIRT3, Cyp D, Cyt C and acetylated Cyp D protein expression in renal tissues of each group; B.quantification of SIRT3 activity in renal tissues of each group; C.quantification of SIRT3 protein; D.quantification of acetylated Cyp D protein; E.quantification of Cyt C proteins; *P<0.05 compared with sham group; #P<0.05 compared with I/R group; △P<0.05 compared with DEX+I/R WT group图4 抑制SIRT3可减轻右美托咪啶对缓解肾损伤相关蛋白的作用Fig 4 Inhibition of SIRT3 attenuated the mitigative effect of dexmedetomidine on kidney injury-related
线粒体基质蛋白Cyp D过度乙酰化,导致线粒体功能障碍,引起Cyt C释放和caspase激活,最终导致肾损伤[10]。本研究发现:I/R可引起肾Cyp D过度乙酰化、Cyt C表达增高和细胞凋亡增加;DEX可改善上述变化,从而缓解肾组织病理学改变。Cyp D抑制剂环孢霉素A可缓解由Cyp D过度乙酰化导致的线粒体损伤[11],与本研究结果一致。SIRT3作为脱乙酰酶,可通过对Cyp D脱乙酰化,阻止Cyp D与腺嘌呤核苷酸转运子的结合,抑制线粒体膜通道的开放,从而改善心肌I/R损伤[11]。本研究发现:在肾I/R损伤模型中,SIRT3活性及蛋白表达水平降低;DEX可上调SIRT3活性及蛋白表达,改善肾功能;而抑制SIRT3可逆转DEX对Cyp D过度乙酰化、Cyt C表达增高和细胞凋亡的缓解作用。DEX通过上调SIRT3的活性及蛋白水平来拮抗肾I/R损伤。
综上所述,DEX通过上调SIRT3在小鼠肾I/R损伤中起到保护作用。
