惰性载体支撑钙铜复合吸收剂的碳酸化性能及其动力学分析
2020-03-04张振民王研凯连世文李丰泉袁东辉李迎春段伦博
张振民, 陈 健, 王研凯, 连世文, 李丰泉, 王 超,袁东辉, 李迎春, 段伦博
(1.内蒙古电力(集团)有限责任公司 内蒙古电力科学研究院分公司,内蒙古 呼和浩特 010020;2. 东南大学 能源热转换及其过程测控教育部重点实验室,江苏 南京 210096)
CO2作为温室气体的主要成分,控制其排放已成为全球关注的焦点问题。燃煤电站是最大、最集中的CO2排放源,减少燃煤电站的CO2排放是实现CO2减排目标的重要途径[1-4]。钙循环工艺具有原料价格低、来源广泛、理论吸附容量高(约每克CaO吸附CO20.786 g)等优点,是目前最有前景的大规模CO2捕集技术之一[5-7]。然而在钙循环工艺中,为了在煅烧反应器出口获得高浓度的CO2,通常采用燃料的富氧燃烧提供CaCO3分解所需的热量。因此,需要额外引入空气分离器制备纯氧。然而,运行空气分离器需要消耗大量的能量,会大幅降低电厂运行效率[8]。
针对运行空气分离器所造成的巨大能耗,Abanades等[9]和Manovic等[10]在近期提出了钙铜联合循环工艺,将化学链燃烧技术与钙循环工艺相耦合,利用铜基载氧体的化学链燃烧所释放的热量煅烧钙基吸收剂,从而避免了空气分离器的运行使用,提高了系统经济性。Ozcan等[11]通过系统计算发现,由于避免了空气分离器的运行使用,在相同CO2捕集效率下(约90%),钙铜联合循环工艺的能耗比钙循环技术减少了3.5%。
无论是钙循环工艺还是钙铜联合循环工艺,吸收剂的性能在很大程度上影响着工艺的运行效率。钙基吸收剂在循环反应过程中会发生烧结,其CO2捕集性能会随着循环次数的增加而急剧衰减[12-13]。然而,相比于钙基吸收剂,钙铜复合吸收剂CO2捕集性能的衰减更为严重[14-15]。Qin等[16]采用湿法混合法分别制备了CaO和钙铜复合吸收剂,发现CaO的首次碳酸化转化率为90%,经历4次循环后衰减至80%。然而,钙铜复合吸收剂首次碳酸化转化率仅为17%,经历4次循环后衰减至13%。这主要是因为钙铜复合吸收剂中铜基氧载体(CuO/Cu)的塔曼温度低于反应温度,加速了复合吸收剂的烧结[17]。此外,随着循环反应的进行,钙铜复合吸收剂中的CuO会迁移至吸收剂表面(柯肯达尔效应),抑制了CO2与CaO的接触[18]。相比于CO2捕集性能的急剧衰减,钙铜复合吸收剂的氧化性能非常优越。在目前绝大多数已报导的工作中,钙铜复合吸收剂在氧化反应中的氧化率始终大于85%[19-22]。
为了改善钙铜复合吸收剂的CO2捕集性能,提高其循环稳定性,目前已经开展了大量的研究工作,主要集中在制备多孔钙铜复合吸收剂[21]、热预处理[18]和添加惰性载体[23]。其中,添加惰性载体是最有大规模应用前景的改性手段之一。惰性载体在吸收剂中发挥“框架”作用,能有效抑制晶粒之间的团聚,阻止孔隙结构坍塌,从而显著改善了吸收剂的循环稳定性。Kierzkowska等[23]采用溶胶-凝胶法制备了MgO支撑的钙铜复合吸收剂,借助热重分析仪在等温条件下(约750 ℃)开展了循环实验,发现其首次CO2捕集量为0.15 g/g,经历了15次循环后,CO2捕集量为0.10 g/g。Ma等[24]采用自组装模板法制备了MgO/Al2O3支撑的钙铜复合吸收剂,在热重分析仪上开展了循环实验,发现其首次CO2捕集量为0.05 g/g,经历了30次循环后,CO2捕集量为0.08 g/g。Ridha等[25]采用机械制粒机制备了水泥支撑的钙铜复合吸收剂,在固定床反应器上开展了循环实验,发现其首次CO2捕集量为0.11 g/g,经历了12次循环后,钙铜复合吸收剂的CO2捕集量为0.07 g/g。由此可见,添加惰性载体后,钙铜复合吸收剂CO2捕集性能的稳定性得到了显著的改善。但由于钙铜联合循环工艺是近期才被提出,研究起步较晚,目前对于添加惰性载体提高钙铜复合吸收剂性能稳定性的报道还较少,仍然还有许多工作需要开展,例如惰性载体种类、惰性载体添加量、合成方法等对吸收剂性能稳定性的影响。
Al2O3和ZrO2是两种常用的惰性载体,可以显著改善钙基吸收剂的循环稳定性[26]。因此,笔者采用Pechini法分别制备了Al2O3和ZrO2支撑的钙铜复合吸收剂和无惰性载体支撑的钙铜复合吸收剂,在热重分析仪上开展了煅烧/还原-氧化-碳酸化循环实验,评估其CO2捕集性能和氧化性能。采用缩核模型对有、无惰性载体支撑的钙铜复合吸收剂的碳酸化反应过程开展了动力学分析,从动力学角度揭示添加惰性载体对钙铜复合吸收剂碳酸化反应的作用机制。
1 实验部分
1.1 试剂和原料
试剂:硝酸钙(Ca(NO3)2·4H2O)、硝酸铜(Cu(NO3)2·3H2O)、硝酸铝(Al(NO3)3·9H2O)、柠檬酸(C6H8O7)、乙醇、乙二醇,均为分析纯,Acros Organics公司产品;硝酸锆(Zr(NO3)4·5H2O)、乙醇、乙二醇,均为分析纯,Sigma-Aldrich公司产品。
气体:N2、CH4、O2、CO2,体积分数均大于99.9%,由南京特种气体厂有限公司提供。
1.2 惰性载体支撑的钙铜复合吸收剂的制备
采用Pechini法制备惰性载体支撑的钙铜复合吸收剂[27]。分别称取一定量的Ca(NO3)2·4H2O、Cu(NO3)2·3H2O、惰性载体前驱体(Al(NO3)3·9H2O或者Zr(NO3)4·5H2O)和等摩尔的柠檬酸,溶解在乙醇溶液中(乙醇和去离子水的体积比为1∶4)。待充分溶解后,再向溶液中添加2 mL乙二醇,搅拌10 min。随后将溶液置于油浴锅中,边搅拌边加热至85 ℃,并保温3 h,可获得黏性胶体。将黏性胶体放入烘箱中,130 ℃干燥12 h。由于在干燥过程中会产生大量的气体,可以观察到黏性胶体剧烈膨胀。最后,将干燥后的样品研磨后送入马弗炉,800 ℃ 干燥1 h(升温速率为5 ℃/min)。
实验中CaO和CuO的摩尔比始终为1,惰性载体与CaO、CuO之和的摩尔比始终为15∶85。将无惰性载体支撑的钙铜复合吸收剂记为CaO-CuO,Al2O3和ZrO2支撑的钙铜复合吸收剂分别记为CaO-CuO-Al2O315和CaO-CuO-ZrO215。
1.3 循环煅烧/还原-氧化-碳酸化实验
采用瑞士梅特勒公司生产的TGA/DSC 1型热重分析仪开展煅烧/还原-氧化-碳酸化循环实验。首先在氧化铝坩埚(体积为70 μL)中称取大约10 mg的样品,置于热重分析仪内。在N2气氛下从室温(25 ℃)升温至850 ℃,然后切换成10%(体积分数,以下同) CH4(N2作为平衡气),保温10 min,在此期间进行煅烧/还原反应。随后切换成N2气氛,降温至指定温度(550~750 ℃)。当达到指定温度后,先将气氛切换成21% O2(N2作为平衡气),进行 15 min 的氧化反应,再将气氛切换成15% CO2(N2作为平衡气),进行30 min碳酸化反应,以此完成一次煅烧/还原-氧化-碳酸化实验。在循环指定次数后,最终总是以煅烧/还原反应作为结尾,方便对循环反应后的样品进行微观结构测试。实验过程中,进入热重分析仪的总气体流量均为175 mL/min,升温或降温速率始终为10 ℃/min,反应压力为常压。
分别采用CO2捕集量(Xn)和载氧量(Yn)来评价钙铜复合吸收剂的CO2捕集性能和氧化性能。具体计算公式如式(1)和式(2)所示:
(1)
(2)
式中:Xn为第n次循环的CO2捕集量,g/g;mn,car为第n次碳酸化后样品的质量,mg;mn,oxi为第n次氧化后样品的质量,mg;m0为样品的初始质量,mg;mn,cal为第n次煅烧后样品的质量,mg;Yn为第n次循环的载氧量,g/g。
1.4 理化性质表征
采用荷兰PANalytical公司生产的X射线衍射仪(PANalytical Empyrean)获得钙铜复合吸收剂的物相组成;采用美国FEI公司生产的扫描电镜(FEI Magellan 400)获得钙铜复合吸收剂的表观形貌;采用美国Quantachrome公司生产的氮气吸附/脱附仪(NOVA 4000 e)获得钙铜复合吸收剂的微孔结构。
2 碳酸化反应动力学控制阶段动力学分析方法
2.1 缩核模型
本研究采用缩核模型作为描述碳酸化反应过程中动力学控制阶段的模型[28],表达式如下:
1-(1-Zn)1/3=kct
(3)
(4)
(5)
式中:Zn是第n次循环中CaO的转化率,%;kc为动力学控制阶段的反应速率,s-1;t为碳酸化时间,s;w为样品中CaO质量分数,%;MCaO和MCO2分别是CaO和CO2的摩尔质量,g/mol。
气-固反应速率R可定义为[29]:
(6)
当气-固反应处于动力学控制阶段时,反应速率R可进一步写成[30]:
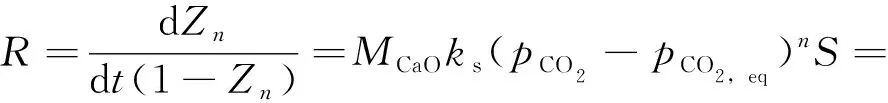
(7)
式中:R为反应速率,s-1;ks为动力学控制阶段的本征反应速率,mol/(m2·s·kPa);pCO2为CO2的分压,kPa;pCO2,eq为CO2的平衡分压,kPa;S为样品的比表面积,m2/g。
由式(4)、(6)、(7)可得:
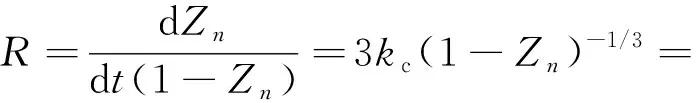
(8)
在初始时刻,即t=0,此时反应速率kc=r0,比表面积S=S0,碳酸化转化率Zn=0,则式(8)可以简化为:
3r0=56ks(pCO2-pCO2,eq)nS0
(9)
由阿累尼乌斯公式
ks=Aexp(-E/RgT)
(10)
可得:
3r0=56Aexp(-E/RgT)×(pCO2-pCO2,eq)nS0
(11)
式中:A为指前因子,mol/(m2·s);Rg为气体常数,8.314 J/(mol·K);T为碳酸化温度,K;E为反应活化能,kJ/mol。
将式(11)两边取对数,经整理可得:
(12)
当pCO2-pCO2,eq>10 kPa时,假设n=0[30],则式(12)可整理成
(13)
因此,反应活化能E和指前因子A可以根据lnr0-1000/T拟合直线的截距和斜率获得。
3 结果与讨论
3.1 钙铜复合吸收剂理化性质表征
采用X射线衍射仪分析了所制备钙铜复合吸收剂的物相组成,其结果如图1所示。由图1看到,当不添加惰性载体时,钙铜复合吸收剂的主要成分是CaO、CuO和Ca2CuO3。尽管在材料制备过程中CaO和CuO发生反应,生成了钙铜化合物(Ca2CuO3),但是在后续的煅烧/还原反应中,Ca2CuO3会分解重新生成CaO和CuO,因此不会对吸收剂的性能产生影响[31]。当加入Al2O3或者ZrO2载体时,CaO分别和载体发生反应,生成了Ca5Al6O14(5CaO+3Al2O3↔Ca5Al6O14)或CaZrO3(CaO+ZrO2↔CaZrO3)。值得注意的是,Ca5Al6O14和CaZrO3是惰性成分,不会参与到碳酸化反应中,而生成的Ca5Al6O14和CaZrO3消耗了钙铜复合吸收剂中的CaO,导致吸收剂中CaO含量减少,降低了吸收剂的CO2捕捉量。但是,Ca5Al6O14和CaZrO3都增强了载体与活性成分(CaO和CuO)之间的相互作用,能更好地发挥载体的“框架”作用。
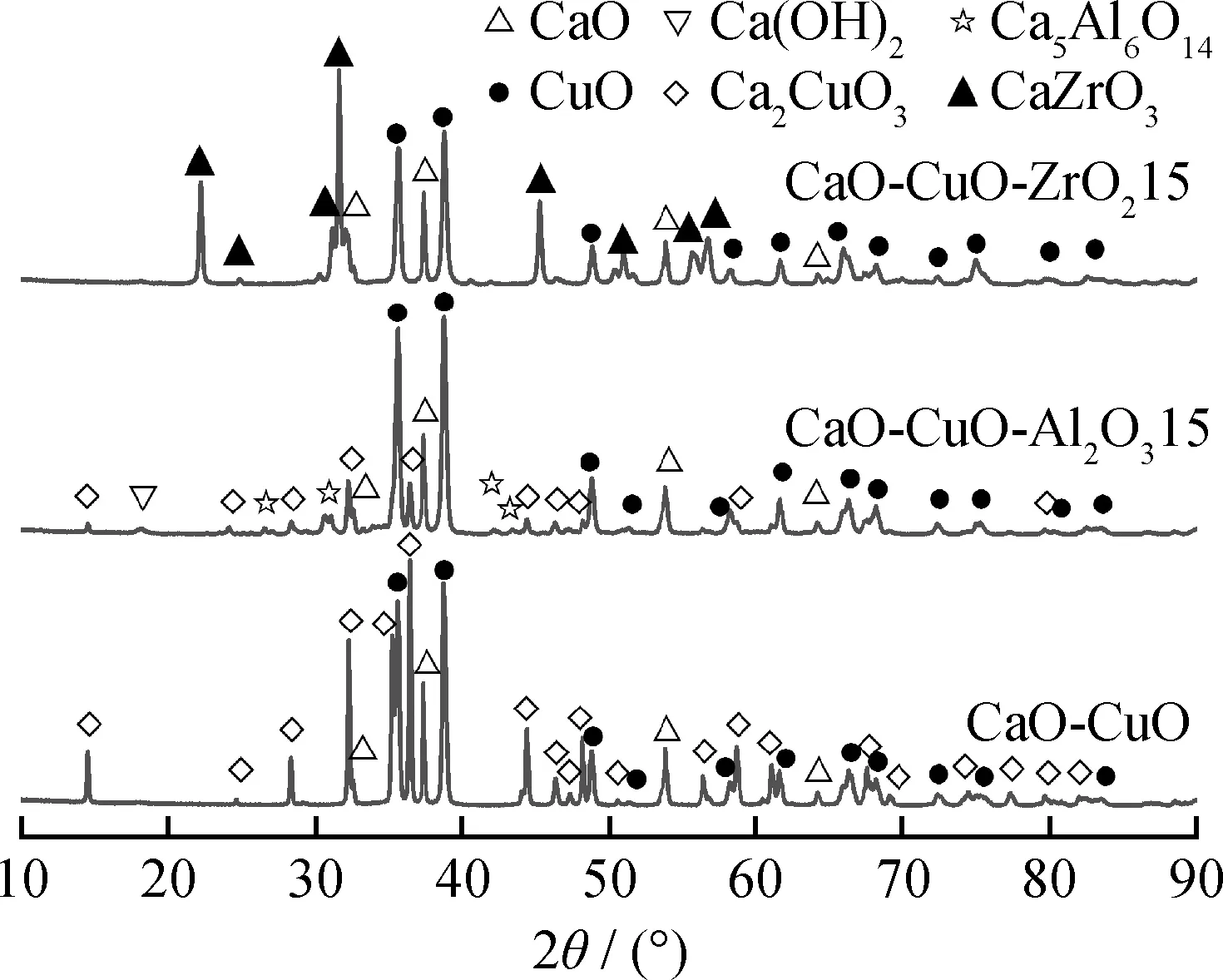
图1 有无惰性载体支撑物的钙铜复合吸收剂XRD谱图Fig.1 XRD patterns of CaO/CuO composites with and without inert supports
表1为有无惰性载体支撑物的钙铜复合吸收剂的比表面积和孔体积。由表1可以发现,当不添加惰性载体时,钙铜复合吸收剂的比表面积非常低,仅为3.1 m2/g,远低于在相同制备参数下合成的钙基吸收剂(约12 m2/g)[27]。这说明由于铜基载氧体的存在,样品在材料制备过程中的烧结情况更为严重。当添加Al2O3或者ZrO2载体后,钙铜复合吸收剂的比表面积有了明显的增加。表明添加惰性载体可以很好地改善钙铜复合吸收剂的孔隙结构。此外,可以发现,添加惰性载体并没有明显地改变钙铜复合吸收剂的孔体积,吸收剂的孔体积始终保持在0.012 cm3/g。

表1 有无惰性载体支撑物的钙铜复合吸收剂的比表面积和孔体积Table 1 Specific surface area and pore volume of CaO/CuO composites with and without inert supports
图2给出了钙铜复合吸收剂的孔径分布。相比于无惰性载体支撑的钙铜复合吸收剂,Al2O3或者ZrO2支撑的钙铜复合吸收剂具有更多直径范围在2~30 nm之间的介孔。这部分介孔的存在非常有利于碳酸化反应的进行,可以加强CO2在吸收剂中的扩散,提高其CO2捕集性能[32-33]。
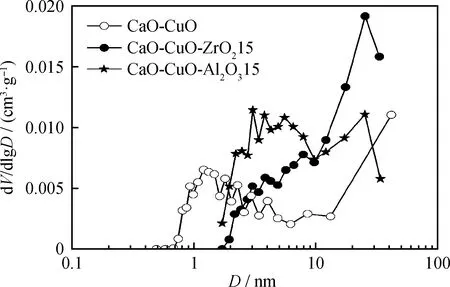
图2 有无惰性载体支撑物的钙铜复合吸收剂的孔径分布Fig.2 Pore size distribution of CaO/CuO composites with and without inert supports
3.2 反应温度对钙铜复合吸收剂氧化性能和CO2捕集性能的影响
反应温度在第一次循环反应中对无惰性载体支撑的钙铜复合吸收剂氧化性能和CO2捕集性能的影响见图3。由图3(a)可以发现,随着氧化温度增加,钙铜复合吸收剂的氧化速率相应提高,但对于最终的载氧量影响不大。当氧化温度高于 700 ℃ 时,钙铜复合吸收剂的氧化速率基本维持不变,且钙铜复合吸收剂的氧化速率均非常高。当氧化温度为 550 ℃ 时,1 min内吸收剂吸收的O2量为0.09 g/g,占总吸收量的75%,5 min内吸收的O2量占总吸收量的90%。
由图3(b)可以看出,碳酸化温度不仅影响钙铜复合吸收剂的碳酸化速率,还影响钙铜复合吸收剂的CO2捕集量。当碳酸化温度从550 ℃增加到 700 ℃ 时,碳酸化30 min,钙铜复合吸收剂的CO2捕集量从0.08 g/g迅速增长到0.24 g/g。在此期间,钙铜复合吸收剂的碳酸化速率也随着碳酸化温度的升高而显著增加。这是因为碳酸化反应过程可以分为快速动力学控制阶段和慢速扩散控制阶段。随着碳酸化温度的升高,动力学控制阶段的时间也相应延长,进而提高了碳酸化反应速率和最终CO2捕集量[34]。然而,当继续增加碳酸化温度到750 ℃时,钙铜复合吸收剂的碳酸化速率和CO2捕集量没有发生明显的改变。

图3 反应温度对CaO-CuO氧化性能和CO2捕集性能的影响Fig.3 Effects of reaction temperatures on the oxidation and CO2 capture performances of the CaO-CuOReaction conditions: Carbonation/reduction reaction temperature 850 ℃, 10% CH4, 10 min; Oxidation reaction: 21% O2, 15 min;Carbonation reaction: 15% CO2, 30 min(a) Oxidation temperature; (b) Carbonation temperature
3.3 钙铜复合吸收剂长循环性能测试
图4给出了有无惰性载体支撑的钙铜复合吸收剂在10次循环内的氧化性能和CO2捕集性能。由图4(a)可知,有无惰性载体支撑的钙铜复合吸收剂都呈现出非常稳定的氧化性能,然而随着惰性载体的加入,钙铜复合吸收剂的载氧量下降,且保持稳定。这是因为加入惰性载体会降低钙铜复合吸收剂中Cu含量,导致钙铜复合吸收剂所吸收的O2量降低。
由图4(b)看到:当不添加惰性载体时,CaO-CuO 首次CO2捕集量为0.16 g/g,经历10次循环后CO2捕集量衰减至0.07 g/g,仅占初始捕集量的43%;当加入惰性载体后,钙铜复合吸收剂的稳定性有了明显的提高。CaO-CuO-Al2O315首次CO2捕集量为0.18 g/g,经历10次循环后CO2捕集量为0.14 g/g,占初始捕集量的78%;CaO-CuO-ZrO215首次CO2捕集量为0.13 g/g,经历10次循环后CO2捕集量为0.12 g/g,占初始捕集量的92%。相比于CaO-CuO,Al2O3和ZrO2支撑的钙铜复合吸收剂经历10次循环后的CO2捕集量分别提升了100%和71%。
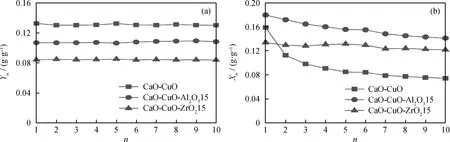
图4 有无惰性载体支撑的钙铜复合吸收剂氧化性能和CO2捕集性能对比Fig.4 Comparison of the oxidation and CO2 capture performance for inert support-stabilized andunstabilized-CaO/CuO compositesReaction conditions are the same as Fig.3.(a) Oxidation performance; (b) CO2 capture performance
值得注意的是,CaO-CuO-Al2O315的首次CO2捕集量高于CaO-CuO。这是因为尽管Al2O3与CaO反应生成了Ca5Al6O14,消耗了钙铜复合吸收剂中的CaO,降低了吸收剂的CO2捕集量,但是生成的Ca5Al6O14改善了钙铜复合吸收剂的抗烧结性能,可以增加吸收剂的CO2捕集量;生成Ca5Al6O14导致的吸收剂CO2捕集量的增加超过了消耗CaO所导致的CO2捕集量的下降,最终使得CaO-CuO-Al2O315的首次CO2捕集量高于CaO-CuO。然而,对于CaO-CuO-ZrO215来说,消耗CaO所导致的CO2捕集量的降低占了主导作用,最终使得CaO-CuO-ZrO215的首次CO2捕集量低于CaO-CuO。
图5给出了CaO-CuO-Al2O315在35 次循环内的氧化性能和CO2捕集性能。由图5可以发现CaO-CuO-Al2O315的氧化性能非常稳定。然而,CaO-CuO-Al2O315的CO2捕集性能会随着循环次数的增加而逐渐衰减。当经历了35 次循环后,CaO-CuO-Al2O315的CO2捕集量从第1次循环的0.18 g/g衰减到了0.11 g/g,仍可以保留初始值的61%。

图5 CaO-CuO-Al2O315在长循环下的氧化性能和CO2捕集性能Fig.5 Oxidation and CO2 capture performance of theCaO-CuO-Al2O315 in a long cyclic testReaction conditions are the same as Fig.3.
图6给出了循环实验前后CaO-CuO和 CaO-CuO-Al2O315 的表观形貌变化。可以发现,新鲜CaO-CuO的表面非常粗糙,是由许多细小颗粒组成(图6(a));经历了10次循环实验后, CaO-CuO 表面发生了严重的烧结,颗粒团聚到一起(图6(b))。当加入Al2O3载体后,新鲜CaO-CuO-Al2O315的孔隙结构非常发达,表面出现了非常多的孔,且表面颗粒变得更加细小(图6(c)),这与氮吸附结果中 CaO-CuO-Al2O315 的比表面积比 CaO-CuO 有所增加相一致(见表1)。经历了35次循环后,尽管CaO-CuO-Al2O315表面的孔减少了很多,但此时表面颗粒仍然非常细小,没有观测到明显的烧结团聚现象(图6(d))。这表明Al2O3载体发挥了很好的“框架”作用,抑制了烧结的发生。

图6 循环实验前后CaO-CuO和CaO-CuO-Al2O315的形貌变化Fig.6 Morphological changes of CaO-CuO and CaO-CuO-Al2O315 before and after cyclic operations(a) Fresh CaO-CuO; (b) CaO-CuO after 10 cycles;(c) Fresh CaO-CuO-Al2O315;(d) CaO-CuO-Al2O315 after 35 cycles
3.4 碳酸化反应动力学研究
根据CaO-CuO和CaO-CuO-Al2O315在碳酸化过程中的热重数据,采用缩核模型分别对其不同循环次数下的动力学控制阶段内的1-(1-Xn)1/3和t进行了拟合,所得反应速率常数kc列于表2中。由表2 发现,所有的相关系数R2都大于0.99,表明缩核模型可以很好地描述钙铜复合吸收剂碳酸化过程中的动力学控制阶段。CaO-CuO-Al2O315初始的kc大于CaO-CuO。经历10次循环后,kc均开始减小。CaO-CuO的kc减小幅度超过一个数量级;然而CaO-CuO-Al2O315的kc减小幅度仅为0.8×10-4s-1。说明添加Al2O3载体不仅可以加快动力学控制阶段的反应速率,还可以延缓动力学控制阶段反应速率的衰减。

表2 不同循环次数(n)下CaO-CuO和CaO-CuO-Al2O315碳酸化反应中动力学控制阶段的反应速率常数Table 2 Reaction rate constants of carbonation inkinetics-controlled stage for CaO-CuO andCaO-CuO-Al2O315 at different cycles (n)
作lnr0-1000/T的拟合直线,根据其斜率和截距分别获得反应活化能E和指前因子A,结果列于表3。如式(13)所示,根据截距计算A时需要用到吸收剂的比表面积(S0),因此表3中只给出了钙铜复合吸收剂在第一次碳酸化反应过程中的动力学参数。表3中CaO-CuO动力学控制阶段的反应活化能是83.5 kJ/mol。这与Chen等[20]采用共沉淀法制备的钙铜复合吸收剂(无惰性载体支撑)所求得的 99.4 kJ/mol 相符。而CaO-CuO-Al2O315动力学控制阶段的反应活化能仅为59.8 kJ/mol,表明添加Al2O3载体可以显著降低碳酸化反应的活化能,进而对碳酸化反应起着促进作用。

表3 CaO-CuO和CaO-CuO-Al2O315第一次碳酸化反应中的动力学参数Table 3 Kinetic parameters of the 1st carbonation reaction of CaO-CuO and CaO-CuO-Al2O315
4 结 论
(1)添加惰性载体可以显著改善钙铜复合吸收剂的CO2捕集性能,提高其循环稳定性。相比于CaO-CuO,Al2O3和ZrO2支撑的钙铜复合吸收剂经历10次循环后的CO2捕集量分别提升了100%和71%。然而,添加惰性载体会降低钙铜复合吸收剂的载氧量,但不影响其循环稳定性。
(2)反应温度对钙铜复合吸收剂的氧化性能和CO2捕集性能起着很大的作用。提高氧化温度会增加氧化速率,但基本不影响最终的载氧量。而提高碳酸化温度不仅会提高碳酸化速率,还会增加最终的CO2捕集量。
(3)添加Al2O3载体不仅可以提高碳酸化反应动力学控制阶段的反应速率,还可延缓动力学控制阶段反应速率的衰减,同时降低碳酸化反应活化能,进而对碳酸化反应起到显著的促进作用。
