铝基载氮体在煤化学链制氨过程中的吸氮和释氮行为
2020-03-04冯鸣谦
吴 烨, 张 权, 冯鸣谦, 刘 冬
(南京理工大学 能源与动力工程学院,江苏 南京 210094)
随着全球经济的快速发展,对于化石燃料的需求日益增加,尤其是直接燃烧煤炭等化石能源会造成大量CO2的排放[1],加剧温室效应对环境造成的破坏,此外还会造成大气污染、雾霾以及生态平衡破坏等其他环境问题[2]。因此,在保障中国工业化和经济快速发展的同时,还要通过改善能源结构、合理利用化石能源、发展无碳能源或清洁能源来控制CO2的排放以及其他环境问题[3-5]。氢能(H2)是21世纪以来可持续发展的清洁无碳能源[6-7],但由于氢气液化难度大[8]、能量密度较低[9]等问题,需要通过对化石燃料的二次开发与利用,制备其他低碳甚至是无碳的气体燃料,控制各种污染物以及CO2的排放,实现资源环境与经济发展的相互促进与相互协调。
氨气(NH3)是被广泛应用于众多产业的重要合成原料,如炸药[10]、化肥[11-12]、制冷剂[13]和药物[14]等。除此之外,NH3的理论燃烧产物是对环境完全没有影响的N2和水[15-16]。由于NH3的理论燃烧热值(317.5 kJ/mol,约为H2的1.5倍)[17]高,以及较低的储存与运输成本(极易液化和溶于水中),国内外众多学者都开展了对于NH3燃烧与利用的研究[18-19]。因此,NH3可以作为一种极具发展前景的无碳气体燃料进行合成与开发。
目前,全球每年产氨量约为1.3×104Mt,大约90%都是通过哈-伯法制得[20],即将N2和H2在催化剂作用下,于高温、高压(700 ℃,30 MPa)下合成。但是,该反应受到热力学平衡的限制,在高温下的单程转化率较低(25%~30%)[21]。此外,该反应主要用于制备众多产业所需的氨原料,对于中国能源结构的改善并没有作用。为了进一步拓宽氨气合成的技术路线,与化石燃料的清洁开发相结合,国内外学者均致力于寻找一种转化率更高的新型氨合成方法。
有人提出通过将化石燃料中的碳源进行固氮反应生成NH3,其反应式如式(1)所示:
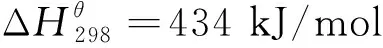
(1)
然而,由于N2分子中N≡N的稳定性[22]高,从热力学与动力学的角度来说,该反应难以实现。进而有人提出将该反应分解成两步反应,即化学链合成法,通过寻求一种合适的载氮体,使得N元素实现从N2到载氮体再到NH3中的迁移,促进化石能源中的能量转移到NH3中[23-24]。氧化铝来源广泛,价格低廉,可以作为铝基载氮体制备合成氨,其机理如图1所示。

图1 化学链反应合成氨(CLAG)的机理Fig.1 Mechanism of chemical looping ammonia generation (CLAG)
将化石燃料应用于化学链制氨反应中,产物CO能广泛应用于有机化工产业、食品行业以及医学研究领域[25],有效避免了化石燃料直接燃烧释放大量CO2,因此对该方法的深入研究对于拓宽化石燃料的清洁利用途径、发展无碳气体燃料和改善中国能源结构具有十分重要的意义。
有许多学者对碳热还原法制备氮化铝(AlN)进行了深入研究。例如: Forslund等[26]使用石墨炉研究了反应参数对该反应过程的影响,发现反应速率随着温度和压力的上升而提高,且温度小于1350 ℃时基本无碳热还原反应,1450 ℃后产物氮化率急剧上升,1550 ℃后逐渐稳定。有学者研究了铝源在碳热还原反应中的吸氮特性,如Tsuge等[27]研究发现,1500 ℃下,各种铝源的反应活性由大到小顺序为γ-Al2O3、Al(OH)3、α-Al2O3;另一方面,Wang等[28]和Komeya等[29-30]研究发现,由于反应所需的能量过高,需要添加合适的催化剂以改变反应途径,降低反应能垒,因此将CaF2、Ca(OH)2、Y2O3、Yb2O3及Cr2O3分别掺杂至吸氮体系中,极大提高了吸氮反应速率及AlN产率,并发现Y2O3的效果最佳,且Y2O3在反应过程中不会挥发,有利于催化剂的循环使用。
AlN是一种具有高导热性、低介电常数、低热膨胀系数等一系列优异特性的新型陶瓷材料,因此主流的研究方向大多为提高AlN的纯度,如何阻止AlN的水解,与笔者的研究目的恰恰相反[31]。除此之外,研究所使用的碳源均具有纯度较高、成分单一的特点,所以煤复杂多变的结构及成分势必对载氮体的吸氮反应造成影响;对于释氮反应,如何促进其水解,促进NH3的释放,目前仍鲜有报道。因此,笔者首先探索了石墨与碳黑对于铝基载氮体(Al2O3与AlN)吸氮反应活性的影响;其次,利用烟煤、无烟煤、褐煤的脱灰半焦为碳源,研究了不同煤种制备所得的脱灰半焦的吸氮反应特性;最后,研究了载氮体的释氮反应(NH3生成反应)特性,进一步提高AlN的水解,促进NH3的生成。
1 实验部分
1.1 试剂与原料
活性氧化铝粉末(γ-Al2O3,比表面积112 m2/g,粒径15 μm,质量分数大于99%,分析纯)、石墨/碳黑(粒径小于等于75 μm,质量分数大于99%)、标准氢氧化钠溶液(NaOH,0.2 mol/L)、甲基红(指示剂)、氢氟酸(HF,质量分数20%),均为阿拉丁生化科技股份有限公司产品;氧化钇粉末(Y2O3,质量分数大于99.00%)、二氧化钛粉末(TiO2,质量分数大于99.00%)、二氧化锆粉末(ZrO2,质量分数大于99.00%)、稀硫酸溶液(H2SO4,1.8×10-5mol/mL)、硝酸银标准溶液(AgNO3,1 mg/L)、盐酸(HCl,质量分数15%),国药化学试剂有限公司产品。氮气(体积分数大于99.99%)、氩气(体积分数大于99.99%)、二氧化碳(体积分数大于99.99%),均为南京文达特种气体有限公司产品。
1.2 原煤的预处理
选择横山烟煤、胜利褐煤、山西无烟煤为实验所用原煤,为了排除原煤中水分、灰分和挥发分对吸氮反应活性的影响,需对原煤样进行热解和酸洗预处理,使其成为脱灰半焦,再进行吸氮实验。处理过程如下:
(1)将煤块进行研磨,筛选出粒径不大于 0.075 mm 的煤粉颗粒;
(2)将煤粉颗粒装入石英载舟中放进管式炉中央,通入Ar吹扫20 min排尽炉内空气,然后进行热解反应。在N2、Ar或CO2气氛下,设置管式炉以2、5或10 ℃/min的升温速率升温至500、600或700 ℃,气体总流量为200 mL/min,热解停留时间为30 min,最后冷却至室温,得到焦炭,并用文献[32]报道的酸洗办法进行灰分处理,所得脱灰半焦的元素分析如表1所示。

表1 不同脱灰半焦的元素分析Table 1 Ultimate analysis of different deashing semi-coke w/%
1.3 实验步骤
在固定床反应装置上对载氮体与各种碳源进行吸氮、释氮反应活性研究,反应装置如图2所示,反应步骤如下。

图2 固定床反应装置示意图Fig.2 The schematic diagram of fixed bed reactor1—N2 cylinder; 2—Ar cylinder; 3—CO2 cylinder;4—Temperature controller; 5—Syringe pump;6—Water vapor valve; 7—Steam generator;8—Tube furnace; 9—Titrator; 10—NH3 absorption bottle
1.3.1 吸氮反应实验步骤
将铝源(γ-Al2O3粉末)、碳源(石墨、碳黑或原煤经处理得到的脱灰半焦)和催化剂(Y2O3粉末)按照(1~5)∶3∶0.03摩尔比均匀混合,其中将铝源与石墨混合的样品命名为AGn(n=1~5,表示Al2O3与石墨的摩尔比为n∶3),与碳黑混合的样品命名为ACm(m=1~5,表示Al2O3与碳黑的摩尔比为m∶3)。然后称取一定量(其中恒定石墨、炭黑或脱灰半焦的质量为0.05 g)上述实验样品,放置在管式炉中进行加热反应。管式炉升温时,通入Ar(100 mL/min)气体除去其中的空气和水分,当加热到反应温度(1100~1500 ℃,其中温度间隔为100 ℃)时,把Ar转换成N2(100 mL/min),反应 30 min 后,将N2再次切换为Ar(100 mL/min)。通过反应前后样品的质量变化计算碳的转化率,计算公式如式(2)所示:
(2)
式中:X为碳的转化率,%;MC为碳的摩尔质量,12 g/mol;mC为吸氮反应前样品中碳的质量,0.05 g;m0为吸氮反应前样品总质量,g;m1为吸氮反应后样品总质量,g;ΔM0为吸氮反应前、后固体的摩尔质量之差,56 g/mol。
1.3.2 释氮反应实验步骤
将AlN和TiO2或ZrO2按一定比例机械混合,将TiO2混合的催化载氮体记为TAN,ZrO2混合的催化载氮体记为ZAN。进行释氮反应时,首先通入500 mL/min的Ar并加热管式炉,升至反应温度(800~1000 ℃,其中温度间隔为50 ℃)后,减小Ar流量至100 mL/min,同时向炉内通入流量为400 mL/min的水蒸气并开始反应,然后打开换气阀门,将释氮反应尾气通入盛有稀硫酸(1.8×10-5mol/L)的吸收瓶中,并使用精密酸度计对吸收液的pH值进行在线监测。反应60 min后关闭水蒸气进气阀门,记录吸收液中pH值变化量。最后在吸收瓶中加入3~5滴甲基红试剂,再用氢氧化钠溶液滴定。当吸收剂的颜色由品红变为浅红时停止滴定,并记录滴定过程中消耗的氢氧化钠溶液的体积。反应中NH3的产量(nN,mol)计算公式如式(3)所示:
nN=2×cH×VH-cOH×VOH
(3)
式中:cH为稀硫酸吸收液的摩尔浓度,1.8×10-5mol/L;VH为使用的稀硫酸吸收液体积,0.15 L;cOH为滴定用标准NaOH溶液的摩尔浓度,0.2 mol/L;VOH为滴定过程中消耗的NaOH溶液体积,L。
单位时间(1 h)内不同工况下参与反应的载氮体的转化量(nA, mol)计算公式见式(4):
(4)
式中:m1和m2分别代表固体反应物在反应前、后的质量,g;ΔM1为释氮反应后和反应前固体的摩尔质量差(Al2O3和2AlN的摩尔质量差),20 g/mol。
然而,由于高温下NH3易分解为N2和H2,因此可通过公式(5)计算不同工况下由参与反应的AlN转化为NH3的产率(η,%):
(5)
1.3.3 氨气分解实验
利用固定床反应器探究了4种条件下(室温下有无ZrO2和900 ℃下有无ZrO2)NH3的分解特性。所有的分解实验均在标准大气压力(0.1 MPa)下进行。实验操作步骤如下:首先向管式炉内放入一定质量(约0.5 g)的ZrO2粉末(或不放),再使用200 mL/min的Ar对实验管路进行2 min左右的吹扫,使残余空气等完全排出。随后,设置升温程序,使管式炉以 15 ℃/min 的升温速率由室温上升至900 ℃(若为室温实验,则省略该步骤)。当炉内温度达到所需温度后,向炉内通入20 mL/min的NH3气体。为了防止高浓度的NH3对实验管路造成腐蚀等危害,同时向炉内通入200 mL/min的Ar对NH3气体进行稀释与平衡。出口气体通入盛有稀硫酸溶液的吸收瓶中,同时向吸收瓶中滴入2~3滴甲基红溶液作为指示剂。当吸收瓶内溶液颜色由品红色变为浅红色时,停止通入NH3,使用200 mL/min的Ar对管道内残余NH3进行吹扫。记录NH3开始通入到指示剂变色的总时间。变色时间越长,说明NH3分解的越多。每次实验均在相同条件下进行10次并取平均值来减小实验误差的影响。
1.4 拉曼分析
使用Aramis型拉曼光谱仪(法国Horiba Jobin Yvon公司产品)对不同的碳源吸氮产物中的碳进行检测,拉曼光谱记录范围为800~2000 cm-1,通过Origin 8.6软件对其进行多峰拟合。峰面积比和峰强度通常作为重要的参数来反映不同碳源中石墨化和无序化碳结构的变化。D峰代表无序化的碳结构,G峰代表石墨化的碳结构,ID/IG(D峰与G峰的面积之比)表示碳结构的无序化程度。
2 结果与讨论
2.1 吸氮反应特性研究
2.1.1 吸氮反应工况的影响
在以石墨或碳黑为碳源(C)的吸氮反应中,不同反应条件下载氮体的吸氮效果如表2所示。由 表2 可以看到,载氮体吸氮反应碳转化率X随着反应温度及氧化铝与C的摩尔比(n(Al2O3)/n(C))的升高而增加,但是,以碳黑为碳源时,当n(Al2O3)/n(C)由3/3增至5/3时,碳转化率的提升效果逐渐减弱。这是因为较高的反应温度为吸氮反应提供了较好的动力学环境,较高的n(Al2O3)/n(C)为吸氮反应提供了较好的热质传递效率并促进了碳的转化,但过多增加氧化铝的比例,其热质传递效率提升空间有限。此外,在相同的反应条件下,以碳黑为碳源的吸氮反应活性明显优于石墨,其主要原因可以从产物中碳结构的拉曼光谱图(见图3)和吸氮反应中碳的转化率(表2)得知:吸氮反应产物中碳的无序化碳程度(ID/IG)随着反应温度的升高和n(Al2O3)/n(C)的增加而降低,说明在吸氮反应过程中,有更多的无序化结构碳用于吸氮反应,无序化结构的碳能够促进吸氮反应的进行,碳黑中的无序化程度很高,而石墨仅含有石墨化结构的碳,因此使用碳黑的吸氮效率明显高于石墨。基于此,n(Al2O3)/n(C)的最佳摩尔比为3/3。

表2 不同反应工况下石墨和碳黑为碳源时吸氮反应中碳的转化率(X)Table 2 The carbon conversion effeciency (X) of graphite andcarbon black as carbon sources under different conditions
从表2得知,反应温度的升高有利于吸氮反应的进行,但是过高的反应温度往往会对反应产物的孔隙结构造成影响,不利于其后续释氮反应的进行,因此需要对吸氮反应产物进行比表面积表征,结果如表3 所示。
由表3可以看出:当反应温度为1200 ℃时,产物AlN仍然能够保持良好的孔隙结构和较大的比表面积;随着反应温度上升到1300 ℃,比表面积急剧下降,并在1500 ℃时降至最低。因此,吸氮反应温度过高并不利于释氮反应的进行。
结合表2、表3和图3的结果,反应温度为1200 ℃、n(Al2O3)/n(C)为3/3是最佳吸氮反应条件。
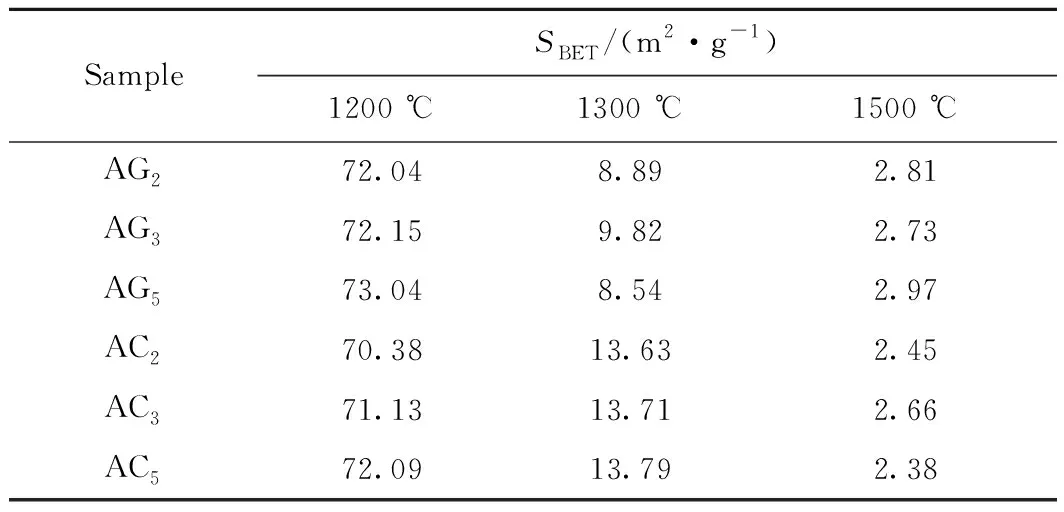
表3 不同反应温度下不同样品吸氮反应后制备出的AlN比表面积Table 3 The AlN specific surface areas of different samples after the N-adsorption reaction at different reaction temperatures
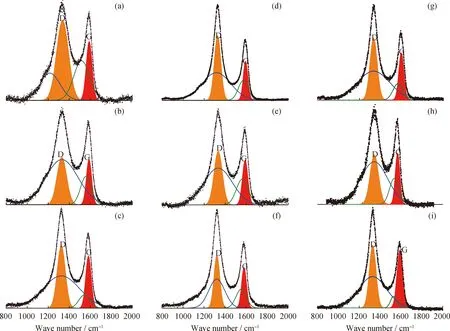
图3 以碳黑为碳源的不同产物中的碳的拉曼光谱分峰谱图Fig.3 Raman spectra of carbon in different products using carbon black as carbon sourceD—Amorphous carbon; G—Graphitized carbon(a) AC1, 1100 ℃, ID/IG=2.78; (b) AC1, 1300 ℃, ID/IG=1.91; (c) AC1, 1500 ℃, ID/IG=1.76; (d) AC3, 1100 ℃, ID/IG=2.34;(e) AC3, 1300 ℃, ID/IG=1.80; (f) AC3, 1500 ℃, ID/IG=1.53; (g) AC5, 1100 ℃, ID/IG=1.86; (h) AC5, 1300 ℃, ID/IG=1.78;(i) AC5, 1500 ℃, ID/IG=1.25
2.1.2 不同脱灰半焦对吸氮反应活性的影响
为进一步研究脱灰半焦的吸氮特性,利用实际煤炭制备的脱灰半焦为碳源开展吸氮实验,相同的反应工况下(反应温度为1200 ℃,n(Al2O3)/n(C)为3/3),其碳的转化率分别为31.3%、26.1%和21.8%,碳源的吸氮反应活性由大到小顺序为烟煤脱灰半焦、褐煤脱灰半焦、无烟煤脱灰半焦。这与图4中通过拉曼分析得到的3种脱灰半焦的无序化程度相对应,因此可推断不同煤种经预处理得到的脱灰半焦中的无序化碳结构有利于提高载氮体的吸氮反应活性。选取烟煤原煤进行热解和酸洗处理得到的脱灰半焦,其吸氮反应效果最好;然而与碳黑相比(见表2),其吸氮效率偏低。因此,可以通过改良热解方式来提升烟煤脱灰半焦中的无序化程度,以进一步提高碳的转化率,实现煤炭高效利用。

图4 3种脱灰半焦中碳的拉曼光谱分峰谱图Fig.4 Raman spectra of carbon in 3 types of deashing semi-cokesD—Amorphous carbon; G—Graphitized carbon(a) Bitumite, ID/IG=3.37; (b) Lignite, ID/IG=2.89; (c) Anthracite, ID/IG=2.70
图5为不同热解终温、热解升温速率以及热解气氛对烟煤半焦吸氮活性的影响。由图5看到,当热解升温速率和热解终温相同时,热解气氛对半焦吸氮反应活性有较为明显的影响。使用CO2气氛对烟煤原煤进行热解处理时,得到的半焦表现出最佳的吸氮活性。当热解终温为700 ℃、升温速率为 10 ℃/min 时,CO2气氛中碳的转化率能够达到39%。而相同条件下,N2气氛处理后碳的转化率只有30%。此外热解终温和热解升温速率的升高,均有利于半焦进行吸氮反应。综上所述,将烟煤在CO2气氛、热解终温为700 ℃、升温速率为10 ℃/min下,热解得到的半焦脱灰处理后,与氧化铝以摩尔比3∶3混合后表现出最好的吸氮特性。

图5 不同热解工况下烟煤半焦在吸氮反应中碳的转化率(X)Fig.5 The carbon conversion efficiency (X) of bitumite semi-coke during the N-adsorption reactionat different pyrolysis conditionsReaction conditions: m(C)=0.05 g;n(Al2O3)∶n(C)∶n(Y2O3)=3∶3∶0.03;N2 flow rate 100 mL/min; Reaction temperature 1200 ℃;Reaction time 30 min
2.2 AlN的释氮反应活性研究
载氮体的释氮行为是衡量载氮体是否适用于化学链制氨过程的又一重要因素。而AlN作为常用的半导体材料,其性能比较稳定[31],需要添加适量的催化剂或调节温度来提高NH3的产量及产率。
2.2.1 TiO2含量对TAN样品释氮的影响
释氮反应中NH3产量(nN)、AlN转化量(nA)和NH3产率(η)随TiO2含量的变化情况如图6所示。由图6可以看出,nN和nA随着TAN样品中TiO2质量分数的增加而不断增加。
已有报道表明[31],AlN晶体中Al—N键的断裂是释氮反应的速控步骤,直接限制了释氮反应的进行,向AlN表面引入羟基可以有效降低释氮反应活化能,促进AlN水解释氮。因此,向释氮反应体系中引入TiO2来促进水分子的解离吸附,提高体系中羟基含量,可促进AlN的水解。但由图6看到,增加TiO2的含量尽管对NH3的产量(nN)有促进作用,但对NH3的产率影响不大,换句话说,TiO2的加入对NH3的产率没有促进作用。根据释氮反应式(5),1 mol AlN理论上会产生1 mol NH3。然而,由于NH3的热力学稳定性较差,高温下极易分解为N2和H2,如式(6)所示。故释氮反应产生的NH3中一部分迅速分解成N2和H2,并达到一个稳定的动态平衡,从而导致NH3产量低于AlN转化量,NH3产率小于1。
(6)
因此,图6中虽然随着TiO2含量的增加,NH3产量不断增加,但同时受到NH3热力学平衡的限制,分解成N2和H2的部分也不断增加。为提高NH3的产率,以TiO2负载质量分数为80%的TAN样品为例,考察温度对NH3产率的影响。

图6 AlN释氮反应中NH3产量(nN)、AlN转化量(nA)和相应的NH3产率(η)随TiO2负载量的变化曲线Fig.6 The yields of NH3 (nN), the conversion amount of AlN (nA) and the corresponding NH3 generation efficiency (η) vs different TiO2 loadingsReaction conditions: m(AlN)=0.4 g; The total flow rates of H2O and Ar are 400 and 100 mL/min respectively;Reacting temperature 900 ℃;Reaction time 60 min
2.2.2 反应温度对掺混TiO2样品释氮的影响
温度是影响载氮体释氮反应的重要因素之一。无TiO2负载与80%质量分数TiO2负载的TAN样品在不同温度下的释氮特性如图7所示。由图7可以看出:在TiO2负载量相同的条件下,nN和nA均随着温度的升高而不断增加;但是无论有无TiO2负载的TAN样品,NH3的产率均随着温度的升高而降低。这是因为升高温度加速了NH3的分解。

图7 不同反应温度下有无负载TiO2时AlN释氮反应中NH3产量(nN)、AlN转化量(nA)和NH3产率(η)的变化Fig.7 The yields of NH3 (nN), the conversion amount ofAlN (nA) and the corresponding NH3 generation efficiency (η) with or without TiO2 under different temperaturesReaction conditions: m(AlN)=0.4 g; The total flow rates ofH2O and Ar are 400 and 100 mL/min respectively;Reaction time 60 min
因此,升高温度和添加TiO2都不是最佳选择。但是TiO2的加入,提高了体系中的羟基含量,促进了NH3的产量,因此,需要找到合适的催化剂,来进一步提高NH3的产率。ZrO2作为TiO2的同族氧化物,除了具有与TiO2相同的吸水性能(解离吸附水蒸气,提高羟基含量)[33-34],表面还富含L酸位,可有效吸附NH3,抑制其分解,从而提高NH3的产率[35]。
2.2.3 ZrO2含量对样品释氮的影响
图8为ZAN样品中不同ZrO2含量对载氮体释氮反应性能的影响。由图8可知,样品中ZrO2质量分数的增加并没有对AlN的转化率(nA)造成明显影响;NH3的产量和产率随着ZrO2质量分数的增加而增加,当ZrO2负载质量分数为80%时,NH3的产率可达到80%左右。

图8 不同ZrO2负载时NH3产量(nN)、AlN转化量(nA)和相应的NH3产率(η)的变化情况Fig.8 The yields of NH3 (nN), the conversion amount of AlN (nA) and the corresponding NH3 generation efficiency (η) under different ZrO2 loadingsReaction conditions: m(AlN)=0.4 g; The total flow rates ofH2O and Ar are 400 and 100 mL/min respectively;Reacting temperature 900 ℃; Reaction time 60 min
为探明ZrO2对NH3的影响,开展了NH3的分解特性研究。实验结果表明,25 ℃下,有、无ZrO2时,甲基红溶液变色总时间(取平均值)均最短(500 s),这意味着出口NH3浓度最大,分解量最少。然而,无ZrO2时,当NH3通过900 ℃的管式炉后,指示剂的变色时间增加至640 s。这是由于900 ℃的高温加速了NH3的分解,使出口NH3浓度降低。在900 ℃下,当炉膛内放入ZrO2粉末后,指示剂变色所需时间约为579 s。这说明ZrO2的存在可以在一定程度上降低NH3的分解速率,从而提高释氮反应中NH3的产量和产率。这种抑制作用并不能完全抵消高温对NH3分解的促进作用,因此该工况下的变色时间仍然比25 ℃下的变色时间长。
图9为ZrO2对NH3的保护机理。当无ZrO2时,如图9(a)所示,释氮反应中产生的NH3游离在高温管式炉中并迅速分解;当ZrO2存在时,如图9(b)所示,大量游离的NH3以分子吸附的方式在ZrO2表面吸附并转移,而这一部分NH3由于受到ZrO2对其分子吸附的保护而难以分解。
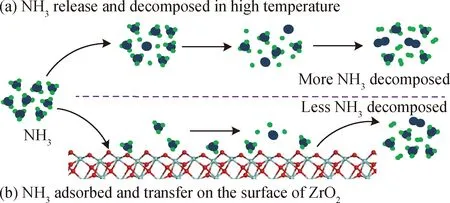
图9 ZrO2对NH3的保护机理Fig.9 The inhibition mechanism of ZrO2 to NH3
综上,ZrO2的存在使NH3在高温下自由解离的路径减少,对NH3形成了保护,抑制了NH3的分解,从而提高了释氮反应中的NH3产率。
3 结 论
对化学链制氨中的吸氮反应和释氮反应特性进行初步探究。结果表明:
(1)相比于石墨化碳结构,无序化碳结构能够促进载氮体吸氮反应的进行,而Al2O3与C的摩尔比为3∶3、吸氮反应温度为1200 ℃是制备出适用于化学链反应制氨的多孔型载氮体的最佳工况。
(2)利用烟煤、无烟煤、褐煤的脱灰半焦为碳源,发现烟煤对于吸氮反应的促进效果最好,并且通过优化对烟煤原煤的热解方式发现,选取烟煤原煤在CO2气氛下以10 ℃/min的升温速率上升至700 ℃进行热解,能够制备出适用于吸氮反应的烟煤半焦。
(3)研究了载氮体的释氮反应(氨气生成反应)特性,添加TiO2作为催化剂可明显提高氮化铝的转化率,但由于氨气的高温分解,导致氨气的产率不高。利用对氨气具有分子吸附能力的ZrO2为催化剂载体,使得载氮体在释氮反应中的氨气产率最高达到80%。
虽然氨气是一种清洁能源,且相应的合成技术(化学链反应制氨法)具有很好的发展前景,但是该方法目前仍有一些问题,例如,能否将制备出的适用于释氮反应的铝基载氮体与释氮反应催化剂(TiO2、ZrO2等)相结合,更重要的是,对载氮体进行循环特性和失活特性探究,并针对失效特性对铝基载氮体进一步优化。
