Fe基和Mn基载氮体的化学链合成氨特性
2020-03-04郭慧欣王宝仪沈来宏
郭慧欣, 王宝仪, 沈来宏
(东南大学 能源与环境学院 能源热转换及其过程测控教育部重点实验室,江苏 南京 210096)
氢能具有燃烧产物清洁无污染以及来源广泛的优点,目前氢能利用的终端产品如氢能源电池、氢能汽车已经逐步走入了大众的视野[1-3]。但氢气的能量密度(单位体积气体储存的能量,kJ/m3)低,为了保证安全,需要在136 MPa的高压条件下使用特殊金属材料对其进行运输和存储,苛刻的储运条件导致的高成本严重制约了其进一步的发展[4-6]。在这种情况下,氨能源作为一种能弥补氢能源劣势的能源载体获得了广泛的关注。
氨气具有特殊气味,在自然界中储量丰富、且不易发生积聚爆炸[7];其在低温条件下存储所消耗的能量仅为氢在同样条件下存储消耗能量的1/5,在运输、存储及使用方面具有低成本、高安全性和清洁无污染等优势[4]。此外,氨能源还是氢能的优良载体,其携带氢的能力可以达到17.8%(质量分数),很好地解决了氢能源在运输和存储方面的问题,因此大力发展氨能源的制备及应用具有十分重要的现实意义[8]。
哈伯法合成氨是工业合成氨的主要方法,哈伯-罗塞格尔于1909年首次从空气中获得氨,并于1918年获得了诺贝尔化学奖。该方法是指在高温(400~600 ℃)及高压(20~40 MPa)的环境中,在催化剂的催化作用下,氮气与氢气直接反应生成NH3的工艺[9]。但高温高压的反应条件使得该过程能耗高、污染严重,目前全球每年在工业合成氨领域产生的能源消耗量占世界能源消耗总量的3%。1918年至今的100年间,由于工业合成氨技术具有不可忽视的节能潜力,各国科研工作者提出了多种优化措施,如研发低压合成氨技术、尾气深度利用技术、优化催化剂组成以及在哈伯法基础上对合成氨技术路线进行创新等[10],但均未从根本上打破热力学限制,氨转化率始终维持在25%左右[11]。为进一步解决这一问题,近年来提出了合成氨与化学链技术耦合的概念,目的是从根本上突破合成氨技术的瓶颈。
图1为化学链合成氨原理示意图。由图1可知,在一定的反应条件下,氮化反应器内低价态金属氮化物MexNy-1与N2进行氮化反应,生成高价态金属氮化物MexNy:

图1 化学链合成氨原理示意图Fig.1 Principle of the chemical looping ammonia synthesis
(1)
高价态金属氮化物进入氨化反应器与H2进行氨化反应生成NH3及低价态金属氮化物MexNy-1:
(2)
上述过程中参与循环的金属氮化物即为载氮体,被还原后的MexNy-1返回氮化反应器,重复氮化过程,完成金属载氮体的再生。
笔者采用N2、H2直接参与反应的化学链合成氨技术,基于反应热力学分析及热重-质谱联用实验,分析了载氮体种类及反应温度对合成氨过程的影响,并为化学链合成氨技术的后续研究提供理论指导和可行性验证。
1 实验部分
1.1 实验原料
锰粉(Mn),分析纯,南京巨优科学器材有限公司产品;还原铁粉(Fe),分析纯,南京晚晴化玻有限公司产品。高纯氮(N2,质量分数不小于99.999%),广州盛盈气体有限公司产品;氢氩混合气,其中氢气质量分数5%,氩气质量分数95%,佛山德力梅塞尔气体有限公司产品。
Fe基与Mn基载氮体合成氨实验的原料为上述还原铁粉(Fe)及锰粉(Mn); Fe-Mn 基载氮体合成氨的实验原料为上述还原铁粉(Fe)与锰粉(Mn)以质量比2∶5(m(Fe)∶m(Mn)=2∶5)的比例进行机械混合制得。
1.2 实验装置与方法
1.2.1 TG-MS
采用德国NETZSCH公司STA 449F3型热重仪与德国Pfeiffer公司Oministar 200型质谱仪联用,对Fe基、Mn基及Fe-Mn基载氮体进行热重质谱(TG-MS)表征,具体方法如下:
采用程序升温的方法对金属单质的氮化过程和氨化过程进行表征,其中载气为Ar,气体流速为20 mL/min;反应气为H2、N2,气体流速均为30 mL/min。依据氮化与氨化过程中反应温度及反应时间的不同,将实验方案分为以下两种,具体步骤如下所述。
方案一:取Fe(或Mn)10 mg置于热重分析仪中,先在Ar环境下升温(速率20 ℃/min)至300 ℃,然后通入H2在300 ℃下进行恒温还原处理1 h,消耗可能存在的氧化物;随后通入N2,在N2环境下升温(速率5 ℃/min)至700 ℃进行升温氮化反应;最后在700 ℃的条件下通入H2与金属氮化物进行恒温氨化反应,并通过气相质谱分析仪在线检测生成的气体。
方案二:取Fe、Mn及Fe-Mn混合物各10 mg分别置于热重分析仪中,先在Ar环境下升温(速率20 ℃/min)至400 ℃,随后通入H2在400 ℃下进行恒温还原处理1 h,消耗可能存在的氧化物并在还原结束后通入Ar(速率20 mL/min)吹扫10 min;接下来在N2环境下升温(速率10 ℃/min)至 1000 ℃ 并恒温1 h,然后降温(速率20 ℃/min)至400 ℃(或700 ℃),通入N2的全程均进行氮化反应,随后使用Ar吹扫10 min;吹扫结束后在400 ℃(或700 ℃)的条件下通入H2与金属氮化物进行氨化反应,并通过气相质谱分析仪在线检测生成的气体。
1.2.2 HSC Chemistry 6.0计算
表1为Fe基、Mn基载氮体氮化反应及氨化反应方程。根据文献[15],常见的Fe基载氮体为Fe4N及Fe2N,常见的Mn基载氮体为Mn4N、Mn5N2及Mn3N2,依据表1所示的反应方程式,结合HSC Chemistry 6.0的计算结果对化学链合成氨过程进行反应热力学分析。

表1 Fe基、Mn基载氮体的氮化反应及氨化反应方程Table 1 N-sorption/desorption reactions of Fe and Mn based nitrogen carrier
2 结果与讨论
2.1 载氮体种类对化学链合成氨的影响
依据方案一所述步骤进行实验,得到的Fe基、Mn基载氮体的TG-MS曲线如图2所示。由图2(a)可知,Fe、Mn基载氮体在反应过程中均存在2个明显的质量变化区,分别为氮化阶段(400~700 ℃,Zone 1)以及氨化阶段(700 ℃恒温段,Zone 2)。

图2 Fe基、Mn基载氮体的TG-MS曲线Fig.2 TG measurements and mass spectra of Fe and Mn based nitrogen carriers(a) TG Measurements; (b) Mass Spectra TG of Fe based nitrogen carrier; TG of Mn based nitrogen carrier; MS of Fe based nitrogen; MS of Mn based nitrogen; Temperature
结合HSC Chemistry 6.0的计算结果可知,图2(a)中Zone 1温度段Mn基载氮体的质量增加主要是因其与N2发生了氮化反应(R5、R6、R7)。图2(a)中Zone 2恒温段为载氮体的氨化反应过程(Fe基载氮体:R3、R4;Mn基载氮体:R8、R9、R10)。由于该过程存在多步基元反应,载氮体中的N首先与活性氢原子(H*)依次形成活性基团NH*及NH2*附着在金属氮化物表面,故在进入Zone 2的前 40 min 内Mn基载氮体和Fe基载氮体仍然呈现质量增加的状态[16]。而在氨化反应开始40 min后Fe基载氮体出现了明显的质量损失。
图3为Fe基、Mn基载氮体氮化与氨化过程吉布斯自由能变化ΔG。由图3(b)可知,Mn基载氮体在400~700 ℃内反应R5及R7的吉布斯自由能变化ΔG始终小于0,反应极易发生,故Mn基载氮体具有良好的固氮性能,氮化过程结束时Mn基载氮体质量增加可以达到相同反应条件下Fe基载氮体质量增加的5倍。

图3 Fe基、Mn基载氮体氮化与氨化过程吉布斯自由能变化量ΔGFig.3 Gibbs free energy of Fe and Mn based nitrogen carriers in N-sorption/desorption reactions(a) Fe based nitrogen carrier; (b) Mn based nitrogen carrier
图4为Fe基、Mn基载氮体氮化与氨化过程化学反应平衡常数kp。由图4(b)可知,Fe基载氮体在0~700 ℃的氨化反应的反应平衡常数始终在10-1~105的范围内,远大于同温度下Mn基载氮体氨化反应的平衡常数(图4(d)),说明Fe-N之间的化学键较弱。在Fe基载氮体的氨化反应过程中检测到了NH3信号(图2(b)),可以证明Fe基载氮体与H2反应生成NH3是Zone 2恒温段出现质量损失的主要原因,故Fe基载氮体具有更好的氨化性能。

图4 Fe基、Mn基载氮体氮化与氨化过程化学反应平衡常数kpFig.4 Chemical equilibrium constant of Fe and Mn based nitrogen carriers in N-sorption/desorption reactions(a) N-sorption process of Fe based nitrogen carrier; (b) N-desorption process of Fe based nitrogen carrier;(c) N-sorption process of Mn based nitrogen carrier; (d) N-desorption process of Mn based nitrogen carrier
综上所述,载氮体的选择对氮化反应及氨化反应有着重要的影响,适宜的载氮体材料需要与N有较强的结合能力,易于与N结合生成高价态金属氮化物,同时其高价态金属氮化物与氨化气体H2有很好的亲和力,易于被还原,同时生成NH3。载氮体除了拥有上述优良的化学反应性能外,还应具有足够的机械强度、尽量低廉的成本以及对环境无害等诸多特性。其中Mn作为拥有多种价态氮化物的过渡金属,各价态间易于转化的特点也为金属氮化物的生成和还原提供了反应基础[17-18],故笔者采用过渡金属中的Fe、Mn单质及Fe-Mn混合物作为载氮体参与化学链合成氨反应。
2.2 反应温度对化学链合成氨的影响
依据方案二所述步骤进行实验得到的Fe基、Mn基及Fe-Mn基载氮体的TG-MS曲线如图5所示。图5(a)及图5(b)均存在两个明显的质量变化区,分别为氮化阶段(Zone 3)以及氨化阶段(Zone 4)。由图5(a)可知,当氮化温度为1000 ℃,氨化温度为400 ℃时,Zone 4恒温氨化段内Fe基载氮体的质量始终保持不变,此时过低的反应温度限制了氨化反应的进行。
由图5(b)可知,提高反应温度对氮化和氨化过程均有重要影响。与方案一的实验结果相比氮化反应温度升至1000 ℃并保持恒温1 h显著提高了氮化阶段载氮体总的质量增加;由图5(c)可知,当氨化温度为700 ℃时,Fe基载氮体及Fe-Mn基载氮体与H2发生氨化反应并生成了NH3,为防止NH3在高温下易分解,产量降低,将恒温氨化反应温度控制在700 ℃。
图5(b)中Zone 3氮化阶段过程结束时,Mn基载氮体的质量增加为同样反应条件下Fe基载氮体质量增加4.5倍,Fe-Mn基载氮体质量增加 1.2倍。但由于Mn的氮化反应是一个放热反应过程,温度升高在提高反应速率的同时对反应产生了抑制作用。提高温度使Mn基载氮体氮化反应平衡常数kp显著降低(图4(c));此时抑制作用成为了主要影响因素,氮化物生成速率变小,因此Mn基载氮体质量增加曲线随氮化反应温度升高而逐渐平缓。
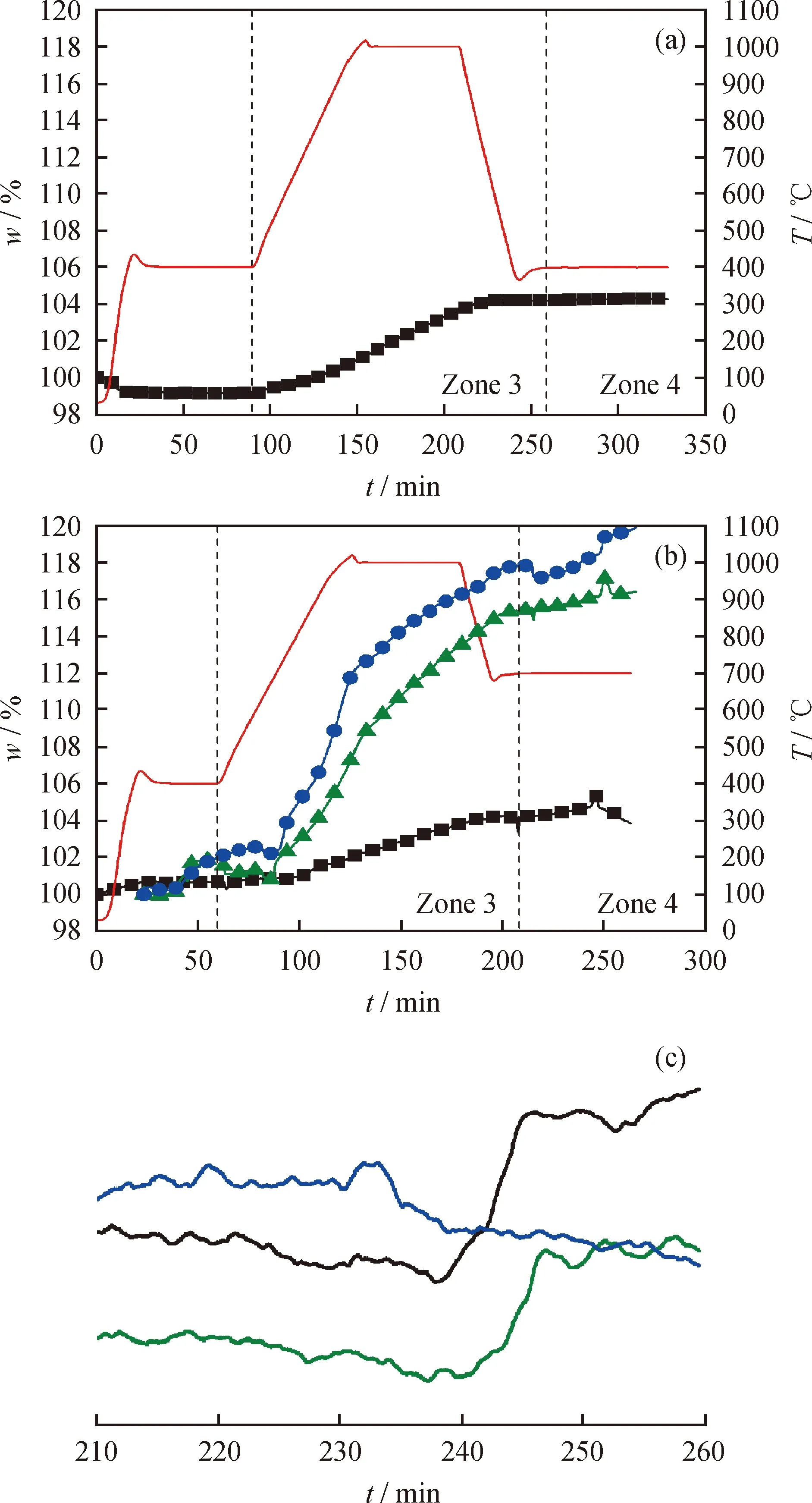
图5 Fe基、Mn基及Fe-Mn基载氮体的TG-MS曲线Fig.5 TG Measurements and mass spectra of Fe, Mn and Fe-Mn based nitrogen carriers(a) TG measurements of Fe based nitrogen carrier in ammonia synthesis process under 400 ℃;(b) TG measurements of Fe,Mn and Fe-Mn based nitrogen carriers in ammonia synthesis process under 700 ℃;(c) Mass spectra of Fe, Mn and Fe-Mn basednitrogen carriers in ammonia synthesis process TG of Mn based nitrogen carrier; TG of Fe based nitrogen; TG of Fe-Mn based nitrogen carrier; MS of Mn based nitrogen; MS of Fe based nitrogen; MS of Fe-Mn based nitrogen carrier; Temperature
综合考虑化学反应动力学与化学反应热力学的影响,后续实验将适当降低Mn的氮化反应温度、延长氮化时间以期获得更好的反应效果。
Fe-Mn基载氮体的氮化及氨化性能与单独使用其中一种金属的载氮体相比得到了提升,但提升效果较为有限。文中Fe-Mn基载氮体只是经过了简单的机械混合,后期需要通过改进制备方法来提高Fe-Mn间的协同作用,进一步优化反应过程。
TG-MS中检测到的质谱信号强度总体较弱,依据前文所述金属氮化物的还原可能存在多步反应,在还原时间较短时气体出口可能出现多种中间产物,并且NH3在高温条件下极易分解。因此在氨产量较小时易凝结附着在热重仪出口及其管路上导致质谱仪难以生成理想的气体产物峰,需要进一步调整实验方案获得更好的效果。
3 结 论
(1)对Fe、Mn基载氮体进行化学反应热力学分析和TG-MS联用实验,验证了化学链合成氨技术的可行性;
(2)Mn基载氮体具有良好的氮化性能,而Fe基载氮体的氨化性能更为突出。当Fe、Mn以质量比2∶5(m(Fe)∶m(Mn)=2∶5)的比例进行机械混合时,其氮化反应的质量增加高于Fe基载氮体的氮化反应质量增加;与Mn基载氮体相比,Fe-Mn 基载氮体在氨化反应阶段检测到了明显的NH3信号。
(3)适当提高氮化及氨化反应温度可以使各自的反应效果得到不同程度的提升,但温度过高时会对反应产生抑制作用。
