基于CuMn2O4载氧体的生物质化学链气化热力学分析
2020-03-04方瑞雪黄齐翔
方瑞雪, 黄齐翔, 刘 晶, 刘 丰
(1.华中科技大学 中欧清洁与可再生能源学院,湖北 武汉 430074;2.华中科技大学 煤燃烧国家重点实验室,湖北 武汉 430074)
生物质作为一种绿色清洁可再生能源,其产量丰富,含氢量大,N、S元素含量低,应用潜力巨大[1-2]。生物质气化过程将生物质能转换为清洁的气体燃料,是生物质能高效利用的重要途径[3]。传统生物质气化技术需要额外的制氧设备,气化成本较高,且工艺流程复杂。生物质化学链气化(Chemical looping gasification, CLG) 是一种新型的气化技术,载氧体中的晶格氧可以代替分子氧使生物质实现部分氧化,生成CO和H2,无需纯氧即可实现生物质能的高效转换。另外,载氧体也具有催化作用,可以促进焦油的分解[4-8]。因此,载氧体是生物质化学链气化技术的关键,其反应性能对整个反应系统的运行至关重要。
目前Mn、Cu、Fe、Co等过渡金属氧化物和钙钛矿型载氧体在生物质化学链气化技术中的研究较多[5,9-14]。其中,锰基载氧体载氧能力和高温抗烧结能力强,在其还原过程中还可以阻碍生物质中碳氢化合物的重组,通过促进C—H键与C—C键的断裂加速焦油中碳氢化合物的分解[15-16],因此在化学链气化技术中具有良好的应用前景[17]。然而锰基载氧体也有缺点,尽管其与H2或CO有较好的反应活性,但是其与CH4或固体燃料的反应活性较弱,且锰基载氧体易与大多数惰性载体如Al2O3、TiO2、SiO2等发生反应形成不可逆的产物而失活[18]。
针对锰基载氧体的不足,制备复合载氧体是优化其性能的有效方式[19-20]。陈智豪等[21]研究了MnFeO3和MnFe2O4作为载氧体的生物质化学链气化过程,结果表明,与相应的单金属载氧体相比,MnFeO3和MnFe2O4复合载氧体加速了稻草热解产物的析出以及焦炭的气化过程,提高了碳转化率,在水蒸气存在的情况下可显著提高H2和CO的产率,气化效率分别达到94.49%和92.76%。Wang等[18]发现以CuMn2O4为载氧体的化学链氧解耦燃烧中,Mn2O3和CuO的协同作用增强了CuMn2O4与生物炭的反应活性,而且流化床实验表明CuMn2O4具有良好的循环反应性能。Mungse等[22]研究表明,以CH4为燃料的化学链燃烧中,CuMn2O4载氧体的平均载氧量为114 mg/g,且随着循环次数增加,载氧量没有发生明显变化。上述研究表明,CuMn2O4在化学链技术中具有良好的应用前景,但是目前仍没有研究者开展基于CuMn2O4生物质化学链气化的研究。
热力学分析可以模拟理想条件下的反应过程,有助于获得系统适合的运行条件。笔者基于吉布斯自由能最小化原理,以松木屑为生物质原料,对其与CuMn2O4载氧体的化学链气化过程进行了热力学分析,研究了载氧体添加量、反应温度、水蒸气含量和CO2含量等反应条件对化学链气化系统性能的影响,从而得到系统运行的优化参数。
1 热力学计算方法
生物质化学链气化过程是基于传统生物质气化技术以及化学链燃烧技术发展而来,将整个气化过程的还原与氧化阶段分开,分别在燃料反应器和空气反应器中进行。在燃料反应器内,生物质利用载氧体提供的热量在高温下迅速热解,得到热解气、焦油和半焦产物。半焦产物与CuMn2O4载氧体接触发生气化反应制取合成气。在空气反应器内,被还原后的载氧体在空气气氛下被氧化恢复晶格氧,之后其作为氧和热的载体返回燃料反应器完成循环。
吉布斯自由能最小化方法是求解热力学平衡态的常用方法之一。其主要原理是:对于某一热化学反应系统,在恒温、恒压及不做膨胀功的条件下,其自发反应总是朝着吉布斯自由能方向减小的方向进行,当吉布斯自由能达到最小值时,该化学反应系统达到平衡状态。
对于有c个组分、π个相的多组分多相系统来说,当系统达到平衡时,其吉布斯自由能(G)达到最小,其表达式为式(1)、(2)。
(1)
约束条件为:
(2)
式(1)、(2)中:nij、μij分别为系统中不同物相j(j=1,…,π)中不同物质i(i=1,…,c)的物质的量和化学势,mol和kJ/mol;dli为组分i中元素l原子个数;bl为系统中l(l=1,…,me)元素的原子个数,me为元素种类数。
HSC Chemistry是世界上广泛使用的集成热力学数据库软件,基于吉布斯自由能最小化原理,计算一个复杂的物相系统在某一温度、压力等条件下的平衡状态以及该平衡状态下系统内各组分的含量。吉布斯自由能变化(ΔG,kJ/mol)可以衡量化学反应的进行方向及反应自发与否,ΔG的表达式为式(3)。
ΔG=ΔH-TΔS
(3)
式(3)中:ΔH、ΔS分别为反应的焓变(kJ/mol)和熵变(kJ/(mol·K));T为反应温度,K。当吉布斯自由能变化小于0,即ΔG<0时,该反应可以自发进行,且ΔG的绝对值越大,反应越容易进行[23]。
笔者选用松木屑作为生物质原料,其元素分析和工业分析结果如表1所示。根据元素分析得出生物质中C、H、O、N、S这5种元素的摩尔比为1∶1.5796∶0.6952∶0.0009∶0.0007,在热力学计算中将生物质物质的量设为1 kmol。在该气化系统中,燃料反应器内存在的元素为C、H、O、N、S、Cu和Mn,包含的组分如表2所示。利用HSC Chemistry 6.0软件“Reaction Equation”和“Equilibrium Compositions” 2个模块分别对CuMn2O4为载氧体的化学链气化过程中反应特性和组分演化进行热力学计算分析。

表1 松木屑的元素分析和工业分析结果Table 1 Ultimate analysis and proximate analysis of pine sawdust

表2 生物质化学链气化系统热力学计算中考虑的物相组分Table 2 Species considered in the thermodynamic calculationsof biomass chemical looping gasification
2 反应平衡热力学计算
依据该生物质化学链气化反应原理[4-5],分析多相系统内可能发生的化学反应,如式(5)~(60)所示。利用软件“Reaction Equation”模块计算各反应的ΔH和ΔG随温度的变化情况,再通过比较各反应的ΔG变化趋势,分析反应进行的难易程度。
生物质在高温下会发生热解反应,生成主要的产物为固体C和气体(CO2、CO、CH4、H2)。
CH1.59O0.7→C+Syngas(CO+H2+CH4+CO2)
ΔH>0
(4)
燃料反应器内载氧体可能与CH4发生的反应(T=1273 K)如式(5)~(15)所示。
CH4+4CuMn2O4→4Cu+4Mn2O3+CO2+2H2O
ΔH=466.9 kJ/mol
(5)
CH4+3CuMn2O4→3Cu+2Mn2O3+CO2+2H2O
ΔH=244.9 kJ/mol
(6)
CH4+2CuMn2O4→2Cu+4MnO+CO2+2H2O
ΔH=195.1 kJ/mol
(7)
CH4+CuMn2O4→Cu+2Mn+CO2+2H2O
ΔH=468.5 kJ/mol
(8)
3CH4+8CuMn2O4→4Cu2O+16MnO+
3CO2+6H2O ΔH=306.7 kJ/mol
(9)
CH4+8CuMn2O4→4Cu2O+8Mn2O3+
CO2+2H2O ΔH=1073.6 kJ/mol
(10)
5CH4+24CuMn2O4→12Cu2O+16Mn3O4+
5CO2+10H2O ΔH=475.8 kJ/mol
(11)
7CH4+8CuMn2O4→4Cu2O+16Mn+
7CO2+14H2O ΔH=971.9 kJ/mol
(12)
CH4+4CuMn2O4→4CuO+8MnO+CO2+2H2O
ΔH=601.7 kJ/mol
(13)
CH4+12CuMn2O4→12CuO+8Mn3O4+CO2+2H2O
ΔH=1614.5 kJ/mol
(14)
3CH4+4CuMn2O4→4CuO+8Mn+3CO2+6H2O
ΔH=695.1 kJ/mol
(15)
燃料反应器内载氧体可能与H2发生的反应(T=1273 K)如式(16)~(26)所示。
H2+CuMn2O4→Cu+Mn2O3+H2O
ΔH=68.3 kJ/mol
(16)
4H2+3CuMn2O4→3Cu+2Mn3O4+4H2O
ΔH=25.6 kJ/mol
(17)
2H2+CuMn2O4→Cu+2MnO+2H2O
ΔH=0.7 kJ/mol
(18)
4H2+CuMn2O4→Cu+2Mn+4H2O
ΔH=274.8 kJ/mol
(19)
3H2+2CuMn2O4→Cu2O+4MnO+3H2O
ΔH=84.8 kJ/mol
(20)
H2+2CuMn2O4→Cu2O+2Mn2O3+H2O
ΔH=220.0 kJ/mol
(21)
5H2+6CuMn2O4→3Cu2O+4Mn3O4+5H2O
ΔH=352.7 kJ/mol
(22)
7H2+2CuMn2O4→Cu2O+4Mn+7H2O
ΔH=633.0 kJ/mol
(23)
H2+CuMn2O4→CuO+2MnO+H2O
ΔH=102.0 kJ/mol
(24)
H2+3CuMn2O4→3CuO+2Mn3O4+H2O
ΔH=355.2 kJ/mol
(25)
3H2+CuMn2O4→CuO+2Mn+3H2O
ΔH=376.1 kJ/mol
(26)
燃料反应器内载氧体可能与CO发生的反应(T=1273 K)如式(27)~(37)所示。
CO+CuMn2O4→Cu+Mn2O3+CO2
ΔH=90.5 kJ/mol
(27)
4CO+3CuMn2O4→3Cu+2Mn3O4+4CO2
ΔH=38.8 kJ/mol
(28)
2CO+CuMn2O4→Cu+2MnO+2CO2
ΔH=-36.1 kJ/mol
(29)
4CO+CuMn2O4→Cu+2Mn+4CO2
ΔH=146.0 kJ/mol
(30)
3CO+2CuMn2O4→Cu2O+4MnO+3CO2
ΔH=-11.8 kJ/mol
(31)
CO+2CuMn2O4→Cu2O+2Mn2O3+CO2
ΔH=187.8 kJ/mol
(32)
5CO+6CuMn2O4→3Cu2O+4Mn3O4+5CO2
ΔH=191.7 kJ/mol
(33)
7CO+2CuMn2O4→Cu2O+4Mn+7CO2
ΔH=407.6 kJ/mol
(34)
CO+CuMn2O4→CuO+2MnO+CO2
ΔH=69.8 kJ/mol
(35)
CO+3CuMn2O4→3CuO+2Mn3O4+CO2
ΔH=323.0 kJ/mol
(36)
3CO+CuMn2O4→CuO+2Mn+3CO2
ΔH=279.5 kJ/mol
(37)
燃料反应器内载氧体可能与C发生的反应(T=1273 K)如式(38)~(48)所示。
C+2CuMn2O4→2Cu+2Mn2O3+CO2
ΔH=240.0 kJ/mol
(38)
2C+3CuMn2O4→3Cu+2Mn3O4+2CO2
ΔH=129.0 kJ/mol
(39)
C+CuMn2O4→Cu+2MnO+CO2
ΔH=104.1 kJ/mol
(40)
2C+CuMn2O4→Cu+2Mn+2CO2
ΔH=481.5 kJ/mol
(41)
3C+4CuMn2O4→2Cu2O+8MnO+3CO2
ΔH=239.8 kJ/mol
(42)
C+4CuMn2O4→2Cu2O+4Mn2O3+CO2
ΔH=543.3 kJ/mol
(43)
5C+12CuMn2O4→6Cu2O+8Mn3O4+5CO2
ΔH=244.4 kJ/mol
(44)
7C+4CuMn2O4→2Cu2O+8Mn+7CO2
ΔH=994.8 kJ/mol
(45)
C+2CuMn2O4→2CuO+4MnO+CO2
ΔH=-411.6 kJ/mol
(46)
C+6CuMn2O4→6CuO+4Mn3O4+CO2
ΔH=94.7 kJ/mol
(47)
3C+2CuMn2O4→2CuO+4Mn+3CO2
ΔH=-547.4 kJ/mol
(48)
此外,上述反应生成的CO2和H2O也可能会发生的反应(T=1273 K)如式(49)~(53)所示。
C+CO2→2CO ΔH=167.7 kJ/mol
(49)
C+H2O→CO+H2ΔH=135.6 kJ/mol
(50)
C+2H2O→CO2+2H2ΔH=103.4 kJ/mol
(51)
CO+H2O→CO2+H2ΔH=-32.2 kJ/mol
(52)
CH4+H2O→CO+3H2ΔH=225.84 kJ/mol
(53)
空气反应器内可能发生的反应(T=1323 K)如式(54)~(60)所示。
2Cu+O2→2CuO ΔH=295.90 kJ/mol
(54)
4Cu+O2→2Cu2O ΔH=152.27 kJ/mol
(55)
2Cu2O+O2→4CuO ΔH=260.05 kJ/mol
(56)
4Mn+3O2→2Mn2O3ΔH=1908.58 kJ/mol
(57)
4MnO+O2→2Mn2O3ΔH=363.34 kJ/mol
(58)
4Mn3O4+O2→6Mn2O3ΔH=191.25 kJ/mol
(59)
CuO+Mn2O3→CuMn2O4ΔH=169.61 kJ/mol
(60)
由上述分析可知,由于Mn、Cu有多种价态,且燃料反应器中不仅有热解、气化反应,还有水汽变换、重整等反应,因此生物质化学链气化是一个复杂过程,在燃料反应器内有多个反应相互竞争,最终的气化是多个反应相互协同和综合作用的结果。依据式(3),由软件“Reaction Equation”计算得到燃料反应器内各个反应的ΔG随温度变化趋势如图1所示。
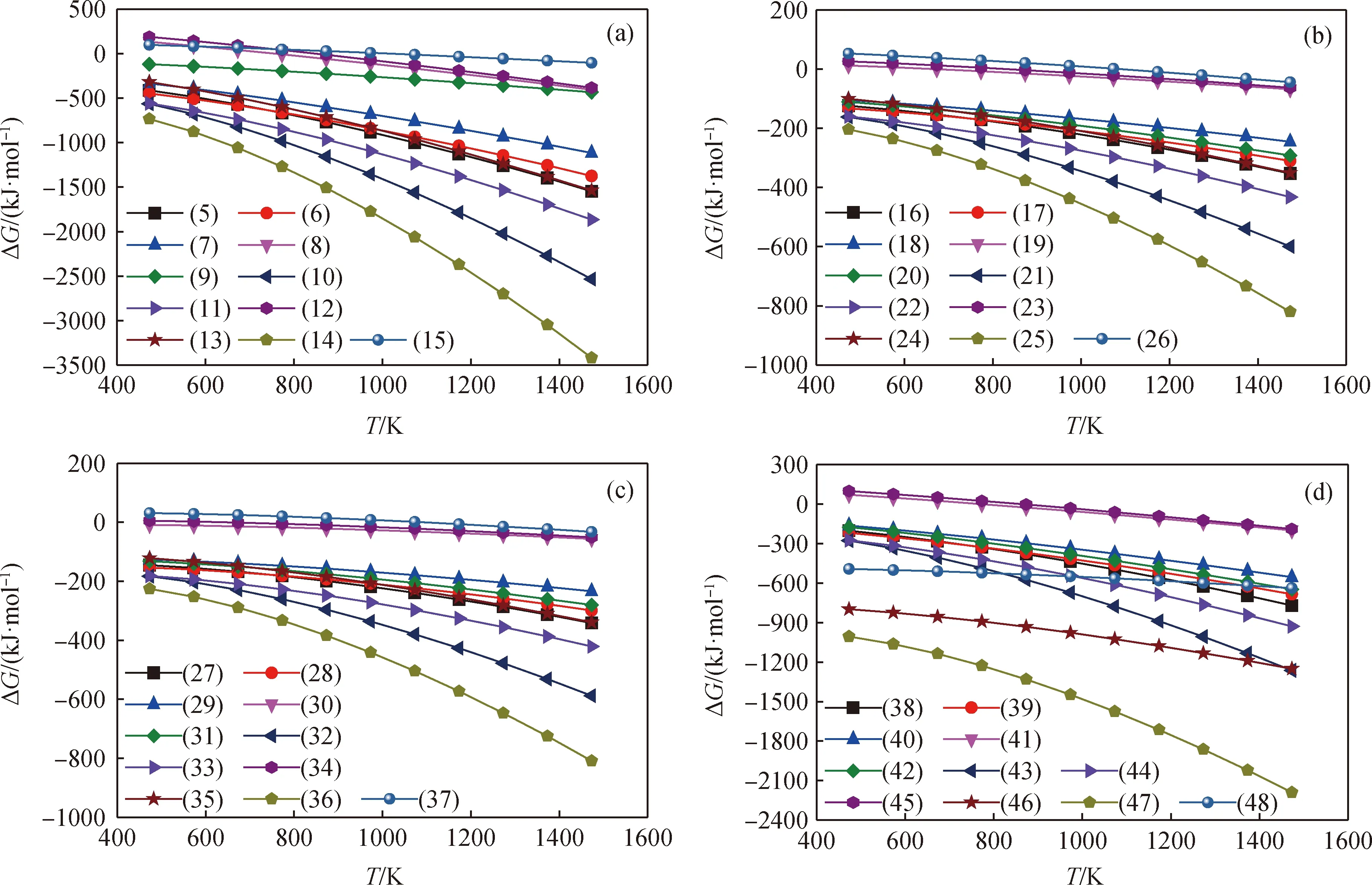
图1 燃料反应器内各反应ΔG随温度的变化趋势Fig.1 The change of ΔG with temperatures in the fuel reactor(a) Reactions of CH4 with CuMn2O4 (Reactions of (5)-(15)); (b) Reactions of H2 with CuMn2O4 (Reactions of (16)-(26));(c) Reactions of CO with CuMn2O4 (Reactions of (27)-(37)); (d) Reactions of C with CuMn2O4 (Reactions of (38)-(48))
反应(5)~(15)、(16)~(26)、(27)~(37)、(38)~(48)分别为CH4、H2、CO和C将CuMn2O4还原至不同程度的状态。从图1可知:这44个反应的ΔG大多小于0,温度越高,ΔG的绝对值越大,反应越容易发生。当CuMn2O4被CH4、H2、CO和C还原至相同状态时,如反应(14)、(25)、(36)和(47),CH4与CuMn2O4反应的ΔG最小,说明CH4与CuMn2O4的反应活性最高,CuMn2O4最容易被CH4还原。另外,反应(14)的ΔG小于反应(10),因此Mn2O3优先于CuO被还原;对比反应(25)和(21)、(36)和(32)、(47)和(43)的ΔG也可得出此结论。由图1(a)可知,当反应温度为1273 K时,CH4与CuMn2O4反应的产物都是Cu、H2O和CO2的情况下,ΔG从小到大的顺序为:反应(5)、反应(6)、反应(7)、反应(8),且反应(8)的ΔG约为0,可以得出CuMn2O4载氧体中Mn组分的还原过程为Mn2O3→Mn3O4→MnO,而MnO很难被还原成Mn单质。同样,对比反应(6)、(11)和(14)在1273 K时的ΔG,可知CuMn2O4载氧体中Cu组分的还原过程为CuO→Cu2O→Cu。图1(b)、(c)和(d)中CuMn2O4各组分的还原过程与图1(a)中的一致。
3 生物质化学链气化系统参数优化
在完成了对系统可能发生的化学反应的热平衡分析后,通过软件中“Equilibrium Compositions”模块计算,进一步分析反应条件对生物质化学链气化过程的影响。将碳转化率作为系统性能评价的主要指标,主要考虑了载氧体的添加量、燃料反应温度、水蒸气含量、CO2含量等条件对气化反应特性的影响,碳转化率(xC,%)按式(61)计算。
(61)
式(61)中:nC,s为半焦中碳的物质的量,mol;nC,b为松木屑中碳的物质的量,mol。
3.1 载氧体/生物质摩尔比(n(O)/n(B))对生物质化学链气化过程的影响
载氧体添加量是影响生物质化学链气化的重要因素,为了得到以不完全氧化产物(CO+H2)为主的合成气,必须严格控制载氧体的添加量。气化系统中,将燃料反应器温度设置为1273 K,生物质的量设置为1 kmol,CuMn2O4的初始量为0, 然后以0.04 kmol的增量逐步增至1 kmol,研究载氧体/生物质摩尔比(n(O)/n(B))对生物质化学链气化过程的影响,结果如图2所示。

图2 载氧体/生物质摩尔比(n(O)/n(B))对生物质化学链气化系统性能的影响Fig.2 Effects of molar ratio of the oxygen carrier to biomass (n(O)/n(B)) on chemical looping gasification(a) Gas content vs. n(O)/n(B); (b) Solid content vs. n(O)/n(B)Fuel reactor temperature: 1273 K; Amount of biomass: 1 kmol
由图2(a)可见,当n(O)/n(B)较低时,其提供给气化过程的晶格氧较少,氧化不够充分,合成气以目标产物CO和H2为主。随着n(O)/n(B)的增大,CO生成量先增大后减小,在n(O)/n(B)为0.16时达到最大;进一步增加n(O)/n(B),一部分CO被完全氧化生成CO2,CO产量逐渐降低,CO2产量增加。随着n(O)/n(B)的增大,H2产量逐渐减小,H2O产量逐渐增大。当n(O)/n(B)为0.56时,CO2和H2O产量均高于H2。这是因为随着载氧体含量的增加,其提供的晶格氧增加,促使生物质由部分氧化向完全氧化过渡,从而部分氧化产物含量降低,完全氧化产物含量升高。n(O)/n(B)在0~1范围时,CH4生成量几乎可忽略。这是因为CH4与CuMn2O4的反应及甲烷重整反应的ΔG较小,CH4在气化过程中被迅速消耗。从图2(a)可以看出,当不添加CuMn2O4时,CO和H2的总生成量为1.45 kmol,此时碳转化率为69.3%;当n(O)/n(B)为0.16时,CO和H2的总生成量达到最大值1.70 kmol,并且此时的碳转化率达到96.7%,是一个较为理想的气化状态。
由图2(b)可以看出,当n(O)/n(B)小于1时,其还原产物以Cu和MnO为主,并无单质锰存在。Mungse等[22]在以CH4为燃料、CuMn2O4为载氧体的化学链燃烧研究中发现,CuMn2O4的最终还原产物为Cu和MnO,与上述分析一致。当n(O)/n(B)大于1后,轻度还原产物Cu2O和Mn3O4开始产生;当n(O)/n(B)大于2.5之后,固体产物以Cu2O和Mn3O4为主,且Cu2O含量趋于稳定。
综合考虑,松木屑化学链气化系统中n(O)/n(B)优化值为0.16,此时目标产物CO和H2生成量最大,为1.70 kmol,增大碳转化率为96.7%。在实际系统中,载氧体不断交替地处于还原氧化气氛中,难以与模拟系统中载氧体一样被深度还原,因此实际系统中n(O)/n(B)应大于0.16。
3.2 燃料反应器温度对生物质化学链气化过程的影响
温度是影响化学链气化的另一重要因素。图3为生物质物质的量为1 kmol,n(O)/n(B)为0.16时燃料反应器温度对生物质化学链气化系统性能的影响。由图3可知,温度由873 K增加到1273 K时,CO生成量由0.15 kmol增加到0.94 kmol。其主要原因是生成CO的反应(生物质热解(4)、碳的气化反应(49)~(50)、CH4的重整反应(53))均为吸热反应,消耗CO的反应(还原反应(27)~(37)、水汽变换反应(52))均为放热反应。基于化学反应平衡移动原理,温度升高有利于CO的生成,因此温度升高时CO的生成量逐渐增大。

图3 燃料反应器温度对生物质化学链气化的影响Fig.3 Effects of fuel reactor temperatures on the chemical looping gasificationAmount of biomass: 1 kmol; n(O)/n(B): 0.16
与CO相比,H2的生成量随温度的变化不显著。这是因为生成H2的水汽转换反应(52)为较为温和的放热反应,温度的升高不利于H2的生成;尽管高温有利于水的重整反应生成H2,但也促进了H2与载氧体的还原反应,消耗了H2,综合作用使H2生成量随着温度变化不大。高温条件有利于焦炭的气化反应(49)正向进行,并且其反应速率大于载氧体的还原反应速率,因此CO2的生成量会随温度升高而减小。CH4生成量较低,其原因与3.1节所述一致。
随着温度的升高,生物质热解、气化反应速率增大,促进生物质中更多的碳和氢转化为CO和H2。碳转换率由873 K的48.6%增加到1273 K的96.7%。当温度超过1273 K后,合成气产量和碳转化率变化趋势不明显。说明当温度在1273 K以上时,反应温度对气化系统的影响不大,并且反应温度过高会增加气化系统的能耗,可能使载氧体烧结失去活性。因此,燃料反应器温度优化为1273 K。
3.3 水蒸气/生物质摩尔比(n(H2O)/n(B))对生物质化学链气化过程的影响
水蒸气不仅是生物质化学链气化反应的产物,也可以作为气化反应的气化剂,用来调整合成气中H2和CO的比例。图4为燃料反应器温度1273 K、生物质1 kmol,n(O)/n(B)为0.16时水蒸气/生物质摩尔比(n(H2O)/n(B))对生物质化学链气化过程的影响。由图4可知,随着n(H2O)/n(B)的增大,CO生成量减小,H2和CO2生成量逐渐增大。这是因为水蒸气含量增多,可以抑制载氧体的还原反应正向进行,同时使水汽平衡反应(52)正向移动。CH4生成量较小,其原因与3.1节所述相同。水蒸气可以作为气化介质为化学链气化过程提供额外的氧,促进了碳的转化,提高了碳转化率。但当n(H2O)/n(B)大于0.4时,合成气生成量无明显变化。同时,过量水蒸气增大了系统的压强,碳的转化受到抑制。

图4 水蒸气/生物质摩尔比(n(H2O)/n(B))对生物质化学链气化的影响Fig.4 Effects of steam to biomass molar ratio (n(H2O)/n(B))on the chemical looping gasificationFuel reactor temperature: 1273 K;Amount of biomass: 1 kmol; n(O)/n(B): 0.16
综上所述,水蒸气的引入有利于生物质的气化,提高合成气中n(H2)/n(CO),改善合成气品质。在实际的气化反应系统中,水蒸气过多会使反应器中混合气的体积流速升高,与载氧体的接触时间变短,反应不充分。此外,未参与反应的水蒸气会带走大量潜热,降低气化反应温度,从而影响系统的气化效率。因此,n(H2O)/n(B)要根据实际需要选择一个最佳值。n(H2O)/n(B)优化值为0.4。
3.4 CO2/生物质摩尔比(n(CO2)/n(B))对生物质化学链气化过程的影响
在传统生物质气化中,CO2也可以作为气化介质为固体燃料的转化提供一部分氧元素。图5为燃料反应器温度1273 K、生物质1 kmol、n(O)/n(B)为0.16 时CO2/生物质摩尔比(n(CO2)/n(B))对生物质化学链气化过程的影响。随着n(CO2)/n(B)的增大,CO与H2O生成量逐渐增大,H2生成量逐渐减小。这是因为CO2含量增大有利于碳的气化反应(49)正向进行,同时抑制了水汽平衡反应(52)正向进行。此外,CO2含量的增大也抑制了CO与载氧体的反应,从而有利于更多的载氧体与H2反应。这也是H2O生成量增大,H2生成量减小的原因之一。CH4生成量较低的原因与3.1节中所述一致。当n(CO2)/n(B)大于0.2后,合成气生成量的变化趋势不明显。这可能是因为n(CO2)/n(B)大于0.2时,生物质中的碳已基本转化为气体;而且随着n(CO2)/n(B)的增大,反应系统的压力增大,不利于气化反应的进行,导致H2的生成量降低,合成气的品质下降。由于CO2也能为生物质气化提供氧元素,因此载氧体被还原的程度降低。基于上述热力学分析综合考虑,本研究中n(CO2)/n(B)优化值为0.2。
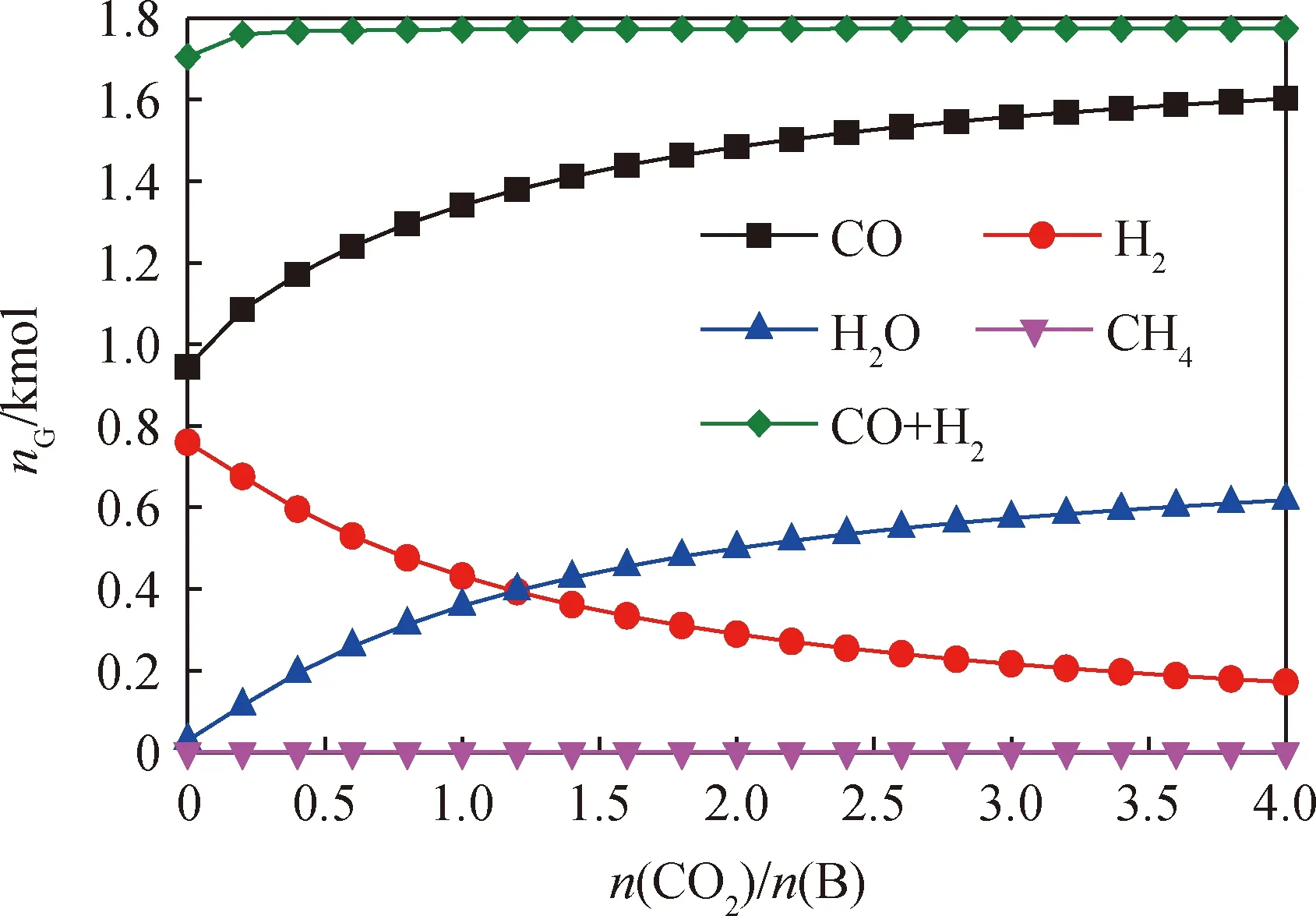
图5 CO2/生物质摩尔比(n(CO2)/n(B))对生物质化学链气化的影响Fig.5 Effects of CO2 to biomass molar ratio (n(CO2)/n(B)))on the chemical looping gasificationFuel reactor temperature: 1273 K;Amount of biomass: 1 kmol; n(O)/n(B): 0.16
3.5 晶格氧恢复过程
载氧体除了具有传递晶格氧和催化功能外,还具有一定的载热作用,它能将一部分热量从空气反应器中传递到燃料反应器,因此空气反应器中的温度一般要高于燃料反应器。基于此,在热力学计算中将空气反应器的温度设定为1323 K。图6为n(Cu)/n(MnO)=0.5时,O2含量对空气反应器内产物平衡组分的影响。
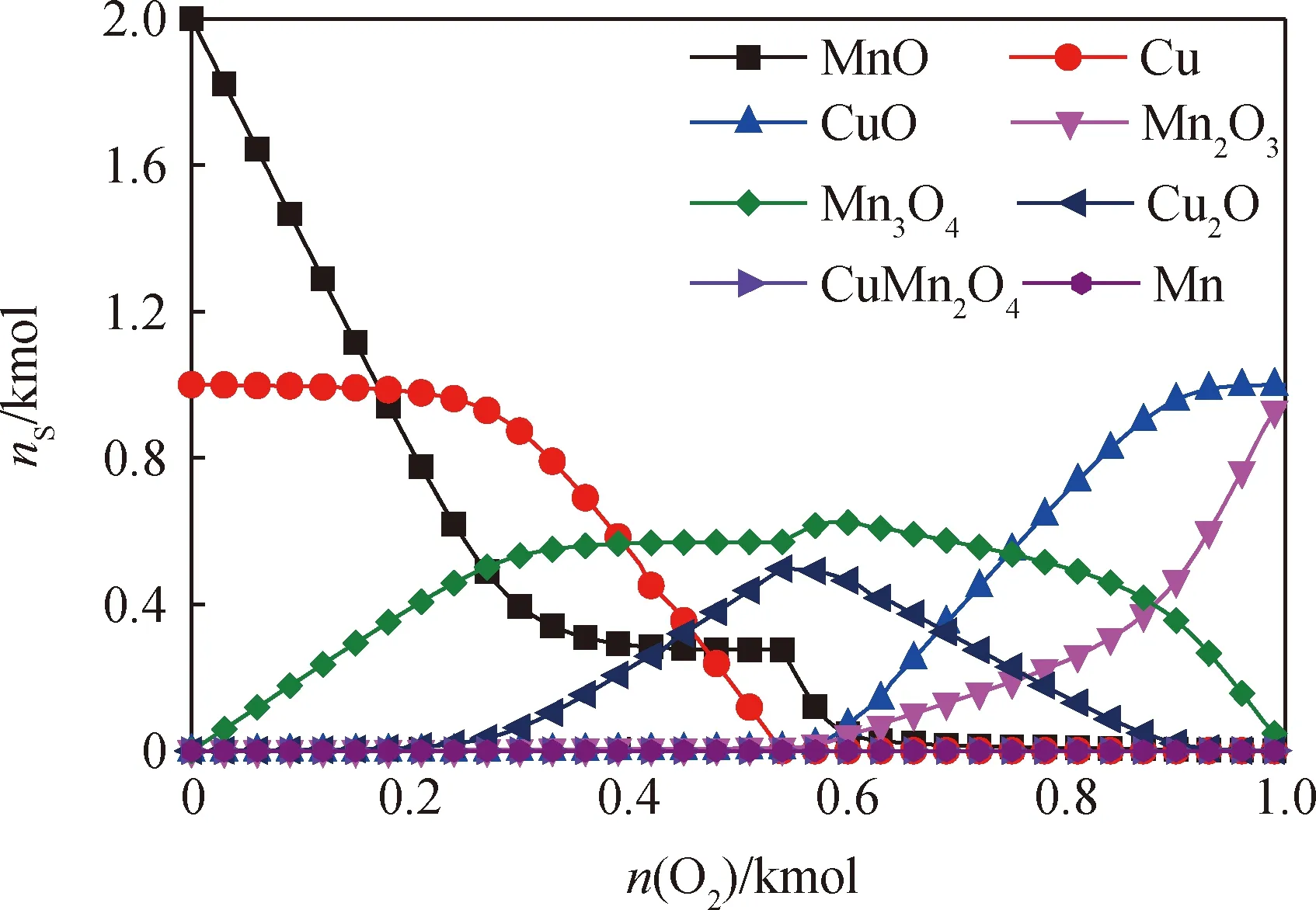
图6 O2含量对空气反应器内产物平衡组成的影响Fig.6 Effects of O2 content on equilibrium composition of the air reactorAir reactor temperature: 1323 K;n(MnO): 2 kmol; n(Cu)/n(MnO): 0.5
由图6可知,MnO要优先于Cu单质被氧化,当n(O2)小于0.2 kmol时,铜以Cu单质形式存在,MnO被氧化成Mn3O4。当n(O2)达到0.2 kmol时,Cu单质开始被氧化为Cu2O。当n(O2)为0.54 kmol时,Cu单质全部转化为Cu2O,此时,部分MnO开始被氧化为Mn2O3。当继续增加n(O2)时,Cu2O会被氧化成CuO,而MnO和Mn3O4被氧化为Mn2O3。当n(O2)达到1 kmol时,此时n(O2)/n(Cu)为1,最终产物为CuO和Mn2O3。这表明被还原的载氧体在空气气氛下具有恢复其晶格氧的倾向。被还原的CuMn2O4载氧体中Cu组分的氧化路径为Cu→Cu2O→CuO,Mn组分的氧化路径为MnO→Mn3O4→Mn2O3。
4 结 论
笔者建立了以CuMn2O4为载氧体、松木屑为燃料的生物质化学链气化模型,对气化系统进行了热力学模拟分析,获得了CuMn2O4与松木屑的气化反应特性,优化了系统的运行条件。主要结论如下:
(1)CuMn2O4载氧体中的晶格氧是逐级释放的,Mn2O3优先于CuO被还原,Cu组分的还原路径为CuO→Cu2O→Cu,Mn组分的还原路径为Mn2O3→Mn3O4→MnO,MnO很难被还原成Mn单质。
(2)燃料反应器内,以气化系统的碳转化率和合成气产量为主要评价指标,系统优化的反应条件:n(O)/n(B)为0.16,反应温度为1273 K,n(H2O)/n(B)为0.4,n(CO2)/n(B)为0.2。
(3)空气反应器内,当n(O2)/n(Cu)为1时,还原后载氧体的晶格氧具有完全恢复的倾向。
