硫酸盐硫在化学链燃烧过程中的迁移转化规律
2020-03-04张海燕周伦正
罗 明, 张海燕, 王 超, 周伦正
(1.江苏大学 能源与动力工程学院,江苏 镇江 212013;2.宁夏大学 省部共建煤炭高效利用与绿色化工国家重点实验室,宁夏 银川 750021)
经济社会的快速发展及人类活动的日益频繁,造成能源消耗量不断增加。目前煤炭仍然是中国主要的动力来源,然而煤炭在开采、运输和利用过程中均会造成严重的环境问题,如水污染和大气污染等[1]。SO2是燃煤污染物中的常见组分,频繁接触SO2会诱发心血管和呼吸系统疾病,给人类健康带来严重损害。化学链燃烧技术(CLC)是将传统的直接接触式燃烧借助载氧体而分解为2个气-固反应,燃料与空气无需接触,由载氧体将空气中的氧传递到燃料中[2]。此外,该技术属于无焰燃烧技术,可限制NOx的生成[3]。
受地域气候、地理等条件的影响,煤中硫的质量分数约为0.04%~9.62%[4]。硫是影响煤炭利用的主要因素之一。煤中的硫可能会对CLC过程产生影响:煤中硫可能会与载氧体发生反应,生成含硫化合物,降低载氧体反应活性、载氧能力甚至造成载氧体失活[5],还可能降低载氧体熔点从而造成烧结等[6];载氧体中的晶格氧也会将燃料中的硫氧化为含硫气体,从而影响燃料反应器出口CO2的纯度。
近年来,研究者主要针对煤中总硫在CLC中的转化行为进行探索[7-10]。然而,煤中硫的赋存形态多样,按赋存形态煤中硫可分为无机硫、有机硫以及少量单质硫[11]。无机硫又可分为硫化物硫和硫酸盐硫,其中硫酸盐硫主要以硫酸钙(CaSO4)和硫酸亚铁(FeSO4)的形式存在[12-15]。不同赋存形态的硫在CLC过程中的迁移转化规律不同,对载氧体以及环境的影响也有所不同。为了了解无机硫在CLC中的硫分布特性,笔者所在课题组前期针对不同载氧体条件下硫化物硫(FeS2)在化学链燃烧中的硫转化行为[16],以及3种含硫模型化合物(FeS2、CaSO4和FeSO4)在铁基载氧体作用下模化物中硫的转化规律进行了分析[17]。因载氧体种类影响含硫组分的分布规律,而Cu基载氧体具有良好的携氧能力和良好的反应活性[18-19],所以笔者研究在Cu基载氧体作用下硫酸盐硫在CLC中的迁移转化规律,并采用2种典型的模型化合物(FeSO4和CaSO4)作为研究对象。
笔者将2种模型化合物(FeSO4和CaSO4)分别担载在活性炭中作为实验样品,首先利用HSC Chemistry 5.0软件对CLC的还原反应阶段进行热力学模拟,考察关键运行参数对该阶段含硫物质分布规律的影响;其次,在小型间歇式流化床反应器中开展实验研究,考察CLC不同反应阶段中含硫气体的分布规律以及硫对不同载氧体的影响。
1 实验部分
1.1 试剂与原料
由于活性炭灰分和硫含量较低[20],所以选择活性炭粉末(AC)作为载体。使用粉煤机将活性炭磨碎,并筛选得到75~180 μm的粉末。选择七水硫酸亚铁(FeSO4·7H2O)和二水硫酸钙(CaSO4·2H2O)作为无机含硫化合物。采用机械研磨法将活性炭放入研钵中,分别加入一定量的FeSO4·7H2O或CaSO4·2H2O,在室温下进行研磨1 h。在活性炭中,FeSO4·7H2O和CaSO4·2H2O的担载质量分数均为5%。担载后的实验样品分别记作 AC-FeSO4和AC-CaSO4。实验所用的活性炭、二水硫酸钙、七水硫酸亚铁、三水硝酸铜、二氧化硅均为分析纯,由国药集团化学试剂有限公司提供。实验所用的Cu基载氧体采用浸渍法制备[21-22],惰性载体为SiO2。在制备过程中控制活性组分CuO与SiO2的质量比为1∶1。
实验样品的工业分析及元素分析如表1所示。

表1 实验样品的工业分析和元素分析Table 1 The proximate and ultimate analyses of samples
1.2 实验装置与步骤
如图1所示,实验在间歇式流化床反应系统上进行。反应器(内径32 mm;长度1200 mm)由不锈钢制成,距离底部500 mm设有多孔布风板。系统温度由电子控制器控制,由K型热电偶测量,采用质量流量计控制不同气体的流量。在预热系统中泵入蒸馏水产生蒸汽,生成的蒸汽被N2带到反应器中。输气管线和出口管线缠绕电加热带以避免水蒸气的冷凝。

图1 小型间歇式流化床反应系统Fig.1 The schematic diagram of the small batch fluidized bed reaction system
在CLC过程中,通过改变反应气氛模拟还原和氧化反应阶段。为防止燃料或载氧体颗粒泄漏,先在布风板上放置一定量的直径约为1.0~1.5 mm的石英砂颗粒,然后在石英砂颗粒上方放15 g的Cu基载氧体。首先以15 ℃/min的速率在空气中将载氧体加热至800 ℃,通入N2(600 mL/min)和蒸汽(0.241 g/min)的混合气流吹扫反应器15 min,然后将0.2 g实验样品送入反应器,开始还原反应阶段。还原反应阶段结束后,通入体积分数分别为95%N2和5%O2混合气体实现载氧体的再氧化,氧化过程的时间设定为20 min。不同反应阶段切换前均需进行15 min的N2吹扫以避免气体掺混。实验结束后,通入N2气体,待反应器温度降至室温后收集固相物质并分析。
从反应器出口产生的气体经干燥后通过气体收集袋进行取样。在实验的还原反应阶段,在第一个3.5 min内每隔30 s采样一次,采样时间间隔随着实验的继续而增大。用气相色谱仪(GC-7820,滕州鲁南分析仪器有限公司产品)分析实验过程中产生的气体成分和浓度,该色谱仪配有3个检测器,包括热导检测器、火焰离子化检测器和火焰光度检测器。实验过程无硫气体(O2、N2、CO、CO2、H2、CH4、C2H4和C2H6)和含硫气体(SO2、H2S、COS和CS2)的浓度均被检测。每次实验前,使用标准气体进行曲线校准。实验过程中的反应气体和吹扫气体的总体积流量为900 mL/min。
1.3 分析仪器与模拟软件
载氧体的性能表征是判断其是否适用于CLC过程的有效手段,采用日本日立公司S-3400 N型扫描电子显微镜(SEM-EDX)、德国Bruker公司D8 ADVANCE型X射线衍射仪(XRD)对载氧体进行表征。
笔者采用实验和模拟相结合的方法,对模型化合物在煤CLC过程中的化学反应进行了研究。采用热力学分析软件HSC Chemistry 5.0,该软件应用于许多不同类型的化学反应和平衡计算[23],笔者主要使用反应方程模块和平衡组成模块。
1.4 实验数据分析
在还原反应阶段,难以定量计算转化成固体或液相组分的硫酸盐硫的量,因此仅计算转化成气相组分的硫酸盐硫的量。该阶段硫酸盐硫转化为含硫气体硫的摩尔分数为:XS,g,red(%),其转化公式见式(1)。

(1)
其中:Nout为出口气体体积流量,mL/min;xi表示各物种的摩尔分数,%;mS为添加进反应器的实验样品中硫的质量,g。
在氧化反应阶段,向反应器中通入O2,在还原反应阶段未转化的硫或含硫物质可能被氧化成SO2。该阶段释放出的硫的摩尔分数为:XS,g,oxd(%),计算见式(2)。
(2)
2 结果与讨论
2.1 模型化合物在化学链燃烧过程中的热力学模拟
为获悉煤化学链燃烧过程模型化合物中的硫与载氧体的反应情况,采用HSC Chemistry 5.0软件对还原反应阶段硫的分布进行模拟讨论。模拟过程依然选择担载在活性炭中的模型化合物作为研究对象;采用水蒸气气氛,设定H2O和N2的体积比为1∶2,水和碳的摩尔比为4.0。考虑到活性炭的低硫低灰特性,简化起见将活性炭视作100%的C。载氧体采用CuO/SiO2,其中SiO2作为惰性组分不参与反应过程。根据2种模型化合物与C的质量比,可以确定AC-CaSO4、AC-FeSO4的原子组成分别为C14.13S0.058和C14.13S0.036。根据公式(3),载氧体与AC-CaSO4、AC-FeSO4的化学计量比分别为28.38、28.33。
CαSβ+(2α+2β)MxOy→
(2α+2β)MxOy-1+αCO2+βSO2
(3)
在CLC过程中,载氧体的量对反应过程也有一定的影响。定义载氧体过氧系数(R)为载氧体的实际摩尔流量与按照化学计量比计算得到的载氧体的理论摩尔流量之比。基于上述假设,分别在以下2种工况下进行模拟:(1)压力为0.1 MPa,调整反应温度(400~1200 ℃),研究反应温度对硫分布规律的影响;(2)压力0.1 MPa,设定反应温度,调整载氧体过氧系数(0.2~2.0),研究过氧系数对硫分布规律的影响。表2分别列出对应模拟计算过程所要考虑的物种。

表2 化学链燃烧过程在HSC计算系统中所包含的物种Table 2 Substances contained in the process of CLC in HSC
温度对硫分布的影响如图2所示。由图2可知,2种模型化合物反应系统内的含硫气体均以SO2的形式存在,未发现H2S的存在。对于FeSO4,在低温条件下,反应系统内存在硫化亚铜(Cu2S和Cu2S(C)),但高温会促进SO2的生成,在反应温度达到800 ℃左右时,FeSO4中的硫仅以SO2的形式存在。对于CaSO4,在低温条件下,未发现铜硫化物的存在,反应产物仅以SO2的形式存在,主要是由于高温促进了CaSO4分解反应的进行。综上所述,CuO具有良好的热力学性能,气相含硫物质以SO2为主,但以FeSO4为模型物时,低温条件下仍然有铜硫化物的存在。

图2 不同温度条件下含硫组分的物质的量Fig.2 The amount of sulfurous components at different temperatures(a) CaSO4; (b) FeSO4p=0.1 MPa; R=1
在800 ℃条件下,R对2种模型化合物在CLC过程中含硫组分的分布影响如图3所示。对于FeSO4而言,当R大于1.0时,反应系统内含硫组分主要为SO2。对于CaSO4而言,当R大于1.0时,反应系统内仅存在少量SO2,大部分硫以CaSO4的形式存在。当R小于0.9时,对于FeSO4,反应系统中含硫组分主要以铜硫化物(Cu2S和Cu2S(C))和少量的SO2的形式存在;对于CaSO4而言,反应系统中还存在微量的H2S。由此可见,在低过氧系数下CuO易被硫化生成Cu2S,在高过氧系数下,硫主要被氧化为SO2。

图3 不同过氧系数(R)条件下含硫组分的物质的量Fig.3 The moles of sulfurous components under different oxygen excess coefficients (R)(a) CaSO4; (b) FeSO4 T=800 ℃; p=0.1 MPa
2.2 模型化合物在化学链燃烧过程中硫的迁移转化规律
图4为在800 ℃条件下,担载在活性炭上的2种模型化合物为燃料时CLC还原反应阶段反应器出口的无硫气体摩尔分数曲线。当AC-CaSO4和 AC-FeSO4投入反应器后,会迅速发生活性炭的水蒸气气化反应,生成的合成气被载氧体氧化生成H2O和CO2。由图4可知,反应器出口处CO2在 1 min 内即达到摩尔分数峰值,随后摩尔分数下降。在反应时间为20.5 min时,当以AC-CaSO4模型化合物为燃料时,CO2、CO、H2和CH4的摩尔分数分别为75.66%、14.42%、9.28%和0.63%;而当以 AC-FeSO4模型化合物为燃料时,CO2、CO、H2和CH4的摩尔分数分别为74.00%、18.57%、7.11%和0.31%。反应器出口可燃性气体浓度较高,主要是由于合成气与载氧体接触较短,部分可燃气体未与载氧体反应而被带离反应器。
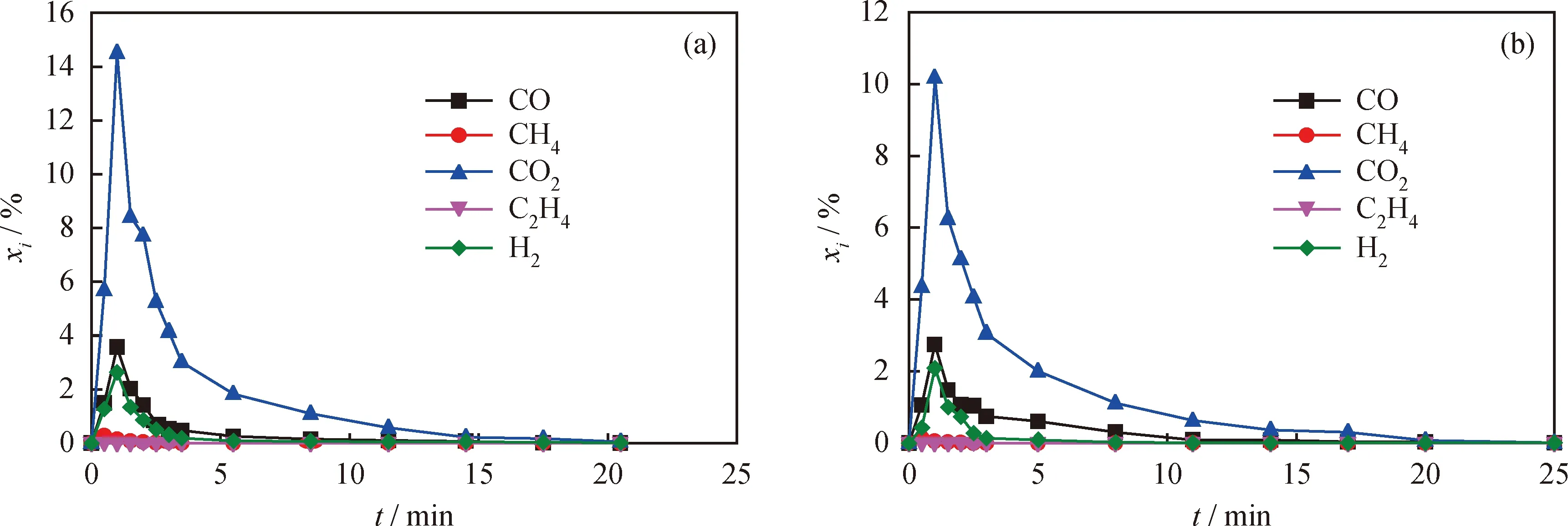
图4 CLC还原反应阶段的常规无硫气体摩尔分数曲线Fig.4 The sulfur-free gas release profiles during the reduction stage in CLC(a) AC-CaSO4; (b) AC-FeSO4 p=0.1 MPa; T=800 ℃; R=3.71
图5为800 ℃下,以担载在活性炭上的2种模型化合物为燃料时,CLC过程还原阶段含硫气体摩尔分数曲线。由图5可知,反应器出口处SO2在 1 min 内摩尔分数即达到峰值,随后下降。当 AC-CaSO4模型化合物为燃料时,SO2的摩尔分数峰值为254.69 μmol/mol;而当AC-FeSO4模型化合物为燃料时,SO2的摩尔分数峰值为213.22 μmol/mol。由图5知,SO2是主要的含硫物质,可能是由于生成的H2S和CS2被载氧体氧化所致。在前20.5 min内,AC-FeSO4中硫转化为气相组分的摩尔分数XS,g,red达到了83.16%,而 AC-CaSO4的XS,g,red仅为50.09%。由此可见,CaSO4比FeSO4有更高的稳定性。
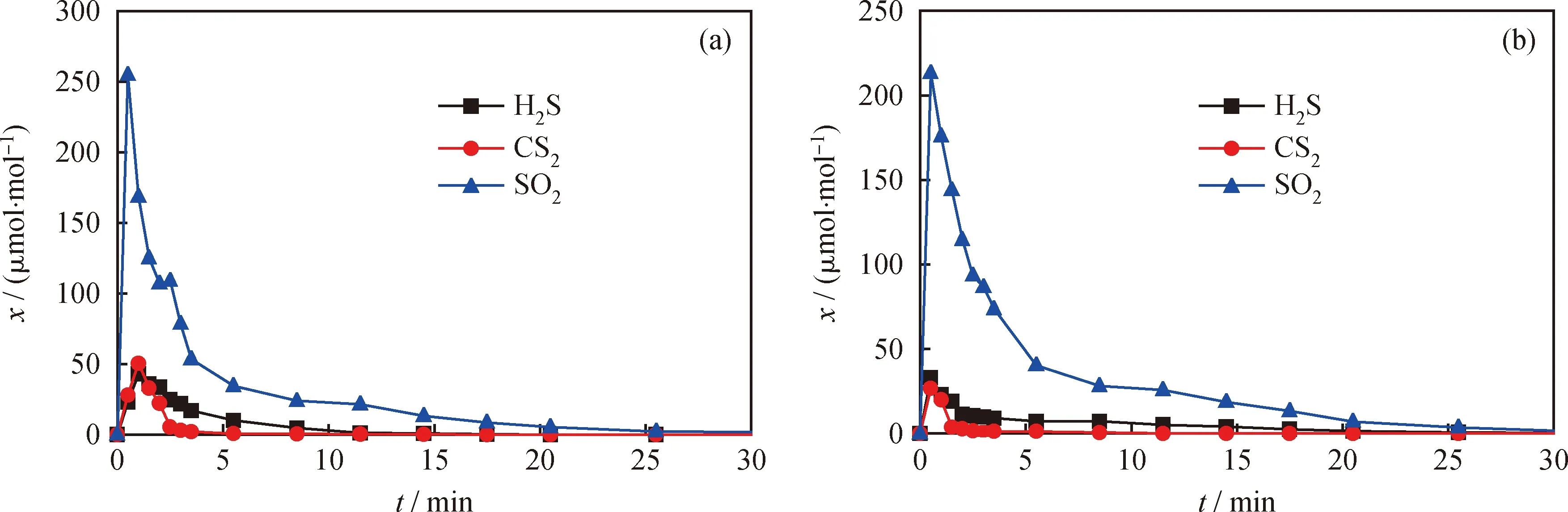
图5 CLC还原反应阶段的含硫气体摩尔分数曲线Fig.5 The sulfur gas release profiles during the reduction stage in CLC(a) AC-CaSO4; (b) AC-FeSO4 p=0.1 MPa; T=800 ℃; R=3.71
2种模型化合物800 ℃条件下氧化反应阶段含硫气体的浓度分布如图6所示。由图6可知,在整个氧化反应阶段未检测到H2S、CS2和COS,而在前6 min内有一个显著的SO2峰,是由于含硫固相组分的氧化所致。在氧化反应阶段的前 15.5 min 内, AC-CaSO4和AC-FeSO4的摩尔分数XS,g,oxd分别为10.90%和9.55%。

图6 CLC氧化反应阶段的气体摩尔分数曲线Fig.6 Gas release curves for the oxidation stage in CLC(a) AC-CaSO4; (b) AC-FeSO4 p=0.1 MPa; T=800 ℃; R=3.71
2.3 模型化合物在化学链燃烧中对载氧体的影响
为了解还原反应阶段模型化合物中的硫与载氧体之间的反应情况,对反应后的载氧体进行了XRD分析,如图7所示。2种模型化合物反应后,载氧体在2θ为20.90°、26.65°、39.51°、40.31°、45.81°、50.17°、60.01°时均出现了SiO2的衍射峰,在2θ为35.58°、38.74°、48.78°、66.29°、67.78°时均出现了CuO的衍射峰,在2θ为36.55°、42.47°、61.57°时均出现了Cu2O的衍射峰。这主要是由于载氧体是过量的,载氧体中部分CuO在高温条件下会被CO和H2还原为Cu2O(见反应式(4)和(5))。此外,在2θ为73.55°时出现了铜硫化物(Cu2S)的衍射峰。这与图3 中的模拟结果是一致的。铜硫化物(Cu2S)主要是由含硫气体与CuO反应生成的。此外,当以 AC-CaSO4模型化合物为燃料时,还原反应后载氧体中在2θ为71.47°时还出现了CaSO4的衍射峰。少量CaSO4的存在,可能是由于CaSO4具有较强的热稳定性,部分CaSO4未参与反应从而残留在载氧体中。

图7 还原反应阶段后载氧体的XRD图谱Fig.7 XRD patterns of the oxygen carriers after reduction stage
CO(g)+2CuO=Cu2O+CO2(g)
(4)
H2(g)+2CuO=Cu2O+H2O(g)
(5)
对一次还原-氧化之后载氧体表面进行 SEM-EDX 分析如图8所示,各元素的质量分数如表3所示。结果表明,当AC-CaSO4和AC-FeSO4模型化合物为燃料时,一次还原-氧化反应后载氧体颗粒表面硫元素的质量分数分别为0.94%和1.07%,表明仍然有部分硫在载氧体表面残留。因此,在实际工业应用过程中,当利用高硫煤时需要考虑硫在载氧体中的积累。

表3 一次还原-氧化反应后载氧体表面各元素的质量分数Table 3 Mass fractions of each element on the surface of the oxygen carrier after one redox process w/%
3 结 论
(1)采用模拟和实验相结合的方法,以2种典型的模型化合物(FeSO4和CaSO4)作为研究对象,研究了在铜基载氧体作用下硫酸盐硫在CLC中的迁移转化规律。
(2)热力学模拟分析发现,反应温度及载氧体过氧系数对模型化合物中硫的分布均有明显的影响。模型化合物中的硫对载氧体的硫化效果较强,在低温和低过氧系数条件下CuO极易被硫化生成Cu2S,从而降低载氧体中活化分子的含量。此外,CaSO4相比于FeSO4具有更强的耐温性,在不同温度及过氧系数条件下总会存在部分CaSO4。
(3)基于间歇式流化床实验发现,在还原反应阶段的前20.5 min内,AC-CaSO4和AC-FeSO4的摩尔分数XS,g,red分别达到50.09%和83.16%,氧化反应阶段的前15.5 min内摩尔分数XS,g,oxd分别达到10.90%和9.55%。当以FeSO4模型化合物为燃料时,在还原反应阶段结束后的载氧体中检测到了Cu2S的存在;当CaSO4模型化合物为燃料时未检测到铜硫化物,但发现了残余的CaSO4。表明与FeSO4相比,CaSO4具有更高的耐温性。当2种模型化合物分别为燃料时,经过一次还原-氧化反应后,对载氧体表面的元素进行EDX分析,均发现有部分硫累积及残留现象。
