杨树PtrRHH94突变体创制及功能初步分析
2020-03-03沈红梅程玉祥
沈红梅 程玉祥


摘要:RING-H2家族基因参与植物的多个生物学过程,PtrRHH94是毛果杨木质化组织内高丰度表达的RING-H2基因。为了探究PtrRHH94基因的功能,选择3组PtrRHH94待编辑靶位点,构建相应的Cas9/gRNA编辑载体,将其遗传转化毛果杨,得到10株转基因幼苗。DNA测序结果显示,7株转基因幼苗体内的PtrRHH94位点被编辑突变,3株植株被鉴定为PtrRHH94敲除突变体。与野生型毛果杨幼树相比,PtrRHH94突变体幼树株高增加,茎节数也增多。此外,PtrRHH94突变体木材的纤维长度与野生型相比没有显著差异,表明PtrRHH94参与了毛果杨茎生长的调控。
关键词:毛果杨;PtrRHH94;突变体;Cas9/gRNA编辑载体
中图分类号:S792.110.1文献标志码:A
文章编号:1002-1302(2020)22-044-05
作者简介:沈红梅(1994—),女,四川广安人,硕士研究生,主要从事林木遗传与育种研究。E-mail:shenhm@nefu.edu.cn。
通信作者:程玉祥,博士,教授,主要从事林木遗传与育种研究。E-mail:chengyuxiang@nefu.edu.cn。
RING基因是植物的一個超级基因家族,其编码的氨基酸含有8个保守的半胱氨酸/组氨酸残基(Cys-X2-Cys-X9-39-Cys-X1-3-His-X2-3-Cys/His-X2-Cys-X4-48-Cys-X2-Cys,X表示任意氨基酸),结合2个锌原子形成带状结构[1]。拟南芥、苹果及水稻等RING超级家族包括经典的RING型和修饰的RING型,经典的RING型分为RING-HC(C3HC4)、RING-H2(C3H2C3)亚家族,而修饰的RING型有RING-v、RING-D、RING-G、RING-S/T等[2-4]。RING-H2类型的基因成员数最多,预示其功能的重要性和复杂性。研究发现,拟南芥经典的RING型和修饰的RING型均有泛素连接酶E3活性[5]。据报道,RING-H2亚家族参与植物的多种生物学过程,如激素生物合成[6-8]、信号传导[9]、逆境响应及光形态建成[10-13]等。杨树有16个RING-H2成员,能在木质部组织内较特异或高丰度表达[14],但是目前这些基因的遗传功能尚未被鉴定。
PtrRHH94是这16个RING-H2成员之一,其启动子活性集中在毛果杨木质化的茎节组织[14],很可能参与其茎的生长发育。为了鉴定毛果杨PtrRHH94基因的功能,本研究拟构建PtrRHH94基因Cas9/gRNA编辑载体,用其遗传转化毛果杨,获得PtrRHH94基因位点被编辑突变的遗传材料,并基于突变体初步分析PtrRHH94基因的功能。
1材料与方法
1.1试验材料
用1月龄毛果杨组培苗进行遗传转化,将温室栽培至3月龄的毛果杨野生型及转基因幼树用于PtrRHH94基因突变表型分析。
1.2主要试剂
EXTaq、pMD18-T,购自TaKaRa公司;植物基因组DNA一步法试剂盒,购自Bioteke公司;SilicaBeadDNAGelExtrctionKit,购自ThermoScientific公司;E.Z.N.APlasmidMiniKit,购自Omega公司;KOD-plus,购自Toyobo公司;BsaⅠ、高浓度T4DNA连接酶,购自NewLab公司。
1.3试验方法
1.3.1植物基因组DNA的提取植物基因组DNA的提取材料为各毛果杨样品叶片,用液氮把叶片研磨成粉末,加入植物基因组DNA一步法试剂进行提取,具体操作参照其说明书。
1.3.2PCR扩增20μLPCR反应体系:13.5μL去离子水,2.0μLdNTP,2.0μL10×Buffer,0.5μLTaqDNA聚合酶,各0.5μL上下游引物,1.0μL模板。扩增条件:95℃5min;95℃30s,58~60℃30s,72℃1.5min,35个循环;72℃5min。PCR产物用1.5%琼脂糖凝胶电泳检测。
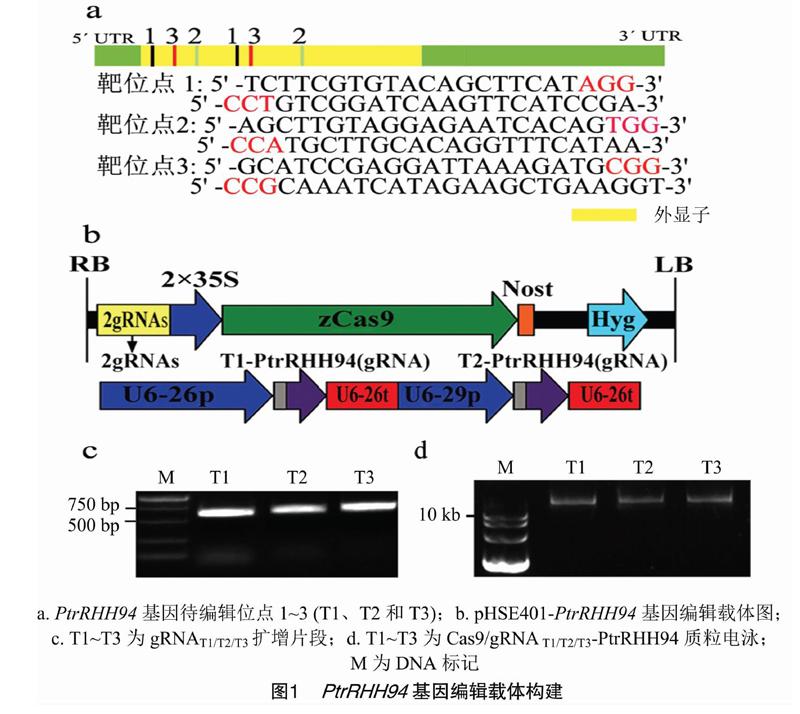
1.3.3PtrRHH94基因编辑载体的构建在扩增靶位点序列片段gRNAT1、gRNAT2和gRNAT3时,以稀释100倍的PCBC-DT1T2质粒为模板,DT1-BsF、DT2-BsR、DT1-F0和DT2-R0为引物,PCR扩增后,将产物用琼脂糖电泳区分,切下目的条带的胶,胶内回收的DNA片段经BsaⅠ酶切、T4DNA连接酶连接到植物基因编辑载体pHSE401[15]上。将连接产物转化DH5α大肠杆菌,筛选出含有pHSE401-gRNAT1/T2/T3的单菌落,经测序鉴定后,将阳性质粒导入GV3101农杆菌,用于毛果杨的转化。
1.3.4毛果杨遗传转化及转基因植株的鉴定毛果杨遗传转化采用农杆菌介导法[16],选择1月龄毛果杨幼苗,切取第2~3节茎段,长度约为1cm,用农杆菌侵染后黑暗共培养48h,用无菌水清洗茎段后,移至含有10mg/L潮霉素的分化培养基上。将抗性芽(25d)移至含有5mg/L潮霉素的生根培养基上。提取转化植株的基因组DNA作为模板,用zCas9-R/F、gRNAT1/T2/T3特异引物进行PCR扩增鉴定。
1.3.5转基因植株体内PtrRHH94基因靶位点的编辑鉴定以转基因植株基因组DNA为模板,用覆盖靶位点的PtrRHH94-R/F引物进行PCR扩增,产物胶回收后连接到pMD18-T载体上,并转化DH5α大肠杆菌。将筛选的阳性克隆进行DNA测序,再与野生型PtrRHH94基因序列进行对比,得到靶位点被编辑的情况。
1.3.6木材纤维长度的测量取样品幼树第20节茎段,剥去树皮,浸泡在解离液(10%硝酸+10%铬酸)中,60℃水浴7h,使纤维、导管细胞从木材组织上解离下来,用1%酸性品红染色后,在光学显微镜下测量纤维长度,每个样品共统计200个纤维细胞。
1.3.7数据分析采用SPSS17.0软件中的独立样本t检验法对株高、茎节数进行差异显著性分析,当P<0.05时,表示差异显著。用GraphpadPrism5.0软件对纤维长度分布情况进行制图。
1.3.8本研究所用引物本研究所用引物情况见表1。
2结果与分析
2.1pHSE401-PtrRHH94基因编辑载体的构建
PtrRHH94基因的突变通过Cas9/gRNA基因编辑技术来实现,在PtrRHH94基因外显子上设计并选出3个特异靶位点序列T1~T3(图1-a)。以pCBC-DT1T2质粒为模板,分别PCR扩增出带有特异靶位点序列的gRNAT1、gRNAT2和gRNAT3片段(图1-b)。分别割胶回收各片段,用BsaⅠ酶切后连接到pHSE401植物基因编辑载体上(图1-c)。将连接产物转化DH5α大肠杆菌,提取阳性菌落质粒,进行电泳检测(图1-d),测定插入片段的DNA序列,得到Cas9/gRNAT1/T2/T3-PtrRHH94编辑载体。将构建的载体导入GV3101农杆菌,用于随后的毛果杨遗传转化。
2.2Cas9/gRNA-PtrRHH94转化毛果杨及分子鉴定
以1月龄的毛果杨无菌苗为转化受体,經过侵染、抗性愈伤形成、抗性愈伤组织分化出芽、抗性芽生根的过程,转入Cas9/gRNAT1/T2/T3-PtrRHH94基因(图2-a~图2-f)。盆栽后共得到10个转基因抗性株系。以提取的抗性植株基因组DNA为模板,用zCas9引物进行PCR扩增鉴定。结果表明,未被转化的野生型(阴性对照)没有扩增出zCas9片段条带,而10株抗性植株均扩增出目标带(图2-g)。用gRNAT1/T2/T3引物进行鉴定,发现抗性植株均扩增出了目标条带(图2-h)。以上结果显示,这10株毛果杨抗性植株中均转入了Cas9/gRNAT1/T2/T3-PtrRHH94基因。
2.3靶基因PtrRHH94编辑突变分析
对10株转基因植株进行PtrRHH94基因靶位点编辑情况鉴定,在跨T1、T2、T3靶位点2端设计引物,扩增目标片段DNA,测序后与野生型进行对比。结果显示,7个株系的PtrRHH94基因均被编辑,其中PtrRHH94-T1-1#、PtrRHH94-T2-2#和PtrRHH94-T3-2#植株为双等位编辑(图3-a),这3个株系中PtrRHH94的部分碱基插入或删除后,导致PtrRHH94编码区提前产生终止密码子,推测其氨基酸远短于野生型PtrRHH94(图3-b),显示这3个株系为PtrRHH94基因敲除突变体。
2.4PtrRHH94基因敲除突变体的表型分析
对PtrRHH94-T1-1#、-T2-2#和-T3-2#敲除突变体进行无性扩繁后,与野生型毛果杨一起盆栽于温室中,进行表型分析与比较。与野生型植株(同为3月树龄)相比,3个不同株系的PtrRHH94突变体植株株高均显著于高于野生型植株(图4-a、图4-b)。为了探究PtrRHH94突变体植株变高的原因,统计植株茎节数,结果显示,3月树龄野生型植株的茎节数平均约23节,而3个不同株系突变体的茎节数均达到25节(图4-c)。为了探究植株变高是否与纤维细胞变长相关,分别统计野生型、PtrRHH94突变体木材200个纤维细胞的长度。结果显示,两者在不同长度纤维的分布与长度上均没有显著差异(图4-d),表明PtrRHH94突变体株变高与木质部组织细胞长度无显著相关性。
3结论与讨论
RING-H2亚家族参与了植物的多种生物学过程,然而在树木中,关于其功能的报道甚少。杨树存在多个木质部特异或高丰度表达RING-H2的成员[14],这些基因很可能参与树木木材形成(林木最主要的性状)。本研究中,笔者以PtrRHH94基因为对象,基于Cas9/gRNA基因编辑技术创制了多株毛果杨PtrRHH94基因突变体。不同株PtrRHH94突变体展示的表型是相同的,表明靶基因被Cas9/gRNA高效率地产生双等位编辑突变,形成了遗传学意义的基因敲除突变体。这个结果也显示,Cas9/gRNA基因编辑技术应用于毛果杨这个基因组最先被解读的模式树[17]是行之有效的。
PtrRHH94敲除突变体出现幼树株高增加现象,表明PtrRHH94参与毛果杨茎生长。进一步探知突变体木材不同长度纤维分布及其长度与野生型的均没有显著差异,且叶片等其他器官也未发现变大,仅突变体幼树的茎节数增多。据此推测,PtrRHH94参与毛果杨茎生长,很可能是通过调控茎的生长发育进程。植物RING-H2基因被报道具有泛素连接酶E3活性[5],PtrRHH94是否通过泛素化参与毛果杨茎生长发育有待被鉴定。植物泛素化途径介入的功能常常是起负调控作用[18-19],PtrRHH94敲除产生幼树变高也是负调控的特征。鉴于此,今后找出被PtrRHH94泛素化的靶蛋白,可为探明其参与毛果杨茎生长的分子作用模式提供参考。
参考文献:
[1]BordenKL.RINGdomains:masterbuildersofmolecularscaffolds?[J].JournalofMolecularBiology,2000,295(5):1103-1112.
[2]LiYZ,WuBJ,YuYL,etal.Genome-wideanalysisoftheRINGfingergenefamilyinapple[J].MolecularGeneticsandGenomics,2011,286(1):81-94.
[3]LimSD,YimWC,MoonJC,etal.AgenefamilyencodingRINGfingerproteinsinrice:theirexpansion,expressiondiversity,andco-expressedgenes[J].PlantMolecularBiology,2010,72(4/5):369-380.
[4]StoneSL,HauksdóttirH,TroyA,etal.FunctionalanalysisoftheRING-typeubiquitinligasefamilyofArabidopsis[J].PlantPhysiology,2005,137(1):13-30.
[5]RamadanA,NemotoK,SekiM,etal.Wheatgerm-basedproteinlibrariesforthefunctionalcharacterizationoftheArabidopsisE2ubiquitinconjugatingenzymesandtheRING-typeE3ubiquitinligaseenzymes[J].BMCPlantBiology,2015,15(1):275.
[6]LyzengaWJ,BoothJK,StoneSL.TheArabidopsisRING-typeE3ligaseXBAT32mediatestheproteasomaldegradationoftheethylenebiosyntheticenzyme,1-aminocyclopropane-1-carboxylatesynthase7[J].ThePlantJournal,2012,71(1):23-34.
[7]ThinesB,KatsirL,MelottoM,etal.JAZrepressorproteinsaretargetsoftheSCF(COI1)complexduringjasmonatesignaling[J].Nature,2007,448(7154):661-665.
[8]GuoH,EckerJR.PlantresponsestoethylenegasaremediatedbySCF(EBF1/EBF2)dependentproteolysisofEIN3transcriptionfactor[J].Cell,2003,115(6):667-677.
[9]GriffithsJ,MuraseK,RieuI,etal.GeneticcharacterizationandfunctionalanalysisoftheGID1gibberellinreceptorsinArabidopsis[J].ThePlantCell,2006,18(12):3399-3414.
[10]RobertsD,PedmaleUV,MorrowJ,etal.ModulationofphototropicresponsivenessinArabidopsisthroughubiquitinationofphototropin1bytheCUL3-RingE3ubiquitinligaseCRL3(NPH3)[J].ThePlantCell,2011,23(10):3627-3640.
[11]ChengMC,HsiehEJ,ChenJH,etal.ArabidopsisRGLG2,functioningasaRINGE3ligase,interactswithAtERF53andnegativelyregulatestheplantdroughtstressresponse[J].PlantPhysiology,2012,158(1):363-375.
[12]ChoSK,RyuMY,SeoDH,etal.TheArabidopsisRINGE3ubiquitinligaseAtAIRP2playscombinatoryroleswithAtAIRP1inabscisicacid-mediateddroughtstressresponses[J].PlantPhysiology,2011,157(4):2240-2257.
[13]GaoT,WuYR,ZhangYY,etal.OsSDIR1overexpressiongreatlyimprovesdroughttoleranceintransgenicrice[J].PlantMolecularBiology,2011,76(1/2):145-156.
[14]TongGM,ShenHM,CaoSQ,etal.IdentificationofRING-H2genecandidatesrelatedtowoodformationinpoplar[J].Forests,2019,10(8):698.
[15]XingHL,DongL,WangZP,etal.ACRISPR/Cas9toolkitformultiplexgenomeeditinginplants[J].BMCPlantBiology,2014,14(1):327.
[16]LiSJ,ZhenC,XuWJ,etal.Simple,rapidandefficienttransformationofgenotypeNisqually-1:abasictoolforthefirstsequencedmodeltree[J].ScientificReports,2017,7(1):2638.
[17]TuskanGA,DifazioS,JanssonS,etal.Thegenomeofblackcottonwood,Populustrichocarpa(Torr.&Gray)[J].Science,2006,313(5793):1596-1604.
[18]FengQ,YohS,TranLS,etal.ArabidopsisDREB2A-interactingproteinsfunctionasRINGE3ligasesandnegativelyregulateplantdroughtstress-responsivegeneexpression[J].ThePlantCell,2008,20(6):1693-1707.
[19]LiuLF,JinL,HuangXH,etal.OsRFPH2-10,aring-H2fingerE3ubiquitinligase,isinvolvedinriceantiviraldefenseintheearlystagesofricedwarfvirusinfection[J].MolecularPlant,2014,7(6):1057-1060.
