除草剂配施安全剂对土壤酶活性与糜子根系生理代谢的影响
2020-03-03赵颖楠林瑞嫦高小丽
冯 煜,赵颖楠,林瑞嫦,王 娜,高小丽
除草剂配施安全剂对土壤酶活性与糜子根系生理代谢的影响
冯 煜,赵颖楠,林瑞嫦,王 娜,高小丽※
(西北农林科技大学/旱区作物逆境生物学国家重点实验室,杨凌 712100)
为探究安全剂与除草剂复配施用对除草剂药害的缓解以及对糜子田土壤酶活性、根系活性氧代谢和糜子生长发育的影响。于2019年5-10月在陕西省榆林市小杂粮试验示范站进行试验,选用糜子品种‘榆糜2号’为试验材料,选取苗前除草剂:谷友(10%单嘧磺隆,2.4 kg/hm²)与3种安全剂:芸苔素(300 mL/hm2)、赤霉素(300 mL/hm2)、奈安(1.2 kg/hm2)复配使用,设置清水不除草对照与人工除草对照。测定杂草鲜重防效、药害指数、根际土壤酶活性、糜子根系抗氧化酶活性与丙二醛含量及糜子农艺性状与产量。结果表明:1)芸苔素、赤霉素、奈安与单嘧磺隆复配后药害指数显著下降,分别降低了20.27%、21.63%、20.94%;2)单嘧磺隆处理(H1)的土壤蔗糖酶、脲酶活性在施药后7~42 d时相较于不除草处理CK1被显著抑制,活性抑制率随时间降低,添加安全剂后土壤蔗糖酶和脲酶活性显著提升,抑制率显著降低;3)与单施除草剂相比,安全剂复配施用的糜子根系超氧化物歧化酶活性在施药后14~28 d时显著升高;过氧化氢酶活性显著降低;丙二醛含量明显降低;4)单嘧磺隆导致糜子株高、穗长、主穗质量降低,安全剂复配施用减少了除草剂的不利影响,其中单嘧磺隆与赤霉素复配施用产量最高,达5 035 kg/hm2,较CK1增产1 114 kg/hm2,较单施单嘧磺隆处理的增产1 061 kg/hm2。安全剂与单嘧磺隆复配使用能延缓单嘧磺隆对糜子根际土壤酶活性的抑制,提高土壤蔗糖酶、脲酶活性,提高糜子根系超氧化物歧化酶活性,减缓了药害胁迫造成的膜脂过氧化作用,减少细胞膜系统的损伤,延缓了根系衰老进程,提高了糜子的株高、茎粗、穗长、主穗质量及产量。其中赤霉素与单嘧磺隆复配使用在缓解除草剂药害,促进糜子增产方面效果较好。
除草剂;土壤;酶活性;安全剂;糜子;活性氧代谢
0 引 言
糜子(L.)属禾本科黍属(Panicum),又名黍、稷和糜,是中国干旱、半干旱地区重要的禾谷类作物,具有抗旱、耐贫瘠、耐盐碱、早熟等优良特性,且具有较高的营养价值和药用价值。随着水资源的日益紧缺,糜子作为抗旱节水作物,在农业上受到越来越多的重视[1-2]。因糜子属于直播密植作物,且播种后正是杂草的生长旺盛期和繁殖期,而传统人工除草成本高、效率低,所以除草剂的使用在糜子田间生产中具有重要意义[3]。研究发现苗前除草剂谷友(10%单嘧磺隆)在糜子田间生产中杂草防除效果好,明显提升了糜子产量[4]。但也有人研究发现,除草剂在杀死杂草,提升作物产量降低劳动成本的同时,亦会对作物产生一定的药害作用,对作物造成多种损伤,降低产量[5]。除草剂安全剂是一种与除草剂复配使用,本身对植物没有明显副作用,通过一系列植物体内的生理生化反应来消除或缓解除草剂药害的有机化合物[6]。研究显示,芸苔素与赤霉素可以有效缓解扑草净和草甘膦对棉花造成的药害[7]。奈安在缓解除草剂二甲四氯钠与烟嘧磺隆对玉米的药害作用上均有较好表现,使用后可显著提升受药害玉米叶绿素含量与最终产量[8]。
土壤是农药的主要载体,土壤酶活性是土壤环境变化的敏感指标,常与土壤农药污染、土壤理化性质具有关联性,代表了土壤中各种生化过程的强度和方向,常被作为土壤环境质量的指标[9]。农药在土壤中的生物降解主要通过土壤酶完成的[10]。除草剂在土壤中以溶液形式存在,被根系长时间吸收,导致根系生长发育受到影响,所以根系抗氧化物酶活性可以反映出植物根系受除草剂影响的程度[11]。研究显示,除草剂广佳安处理后的油菜根系,其超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)和抗坏血酸过氧化物酶(Ascorbate Peroxidase,APX)活性均受到不同程度抑制,上述生理代谢水平的改变是导致作物种苗根系生物量积累和形态建成受抑制的重要原因[12]。除草剂在生产上的安全使用,对农药科学使用降低点源污染[13]及糜子轻简化生产意义重大。因此本研究通过研究单嘧磺隆与安全剂复配施用后糜子田土壤酶活性与糜子根系抗氧化酶活性及产量的变化,探究提高除草剂安全性及提升除草剂高效利用的方法,以期为除草剂在糜子生产上的安全使用提供理论依据与技术支撑。
1 材料与方法
1.1 试验地概况
试验于2019年在陕西省榆林市小杂粮试验示范站进行(38°38′N,109°79′E),示范站地处黄土高原丘陵沟壑区,降雨主要集中在7-9月,年均降水量400 mm左右,约占全年降水量的61%。试验区为典型的干旱半干旱大陆性季风气候,年平均气温为11.0 ℃,最高气温36.3 ℃,最低气温−25.7 ℃。试验地土壤为黄绵土,地势平坦、肥力均匀,试验前耕层(0~20 cm)土壤pH值为8.27,含有机质4.8 g/kg、全氮0.31 g/kg、有效磷32.7 mg/kg、速效钾72 mg/kg。
1.2 试验设计
选用当地主栽糜子品种‘榆糜2号’为试验材料,选用苗前除草剂谷友(H1,主要成分:10%单嘧磺隆);3种安全剂:芸苔素(S1,东立信生物工程有限公司)、赤霉素(S2,东立信生物工程有限公司)、奈安(S3,河南远东生物工程有限公司)。根据本课题组前期除草剂筛选试验结果[14],单嘧磺隆浓度设置为2.4 kg/hm2,安全剂浓度参考田间推荐剂量。施用时将除草剂溶于水中,加入安全剂混匀,使用气压式喷雾器(苏州嘉达园林公司)6月13日播种后均匀喷施。设置2个对照(喷洒等量清水不除草CK1和人工除草CK2)。试验田间种植随机区组排列,小区面积10 m2(2 m×5 m),共6个处理,重复4次,共24个小区,5行区,行距40 cm,株距4 cm,基本苗4万株/hm2。田间管理同当地大田生产。具体药剂品种和用量见表1。
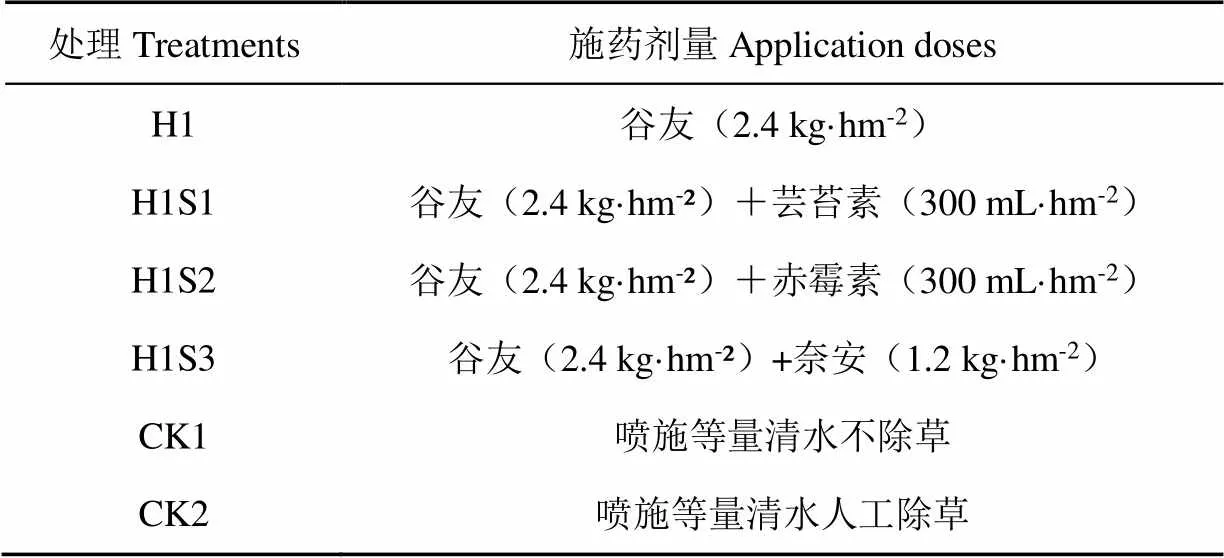
表1 试验处理
1.3 测定项目及方法
1.3.1 田间防效及药害指数调查
每个处理随机选取3个重复小区作为取样小区,用面积为0.25 m2的铁丝框(边长0.5 m)来随机取样,每个取样小区随机量取一个样点,将样点内全部杂草取回,称鲜质量。施药后15 d开始调查,每15 d调查1次,共调查5次。田间防效用鲜重防效标示,计算见式(1):
=(1−2)/1×100(1)
式中为鲜重防效,%;1为喷洒清水对照区杂草鲜质量,g;2为处理区杂草鲜质量,g。
喷药后14 d调查药害指数。药害分级标准参考字雪靖[14]的药害分级表,并结合试验实际药害情况进行适当调整。药害分级标准详见表2,根据各级药害的株数和总株数,计算药害指数,见式(2):


表2 药害分级标准
1.3.2 土壤酶活性测定
喷药后根据糜子生育进程确定取样时间(遇雨提前或推后)。分别于6月20日(喷药后7 d)、6月27日(喷药后14 d)、7月11日(喷药后28 d)、7月25日(喷药后 42 d)、8月22日(喷药后70 d)、9月17日(喷药后96 d)采集糜子根际土样。每次采集的糜子根际土样过2 mm筛,自然风干后保存用于测定酶活性。土壤脲酶活性用靛酚蓝比色法测定;土壤蔗糖酶活性用3,5-二硝基水杨酸比色法测定;土壤磷酸酶活性用磷酸苯二钠比色法测定;土壤过氧化氢酶活性用紫外分光光度法测定[15-16]。以清水对照CK1的土壤酶活性为对照,计算各处理对土壤酶活性的抑制率,见式(3):

1.3.3 糜子根系抗氧化酶活性及丙二醛含量测定
喷药后14 d开始取糜子根系,取样间隔时间同根际土壤取样。每次所取根系样品用水小心冲洗干净后用吸水纸吸干表面水分,然后保存在−80 ℃冰箱备用。超氧化物歧化酶(SOD)活性采用光照核黄素体系,氮蓝四唑(Nitro-Blue Tetrazolium,NBT)光还原法测定;过氧化氢酶(Catalase,CAT)活性采用紫外法测定;丙二醛(Maleicdialdehyde,MDA)含量测定采用硫代巴比妥酸法测定[17-19]。
1.3.4 糜子农艺性状
株高、茎粗及穗长测定:糜子成熟期每个处理取长势均匀的6株糜子植株进行测定。株高和穗长用直尺测量;茎粗用游标卡尺测量。主穗质量测定:将标记的糜子主穗去掉穗柄后用电子天平称取质量。产量测定:每小区取中间未取样行单收计产。
1.4 数据处理
采用Excel 2013软件对数据进行处理和绘图,SPSS19.0统计分析软件对数据进行差异显著性分析。表格数据用“平均值±标准误”表示。
2 结果与分析
2.1 单嘧磺隆配施安全剂对除草剂防效及药害的影响
由表3可以看出,除草剂与安全剂复配施用对除草剂的防效并无显著的影响,各处理杂草防效均能保持较高水平。除草剂与安全剂复配处理(H1S1、H1S2、H1S3)的药害指数均显著低于只喷除草剂处理(H1),分别下降了20.27%、21.63%、20.94%,说明安全剂与除草剂复配施用可以显著减轻除草剂对糜子的药害。
2.2 单嘧磺隆配施安全剂对根际土壤酶活性的影响
由图1可知,处理H1S1、H1S2、H1S3、H1的土壤蔗糖酶相较于清水对照表现为为先抑制后激活,处理CK2变化趋势为先激活后抑制。7~42 d时处理H1的土壤蔗糖酶活性均被抑制,其中7 d时抑制率最高,达76.49%;复配安全剂后,处理H1S1、H1S2、H1S3的土壤蔗糖酶抑制率显著下降,其中处理H1S2的抑制率最低,显著低于处理H1S1与H1S3,说明安全剂S2相较于S1、S3能更好的降低单嘧磺隆对土壤蔗糖酶活性的抑制影响。施药后96 d(成熟期)时处理除CK2外其余处理的土壤酶活性均被激活,其中H1S2激活率最高,H1S1激活率最低,分别为49.25%和1.46%,H1S1、H1S3激活率显著低于H1。对照CK2的蔗糖酶活性除了在96 d时被抑制,其余时期均被激活。

表3 糜子农田杂草鲜重防效和药害指数
注:不同小写字母表示不同处理间在 0.05 水平存在显著性差异,下同。
Note: Different lowercase letters indicate that there is a significant difference between the different treatments at 0.05 level, the same as below.
除草剂的土壤脲酶活性变化表现为抑制-激活-恢复,7~42 d时处理H1的脲酶活性被抑制,复配安全剂后处理H1S1、H1S2、H1S3的土壤脲酶活性的抑制率显著降低。施药后70 d时各处理脲酶活性均表现为激活,其中处理H1激活率最高,达51.24%,H1S3激活率最低,为3.76%。施药后96 d时,处理H1脲酶活性仍表现为激活,激活率对比70 d时下降了41.09%,H1S1、H1S2、H1S3脲酶活性均被抑制,抑制率分别为1.60%、1.28%、4.48%。说明除草剂在前期抑制了土壤脲酶活性,后期随时间逐渐恢复,添加安全剂可以减缓前期除草剂对土壤脲酶的抑制作用,使其更快的恢复到正常水平。其中安全剂S2添加后土壤的脲酶活性的恢复速度最快。
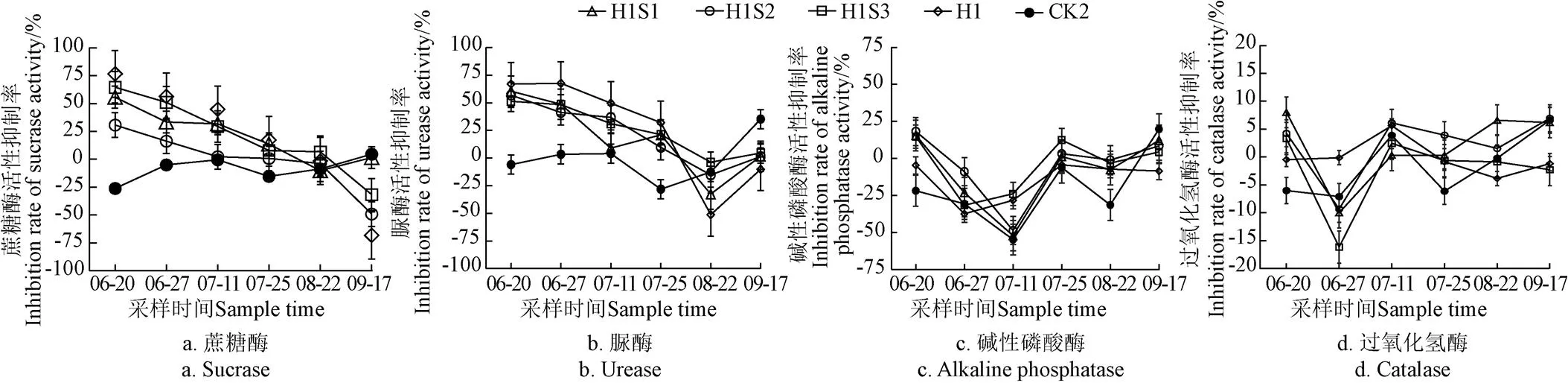
图1 土壤酶活性抑制率
除草剂激活了糜子田的土壤碱性磷酸酶活性,激活率变化趋势为上升-下降-上升,其中施药后14 d时激活率最高,为37.37%;复配安全剂的处理H1S1、H1S2、H1S3的碱性磷酸酶在施药后7、42、96 d时表现为抑制,14、28、70 d时表现为激活,3个处理在7 d时抑制率都达到最大值,为15.67%、18.21%、14.83%,28 d时激活率都达到最大值,为52.09%、48.61%、23.81%。处理CK2除了96 d时表现为抑制,其余时期均为激活。
处理H1的土壤过氧化氢酶活性变化表现为激活-抑制-激活,仅在施药后28 d时表现为抑制,且抑制率显著高于处理H1S1、H1S2、H1S3。处理H1S1、H1S2、H1S3的过氧化氢酶活性变化表现为抑制-激活-抑制,仅在施药后14 d时表现为激活,激活率显著高于处理H1,分别为10.01%、9.32%、16.13%;人工除草处理CK2相较于CK1表现为反复激活抑制。总体来看,土壤过氧化氢酶活性受各处理的影响相对较小。复配安全剂的处理(H1S1、H1S2、H1S3)的碱性磷酸酶和过氧化氢酶的活性变化趋势相同,但在不同时期激活/抑制率略有不同。
2.3 单嘧磺隆配施安全剂对糜子根系生理代谢的影响
由图2a可知,各处理根系SOD活性的变化趋势为降低-增加-降低,处理H1在施药后14~28 d时的SOD活性显著低于CK1,复配安全剂后处理H1S1、H1S2、H1S3的SOD活性显著高于H1。施药后42~70 d时处理H1的SOD活性显著高于CK1,复配安全剂后降低了糜子根系的SOD活性。施药后96 d(成熟期)时4个处理的SOD活性均显著低于2个对照。3种安全剂与除草剂复配对根系SOD活性的影响趋势是一致的,但不同安全剂处理间对糜子根系SOD活性的影响在不同时期略有不同。
如图2b所示,各处理的CAT活性随时间变化大致趋势为先升高再降低,在42 d时CAT活性达到最大值。施药后14~42 d时H1处理的根系CAT活性显著高于CK1,复配安全剂处理H1S1、H1S2、H1S3的CAT活性均有所下降。施药后96 d(成熟期)时4个处理的CAT活性均显著低于对照CK1。总体来看,添加安全剂处理的CAT活性除了70 d时的处理H1S1,其他时期均低于处理H1,3种安全剂处理间CAT的活性在不同时期略有不同。
如图2c所示,各处理的根系MDA含量随时间增加而上升,除草剂处理H1的根系MDA活性全生育期均显著高于对照CK1,复配安全剂后根系MDA含量显著下降,接近对照CK1和CK2。安全剂S2添加后,在28、42、70 d时处理H1S2的MDA含量在3个安全剂处理中最小,效果相对较好。
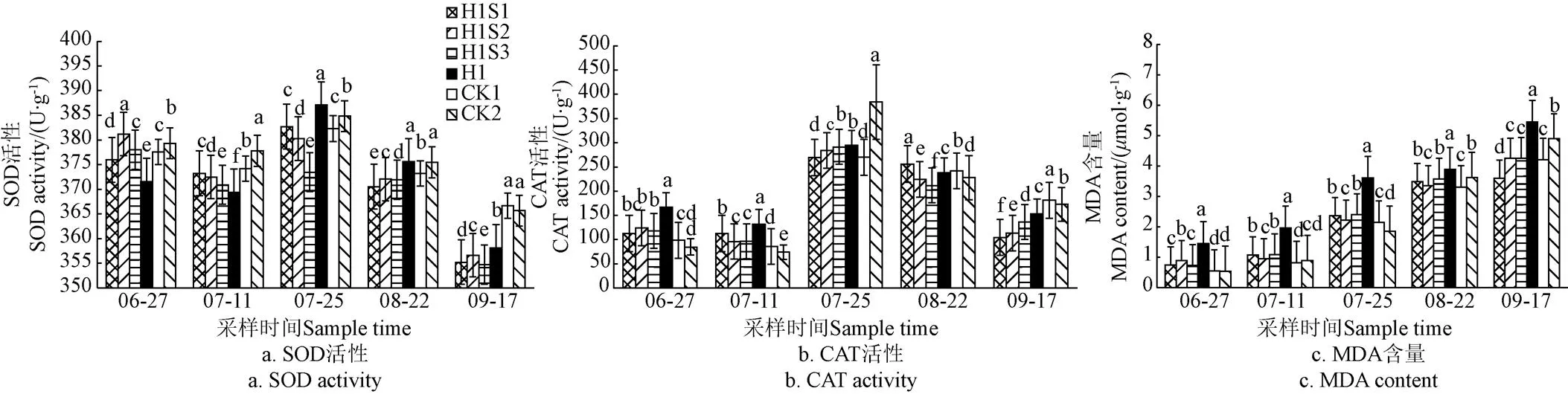
注:SOD为超氧化物歧化酶;CAT为过氧化氢酶;MDA为丙二醛。
2.3 单嘧磺隆配施安全剂对糜子农艺性状和产量的影响
由表4可知,喷施除草剂后糜子株高被明显抑制,处理H1的株高显著低于对照CK1与CK2,处理CK2的株高显著高于其他处理。安全剂与除草剂复配施用的处理H1S1、H1S2、H1S3株高均比处理CK1高,且显著高于处理H1,说明苗前除草剂会显著抑制糜子的株高,安全剂与除草剂复配施用能显著减少除草剂对株高的影响。只喷施除草剂处理H1的茎粗均低于添加安全剂的处理(H1S1、H1S2、H1S3),但高于CK1,安全剂与除草剂复配施用后,相较于处理H1糜子茎粗有明显改善,与CK2相近。各处理穗长间差异不显著,但处理H1穗长最低,添加安全剂在一定程度上减少了除草剂对糜子穗长的影响。

表4 糜子农艺性状和产量
如表4所示,人工除草对照CK2主穗质量最大,达24.96 g,处理H1最小,为19.15 g,安全剂与除草剂复配处理H1S1、H1S2、H1S3主穗质量均高于处理H1。从产量来看,不除草处理CK1产量最低,仅有3 921 kg/hm2,人工除草处理CK2产量最高,达5 456 kg/hm2,处理H1产量仅高于CK1,低于安全剂与除草剂复配处理。安全剂与除草剂复配处理的H1S2、H1S3的产量显著高于仅喷除草剂处理H1和清水对照CK1,其中H1S2产量达5 035 kg/hm2,较H1增产1 061 kg/hm2,较CK1增产1 114 kg/hm2。由此可以看出,安全剂与除草剂复配施用能明显改善除草剂对糜子农艺性状的影响,缓解除草剂对糜子产生的药害,提高糜子产量,增加经济效益。
3 讨 论
大量研究表明,除草剂、杀虫剂等各种化学药剂都会对土壤酶活性产生明显的影响,化学药剂与土壤酶之间产生的互作影响极其复杂,不同的除草剂对土壤酶活性的影响也不尽相同,一种化学药剂或许是一种土壤酶的激活剂,也是另一种酶的抑制剂[20-23]。当有机污染物进入土壤后需要经过一系列过程才能降解,其中生物降解主要依赖于土壤酶[24]。Feng等[25]研究表明,在污染土壤修复过程中,酶活性的变化不仅反映土壤生态系统功能的恢复,也反映修复所用方法及材料在不同土壤的相互作用对土壤微生物及酶的影响。常用于农药修复的主要是水解酶和氧化还原酶,其中包括了脲酶、磷酸酶和过氧化氢酶。
研究土壤蔗糖酶活性变化有利于了解土壤肥力变化及农药对土壤生态环境的影响,而土壤生态环境对农药的生物降解具有重要意义[26-27]。脲酶是作用专一的酰胺酶,它仅能将尿素水解,将土壤中的有机氮水解为氨态氮,使植物所需的养分转化为有效态[28]。刘丹丹等[29]研究发现除草剂莠去津在土壤中的降解需要由脲酶等6种酶与莠去津降解菌sp.共同完成。本研究表明喷施除草剂单嘧磺隆后对土壤蔗糖酶和脲酶活性在前中期产生显著的抑制作用,添加安全剂后这种抑制作用被明显减轻,到了后期由于除草剂降解,蔗糖酶活性被激活;添加安全剂处理的脲酶活性均有所下降,表明添加安全剂后可以使除草剂对土壤蔗糖酶和脲酶活性的不利影响更快的恢复,这有助于除草剂在土壤中的生物降解。其中安全剂赤霉素相比芸苔素、奈安能更好的减小除草剂对蔗糖酶的抑制作用,并更快的使脲酶活性恢复正常水平。土壤磷酸酶可以将繁杂的有机磷水解成能被直接吸收的无机磷,在土壤磷流动中发挥着十分重要的作用[30-31]。本研究表明,除草剂对土壤中的碱性磷酸酶活性有激活作用,添加安全剂后,对碱性磷酸酶活性的影响表现为反复的抑制-激活。土壤中的过氧化氢酶作为农药生物降解的重要氧化还原酶,本研究中各处理的土壤过氧化氢酶活性也表现为反复抑制-激活,但抑制/激活率相对较低,表明除草剂与安全剂对土壤过氧化氢酶活性的影响较小,这与周世雄等[32]的研究结果相近。本研究结果表明,安全剂的使用可以减少除草剂单嘧磺隆对糜子田土壤产生的负面影响,使其土壤酶活性更快的恢复到正常水平,有利于土壤农药的酶修复,这对除草剂在土壤中的生物降解、保护土壤生态环境和后茬作物的生长都具有重要的意义。
超氧化物歧化酶(SOD)是主要的活性氧清除酶系,过氧化氢酶(CAT)使H2O2转化为H2O和O2,二者协同运作,使自由基维持在一个较低的水平,从而避免膜受到损伤,抗氧化物酶的活性受不同农药及相同农药的不同浓度的影响均有所不同[33-34]。安全剂除了是除草剂解毒剂,也是一种植物生长调节剂,具有调节植物体内物质输导和生长发育、新陈代谢的功能,因而可通过与除草剂混用促进杂草快速吸收除草剂,进而提高防除杂草的效果[35]。胡利峰等[36]研究发现安全剂可能通过抑制作物对除草剂的吸收转运,或诱导植物体内的酶活性发生变化而增强其对除草剂的代谢来缓解除草剂对作物的不利影响。Panfili等[37]研究表明解草酮用于缓解除草剂特丁津药害时会提升作物的抗氧化酶活性。本研究表明,除草剂单嘧磺隆处理的糜子根系SOD活性在生育前期被显著抑制,添加安全剂后明显缓解了单嘧磺隆对糜子根系的抑制影响,这与陶波等[38]的研究结果一致。生育中后期随除草剂在土壤中的降解,单嘧磺隆处理糜子根系SOD活性被明显激活。除草剂单嘧磺隆处理的糜子根系CAT活性相较于清水处理表现为激活-抑制,在前中期CAT活性有显著提高,添加安全剂后这种激活作用受到了不同程度的减弱,这与张盼盼等[39]的研究结果相似。除草剂单嘧磺隆会显著提升糜子根系的MDA含量,安全剂与单嘧磺隆复配使用后能显著降低根系MDA含量,其中安全剂赤霉素添加后中后期糜子根系MDA含量最小,延缓根系衰老效果相对较好。根系抗氧化物酶活性与MDA含量的变化说明安全剂的添加有效的缓解了除草剂单嘧磺隆对糜子根系的不利影响,显著减少单嘧磺隆对糜子根系细胞膜系统的伤害,减弱了单嘧磺隆对糜子根系生长发育和形态建成的抑制作用,从而保证糜子正常的生长发育,显著提高了糜子的产量。
4 结 论
与单施除草剂单嘧磺隆相比,其配施芸苔素、赤霉素、奈安后药害指数显著下降,分别降低了20.27%、21.63%、20.94%,并且缓解了除草剂对糜子根际土壤酶活性的抑制,提高土壤蔗糖酶、脲酶活性,改变了单嘧磺隆对土壤碱性磷酸酶和过氧化氢酶活性的不利影响。添加安全剂后,糜子根系超氧化物歧化酶活性提高,减缓了药害胁迫造成的膜脂过氧化作用,减少细胞膜系统的损伤,延缓了根系衰老进程,提高了糜子的株高、茎粗、穗长、主穗重及产量,其中赤霉素与单嘧磺隆复配较单施单嘧磺隆增产1 061 kg/hm2,故而安全剂赤霉素与除草剂单嘧磺隆复配使用在缓解除草剂药害,促进糜子增产方面效果相对较好。
[1]柴岩. 糜子[M]. 北京:中国农业出版社,1999:68-90.
[2]王显瑞,赵敏,柴晓娇,等. 施肥对糜子密度、产量及农艺性状的影响[J]. 中国农学通报,2013,29(6):160-165.
Wang Xianrui, Zhao Min, Chai Xiaojiao, et al. The impact of fertilizer on proso millet density, yield and agronomic traits[J]. Chinese Agricultural Science Bulletin, 2013, 29(6): 160-165. (in Chinese with English abstract)
[3]朱懿. 不同除草剂对机直播稻田杂草控制及水稻生长和产量的影响[D]. 成都:四川农业大学,2015.
Zhu Yi. The Influences of Different Herbicides on Weed Control and Rice Growth and Output in Mechanical Direct Seeding Fields[D]. Chengdu: Sichuan Agricultural University, 2015. (in Chinese with English abstract)
[4]黄贵斌. 糜子农田除草剂的防效及安全性评价[D]. 杨凌:西北农林科技大学,2017.
Huang Guibin. The Control Effect and Safety Evaluation of Herbicide in Broomcorn Millet Farmland[D]. Yangling: Northwest A&F University, 2017. (in Chinese with English abstract)
[5]Bartucca M L, Alessandro D M, Daniele D B. Interference of three herbicides on iron acquisition in maize plants[J]. Chemosphere, 2018, 206: 424-431.
[6]李瑾,刘秀,金晨钟,等. 酰胺类除草剂安全剂作用机理及研究应用进展[J]. 现代农业科技,2016(21):107-109,114.
Li Jin, Liu Xiu, Jin Chenzhong, et al. Research progress of mechanism and application of amide herbicide safener[J]. Modern Agricultural Science and Technology, 2016(21): 107-109, 114. (in Chinese with English abstract)
[7]张特,赵强. 棉田阔叶除草剂与安全剂的复配药剂筛选[J]. 农药,2017,56(4):307-310.
Zhang Te, Zhao Qiang. Screening of drug combination in broad leaf herbicides and safeners in cotton filed[J]. Agrochemicals, 2017, 56(4): 307-310. (in Chinese with English abstract)
[8]高新菊,葛玉红,王恒亮,等. 缓解剂对2甲4氯钠玉米药害的解除作用[J]. 农药,2014,53(2):109-112.
Gao Xinju, Ge Yuhong, Wang Hengliang, et al. Relief effects of antidotes on the MCPA-Na phytotoxicity in maize[J]. Agrochemicals, 2014, 53(2): 109-112. (in Chinese with English abstract)
[9]Bo N’ska E, Lasota J, Zwydak M. The relationship between soil properties, enzyme activity and land use[J]. Forest Research Papers, 2017, 78(1): 39-44.
[10]和文祥,蒋新,朱茂旭,等. 酶修复土壤农药污染的研究进展[J]. 生态学杂志,2001,20(3):47-51,68.
He Wenxiang, Jiang Xin, Zhu Maoxu, et al. Advance on enzymes bioremediation of pesticides-polluted[J]. Chinese Journal of Ecology, 2001, 20(3): 47-51, 68. (in Chinese with English abstract)
[11]汪梦竹. 油菜和小麦种苗根系对乙草胺耐性差异的分析[D]. 杨凌:西北农林科技大学,2016.
Wang Mengzhu. Analysis of Acetochlor Tolerance in Root ofand[D]. Yangling: Northwest A&F University, 2016. (in Chinese with English abstract)
[12]董改改,慕小倩,汪梦竹,等. 广佳安对油菜芽苗根系形态结构及生理指标的影响[J]. 中国油料作物学报,2015,37(2):206-213.
Dong Gaigai, Mu Xiaoqian, Wang Mengzhu, et al. Attack effects on morphological structure and physiological change of rape seedling root[J]. Chinese Journal of Oil Crop Sciences, 2015, 37(2): 206-213. (in Chinese with English abstract)
[13]郭鸿鹏,朱静雅,杨印生. 农业非点源污染防治技术的研究现状及进展[J]. 农业工程学报,2008,24(4):290-295.
Guo Hongpeng, Zhu Jingya, Yang Yinsheng. Research status and development of technologies for controlling agricultural non-point source pollution[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 24(4): 290-295. (in Chinese with English abstract)
[14]字雪靖. 不同除草剂的田间防效及对糜子生长发育的影响[D]. 杨凌:西北农林科技大学,2018.
Zi Xuejing. Effct of Different Herbicides on Weeds in Millet Field and Their Effects on Growth and Development of Broomcorn Millet[D]. Yangling: Northwest A&F University, 2018. (in Chinese with English abstract)
[15]关松荫. 土壤酶及其研究法[M]. 北京:农业出版社,1986.
[16]杨兰芳,曾巧,李海波,等. 紫外分光光度法测定土壤过氧化氢酶活性[J]. 土壤通报,2011,42(1):207-210.
Yang Lanfang, Zeng Qiao, Li Haibo, et al. Measurement of catalase activity in soil by ultraviolet spectrophotometry[J]. Chinese Journal of Soil Science, 2011, 42(1): 207-210. (in Chinese with English abstract)
[17]邹琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2003.
[18]全国农业技术推广服务中心. 土壤分析技术规范[M]. 北京:中国农业出版社,2006:36-41.
[19]陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社,2006.
[20]谷盼妮,王美娥,陈卫平. 环草隆与镉复合污染对城市绿地重金属污染土壤有机氮矿化量、基础呼吸和土壤酶活性的影响[J]. 生态毒理学报,2015,10(4):65-87.
Gu Panni, Wang Meie, Chen Weiping. Combined effects of siduron and cadmium on organic nitrogen mineralization, basal respiration and enzyme activities in heavy metal polluted urban soil[J]. Asian Journal of Ecotoxicology, 2015, 10(4): 65-87. (in Chinese with English abstract)
[21]Ramakrishnan B, Megharaj M, Venkateswarlu M, et al. Mixtures of environmental pollutants: Effects on microorganisms and their activities in soils[J]. Reviews of Environmental Contamination and Toxicology, 2011, 211: 63-120.
[22]Megharaj M, Ramakrishnan B, Venkateswarlu K, et al. Bioremediation approaches for organic pollutants: A critical perspective[J]. Environment International, 2011, 37(8): 1362-1375.
[23]Kucharski J, Wyszkowska J. Biological properties of soil contaminated with the herbicide Apyros 75 WG[J]. Journal of Elementology, 2008, 13(3): 357-371.
[24]王聪颖,和文祥,何敏超,等. 酶在土壤农药污染修复中的研究进展[J]. 农业环境科学学报,2005,24(S1):371-374.
Wang Congying, He Wenxiang, He Minchao, et al. Research advances on repairing pesticides polluted soils by enzymes[J]. Journal of Agro-Environment Science, 2005, 24(S1): 371-374. (in Chinese with English abstract)
[25]Feng C, Ma Y H, Jin X, et al. Soil enzyme activities increase following restoration of degraded subtropical forests[J]. Geoderma, 2019, 351: 180-187.
[26]马彦霞,郁继华,张晶,等. 设施蔬菜栽培茬口对生态型无土栽培基质性状变化的影响[J]. 生态学报,2014,34(14):4071-4079.
Ma Yanxia, Yu Jihua, Zhang Jing, et al. Effect of different rotation systems on the characteristic change of ecotype soilless culture media for vegetables in greenhouse environments[J]. Acta Ecologica Sinica, 2014, 34(14): 4071-4079. (in Chinese with English abstract)
[27]Wang Liuwei, Hou Deyi, Shen Zhengtao, et al. Field trials of phytomining and phytoremediation: A critical review of influencing factors and effects of additives[J]. Critical Reviews in Environmental Science and Technology, 2020, 50(24): 2724-2774.
[28]刘淑娟,张伟,王克林,等. 桂西北喀斯特峰丛洼地不同植被演替阶段的土壤脲酶活性[J]. 生态学报,2011,31(19):5789-5796.
Liu Shujuan, Zhang Wei, Wang Kelin, et al. Soil urease activity during different vegetation successions in karst peak-cluster depression area of northwest Guangxi, China[J]. Acta Ecologica Sinica, 2011, 31(19): 5789-5796. (in Chinese with English abstract)
[29]刘丹丹,刘畅,王琳,等.sp.对土壤莠去津污染修复及代谢途径分析[J]. 农药,2017,56(12):887-889.
Liu Dandan, Liu Chang, Wang Lin, et al. Effect ofsp. on soil atrazine remediation and metabolic pathway analysis[J]. Agrochemicals, 2017, 56(12): 887-889. (in Chinese with English abstract)
[30]郑棉海,黄娟,陈浩,等. 氮、磷添加对不同林型土壤磷酸酶活性的影响[J]. 生态学报,2015,35(20):6703-6710.
Zheng Mianhai, Huang Juan, Chen Hao, et al. Effects of nitrogen and phosphorus addition on soil phosphatase activity in different forest types[J]. Acta Ecologica Sinica, 2015, 35(20): 6703-6710. (in Chinese with English abstract)
[31]李莹飞,耿玉清,周红娟,等. 基于不同方法测定土壤酸性磷酸酶活性的比较[J]. 中国生态农业学报,2016,24(1):98-104.
Li Yingfei, Geng Yuqing, Zhou Hongjuan, et al. Comparison of soil acid phosphatase activity determined by different methods[J]. Chinese Journal of Eco-Agriculture, 2016, 24(1): 98-104. (in Chinese with English abstract)
[32]周世雄,魏朝俊,胡海燕,等. 氟磺胺草醚对大豆根际土壤微生物和酶活性的影响及其在根际的降解[J]. 植物营养与肥料学报,2018,24(1):203-211.
Zhou Shixiong, Wei Chaojun, Hu Haiyan, et al. Effects of fomesafen on soil microorganisms, soil enzyme activities and its degradation in soybean rhizosphere[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(1): 203-211. (in Chinese with English abstract)
[33]冯明,王宏富. 3种除草剂对晋谷21SOD的影响[J]. 现代农业科技,2015,12:121,128.
Feng Ming, Wang Hongfu. Effect of three herbicides on Jingu 21 superoxide dismutase[J]. Modern Agricultural Science and Technology, 2015, 12: 121, 128. (in Chinese with English abstract)
[34]谢飞. 异丙甲草胺对玉米和水稻生态毒性的手性差异性研究[D]. 杭州:浙江工商大学,2011.
Xie Fei. Research on the Ecotoxicology and Enantioselectivity of Metolachlor on Maize and Rice[D]. Hangzhou: Zhejiang Gongshang University, 2011. (in Chinese with English abstract)
[35]江海澜. 除草剂与植物生长调节剂互作对棉田龙葵的影响及生理机制研究[D]. 石河子:石河子大学,2013.
Jiang Hailan. Study on the Effect of Interaction of Plant Growth Regulations and Herbicides on the Physiology and Biochemistry ofL[D]. Shihezi: Shihezi University, 2013. (in Chinese with English abstract)
[36]胡利锋,刘小安,孙兰,等. 除草剂安全剂作用机理研究进展[J]. 农药学学报,2017,19(2):152-161.
Hu Lifeng, Liu Xiaoan, Sun Lan, et al. Progresses in the action mechanism of herbicide safeners[J]. Chinese Journal of Pesticide Science, 2017, 19(2): 152-161. (in Chinese with English abstract)
[37]Panfili I, Bartucca M L, Marrollo G, et al. Application of a plant biostimulant to improve maize () tolerance to metolachlor[J]. Journal of Agricultural and Food Chemistry, 2019, 67(44): 12164-12171.
[38]陶波,王禹堃,李德萍,等. 安全剂AD-67对精异丙甲草胺解毒效应研究[J]. 东北农业大学学报,2019,50(1):29-35,51.
Tao Bo, Wang Yukun, Li Deping, et al. Study on detoxification effect of safeners AD-67 on S-metolachlor[J]. Journal of Northeast Agricultural University, 2019, 50(1): 29-35, 51. (in Chinese with English abstract)
[39]张盼盼,杨裕然,薛佳欣,等. 烯效唑对盐胁迫下糜子幼苗形态和生理特性的调控效应[J]. 草业学报,2020,29(10):81-90.
Zhang Panpan, Yang Yuran, Xue Jiaxin, et al. Effects of uniconazole on morphology and physiological characteristics of proso millet seedings under salt stress[J]. Acta Prataculturae Sinica, 2020, 29(10): 81-90. (in Chinese with English abstract)
Effects of combined application of safeners and herbicides on soil enzyme and active oxygen metabolism in proso millet
Feng Yu, Zhao Yingnan, Lin Ruichang, Wang Na, Gao Xiaoli※
(,712100,)
Proso millet is a small-seeded grass crop that produces large amounts of grain. Proso millet is also usually cultivated in arid and semi-arid regions of China, due mainly to its drought resistance, barren tolerance, and early maturity. In proso millet fields, chemical herbicides are mostly used to remove or prevent the growth of unwanted plants, such as weeds, invasive species, or agricultural pests. However, the herbicides can inevitably damage the proso millet, even to cause phytotoxicity of crops in the weeding. As such, safeners can be added to reduce the damage of herbicides to plants. Nevertheless, there is still a lack of research concerning the effects of safeners and herbicides on the soil environment and root active oxygen metabolism of proso millet. Therefore, this study aims to explore the effects of safeners on the mitigation of herbicide damage, the soil enzyme activity, the root antioxidant enzyme activity, as well as the growth and development of proso millet. Taking proso millet variety’ Yumi-2’ as the material in Yulin, Shaanxi Province in 2019, four patterns of herbicides compounding were designed, including one pre-emergence herbicide: Guyou (10% monosulfuron wettablepowder, 2.4 kg/hm², H1), Guyou add brassins (300 mL/hm2, H1S1), Guyou add gibberellin (300 mL/hm2, H1S2), and Guyou add Naian (1.2 kg/hm2, H1S3), meanwhile, the tap water (CK1) and artificial weeding (CK2) as controls. Moreover, the chemical and physical parameters were determined, including the control effect of weed fresh weight, phytotoxicity index, rhizosphere soil enzyme activity, root antioxidant enzyme activity, Maleicdialdehyde (MDA) content, agronomic traits and yield. The results showed that: 1) The phytotoxicity indexes of brassins, gibberellin, and Naian combined with Guyou significantly decreased by 20.27%, 21.63%, and 20.94%, respectively, but there was no significant change in the weed control effect. 2) The soil invertase and urease activities in the H1 treatment were dramatically inhibited, compared with that in the CK1 at 7-42 days after spraying, where the activity inhibition rate decreased with the time. Furthermore, the activities of soil invertase and urease significantly increased, whereas, the inhibition rate was significantly reduced after adding the safener (H1S1, H1S2, and H1S3 treatments). It infers that the mixed spraying of safener and Guyou can reduce soil alkaline phosphatase and catalase activities. 3) The root Superoxide Dismutase (SOD) activity in the H1 treatment was significantly lower than that in the CK1 at 14-28 d, while that was higher than that in the CK1 at 42-70 d. The activity of root SOD in the safener compound was higher than that in the H1 treatment at 14-28 d after spraying, while that was lower than that in the H1 treatment at 42-70 d. The root Catalase (CAT) activity in the H1 treatment was higher than that in the CK1 at 14-42 d, while was lower than that in the CK1 at 70-96 d. The CAT activity was reduced in safener compound after spraying. The root MDA content in the H1 treatment increased significantly, while it decreased significantly in the safener compound treatment after spraying. 4) Monosulfuron-methyl resulted in the reduction of plant height in proso millet, ear length, and main ear weight. The combined application of safeners reduced the adverse effects of herbicides. The yield of each treatment was higher than that of CK1. The combination of monosulfuron-methyl and gibberellin yields the highest yield, reaching 5 035 kg/hm2, which is an increase of 1 114 kg/hm2compared with CK1 treament and 1 061 kg/hm2compared with H1 treament. The combination of safener and monosulfuron-methyl can delay the inhibition of monosulfuron-methyl on the rhizosphere soil enzyme activity of proso millet, while increase the activities of soil invertase and urease, as well as the root SOD activity. It infers that the combined addition can be used to reduce the membrane lipid peroxidation, the damage of cell membrane system, and the senescence process of root system, while to increase plant height, stem thickness, ear length, main ear weight, and yield of proso millet. The findings demonstrated that the combination of safener gibberellin and herbicide monosulfuron-methyl can have a better effect to alleviate the herbicide damage, while promote the yield of proso millet.
herbicides; soils;enzyme activity; safener; proso millet; active oxygen metabolism
冯煜,赵颖楠,林瑞嫦,等. 除草剂配施安全剂对土壤酶活性与糜子根系生理代谢的影响[J]. 农业工程学报,2020,36(23):117-123.doi:10.11975/j.issn.1002-6819.2020.23.014 http://www.tcsae.org
Feng Yu, Zhao Yingnan, Lin Ruichang, et al. Effects of combined application of safeners and herbicides on soil enzyme and active oxygen metabolism in proso millet[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(23): 117-123. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.23.014 http://www.tcsae.org
2020-08-17
2020-11-17
国家谷子高粱产业技术体系项目(CARS-06-13.5-A26);陕西省重点研发计划项目(2018TSCXL-NY-03-01)
冯煜,主要从事作物高效栽培与生理生态技术研究。Email:jqfyttt@qq.com
高小丽,副教授,主要从事小杂粮优质高效栽培生理生态研究。Email:gao2123@nwsuaf.edu.cn
10.11975/j.issn.1002-6819.2020.23.014
S516
A
1002-6819(2020)-23-0117-07
