运动调节小凹蛋白-1表达改善2型糖尿病小鼠骨髓内皮祖细胞迁移能力
2020-03-02黄燕凤翟露刘玉花马翠韦薇戴霞
黄燕凤 翟露 刘玉花 马翠 韦薇 戴霞
1 广西医科大学第一附属医院护理部(南宁530021)
2 广西医科大学第一附属医院老年消化内科
糖尿病可引起血管内皮损伤和功能异常,促进动脉粥样硬化的发生发展,导致冠心病、缺血性脑卒中及下肢动脉闭塞等,是糖尿病患者致死致残的主要原因[1,2]。而这种血管内皮功能障碍的发生与骨髓内皮祖细胞(endothelial progenitor cells,EPCs)密切相关[3]。EPCs是血管内皮细胞的前体细胞,当血管内皮发生局部难以修复的损伤后,EPCs可向血管损伤部位迁移至血管内皮,参与血管新生和血管内皮修复[4]。然而,当机体患糖尿病时,EPCs的数量减少、功能受损,不能有效地发挥EPCs内皮修复作用[5,6]。因此,寻求改善糖尿病状态下EPCs功能的方法及其相关机制,对于治疗糖尿病血管病变有重要意义。
目前,不少研究证实有氧运动能提高老年人、冠心病以及慢性心衰患者的EPCs迁移功能,促进损伤内皮的修复[7-9]。但目前关于运动对糖尿病患者或者动物模型的EPCs功能作用研究较少,尚未发现有研究报道有氧运动、抗阻运动以及联合有氧-抗阻运动(联合运动)对糖尿病EPCs迁移能力的影响,且其相关机制尚不十分明确。有研究证实,小凹蛋白-1(caveolin-1,Cav-1)参与血管修复和生成过程[10,11],但Cav-1与EPCs关系的研究较少,而高血糖可改变Cav-1 的表达,同时使EPCs 功能受损[12,13]。运动是否能通过调节Cav-1 表达改善糖尿病小鼠EPCs的迁移能力,以及哪种运动的效果更好有待进一步研究。本研究对2型糖尿病小鼠实施为期8周的有氧运动、抗阻运动以及联合运动干预,体外分离培养骨髓源EPCs后比较各组EPCs迁移能力以及Cav-1 蛋白表达情况,探索哪种运动更能改善EPCs 迁移能力以及Cav-1 蛋白表达,从而促进血管内皮修复和血管再生,为运动治疗糖尿病、防治糖尿病血管并发症提供新的基础研究依据和新的思路。
1 对象和方法
1.1 动物及分组
将40 只8 周龄雄性db/db 小鼠(品系:BKS-DB/Nju;血糖28 mmol/L;体重42.27±1.21 g;公司:南京大学-南京生物医药研究院)按照电脑产生的随机数字进行编号,随机分为有氧运动组、抗阻运动组、联合有氧+抗阻运动组(联合运动组)以及对照组,每组10只。
1.2 主要实验试剂
RIPA 裂解液(碧云天)、PMSF溶液(索莱宝)、10X电泳转膜液(索莱宝)、甲醇溶液(成都科龙)、5X Tris-甘氨酸电泳缓冲液(索莱宝)、抗体Cav-1(100 μl)(美国CST 公司)、Western blot 一抗稀释液(索莱宝)、Western blot 二抗稀释液(碧云天)、1×PBS 缓冲液(pH 7.2- 7.4,索莱宝)、蛋白磷酸酶抑制剂混合物(100X,索莱宝)、BCA 蛋白浓度测定试剂盒(碧云天)、荧光二抗(羊抗兔,美国LICOR 公司)、荧光二抗(羊抗鼠,美国LICOR公司)。
1.3 运动训练
各组均以普通饲料喂养。空白组不进行任何运动干预;各运动组分别采取相应的运动,运动方案参考既往研究并改良[14,15],由专人负责运动训练干预,每周运动6 天,共8 周。有氧运动组db/db 小鼠在坡度均为0度WDW-1型8跑道小鼠跑台(北京东西仪器科技有限公司,出厂编号:2016020-022)跑步。在第1周时有氧运动速度为10 m/min,逐渐增加至15 m/min,30 min/d,第2~8周速度为15 m/min,60 min/d。抗阻运动组db/db小鼠的尾部缠绕一定重量的水球进行爬梯训练,具体干预方案见表1。联合运动组每周的运动量为有氧运动与抗阻运动各一半的方式,见表2。

表1 抗阻运动组运动方案

表2 联合运动组运动方案
1.4 EPCs的分离培养
于运动干预第8 周后取材,各组分离培养EPCs 方法均一致。颈椎脱臼法处死小鼠,于75%乙醇内浸泡5~10 min,无菌分离小鼠肱骨、股骨及胫骨并离断,以含三抗(青霉素-链霉素-庆大霉素)的无菌PBS 充分冲洗骨髓腔,收集骨髓细胞至无菌15 ml 离心管中,将骨髓腔冲洗液轻柔吹打均匀后,按1︰1 体积缓慢滴加于淋巴细胞分离液上,2000 rpm/min 离心 20 min 后用巴氏吸管吸取出中间白色云雾状细胞层,加入PBS 清洗细胞去除残留的淋巴细胞分离液,离心获取细胞沉淀,加入EGM-2MV 培养基重悬细胞。将细胞培养物接种于包被了纤维黏连蛋白(FN 蛋白)的T25 细胞培养瓶中,于二氧化碳培养箱中培养。此后,每天观察细胞生长情况,每3天换液一次,去除非贴壁细胞。细胞扩增至一定数量后进行EPCs的鉴定,待细胞汇合度达到80%后开始进行细胞传代培养。
1.5 EPCs的鉴定
向各组的24孔板中依次加入DiI 标记的乙酰化低密度脂蛋白(DiI-ac-LDL,Molecular Probes 公司)和带FITC 荧光标记的豌豆凝集素(FITC-UEA-I,Sigma 公司),共聚焦显微镜观察到Dil-acLDL、FITC-UEA-I双染色阳性的细胞被认为是正在分化的EPCs[16]。流式细胞检测CD133 表型,Anti-mouseIgG-Fc/PE(博奥森)作为同型对照(阴性对照),将PE荧光标记的造血干细胞抗原CD133 抗体(博奥森)加入待测细胞溶液中孵育30 min。PBS 溶液洗涤后,以300 g/min 转速离心5 min,重悬调整细胞密度后,流式细胞仪检测CD133 表型表达情况。
1.6 EPCs的迁移功能检测
采用细胞划痕实验反映细胞迁移功能。1~3×106个EPCs 接种于6 孔板,置于37℃、5% CO2的细胞培养箱中培养24 h。用200 μL 移液器配合直尺枪头垂直于6 孔板,对照预先画好的线,均匀画条痕。用1×PBS缓冲液洗涤6 孔板3 次,去除划下的细胞,加入无血清培养基继续置37℃、5% CO2的细胞培养箱中培养。各组EPCs分别于0 h、48 h在倒置荧光/相差显微镜成像分析系统定点拍照并分析,绘制柱状图[17,18]。
1.7 蛋白免疫印迹技术(Western blotting)
往25 cm2细胞培养瓶里加PIRA裂解液、苯甲基磺酰氟溶液(PMSF)、蛋白磷酸酶抑制剂混合液以裂解EPCs,裂解后进行4℃、14000 r/min 的条件离心15 min,吸取上清液,5×蛋白上样缓冲液按照1︰5体积比加入上清液,混匀后槽式加热器调节温度100℃,加热10 min 使蛋白变性。使用BCA 法测定蛋白浓度,将蛋白进行10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳分离并转到聚偏二氟乙烯膜上(PVDF)。制备蛋白凝胶后,电泳、转膜,5%脱脂奶粉封闭至少1 h,之后用TBST 洗涤。一抗孵育2 h 后二抗孵育1 h,TBST 洗涤,最后用Odyssey 双色红外激光成像系统扫描,选择800 通道,调节明亮度,记录各组蛋白灰度值。
1.8 统计学分析
采用Image J 软件分析图片,SPSS 22.0 统计软件对数据进行统计分析,组间比较采用单因素方差分析,检验水准为α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学观察
骨髓分离后获得的细胞在FN 蛋白包被的培养瓶中培养,24 h 开始贴壁,4 d 贴壁基本完全,可见较多贴壁细胞,呈圆形、短梭形,部分为长梭形;随着培养时间的延长,圆形细胞数量减少,梭形细胞数量渐渐增多,可出现细胞集落,7 d 后EPCs 大量增殖,并有梭形贴壁细胞在其边缘不断生成,可出现“铺路石”样改变,见图1。

图1 倒置显微镜下EPCs的形态(×100)
2.2 双荧光染色鉴定
在激光共聚焦显微镜下,胞浆摄取DiI-ac-LDL,显示红色,胞膜结合FITC-UEA-I,显示绿色,双染色阳性细胞为黄色,为正在分化的EPCs。各组EPCs 的DiIac-LDL 及FITC-UEA-I 双染阳性率为73.50%±7.47%(图2)。流式细胞仪检测表型CD133 检出率为63.29%(图3)。
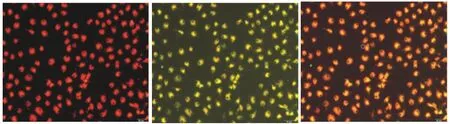
图2 DiI-ac-LDL及FITC-UEA-I双染试验结果(×200)
2.3 EPCs迁移能力检测
本研究观察了运动8 周后EPCs 的迁移能力,与对照组相比,运动可以改善EPCs 的迁移能力。8 周运动结果显示:与对照组相比,有氧运动、抗阻运动以及联合运动均能明显改善EPCs 的迁移能力(P<0.05),且联合运动较有氧运动、抗阻运动效果更佳(P<0.05)。见图4。
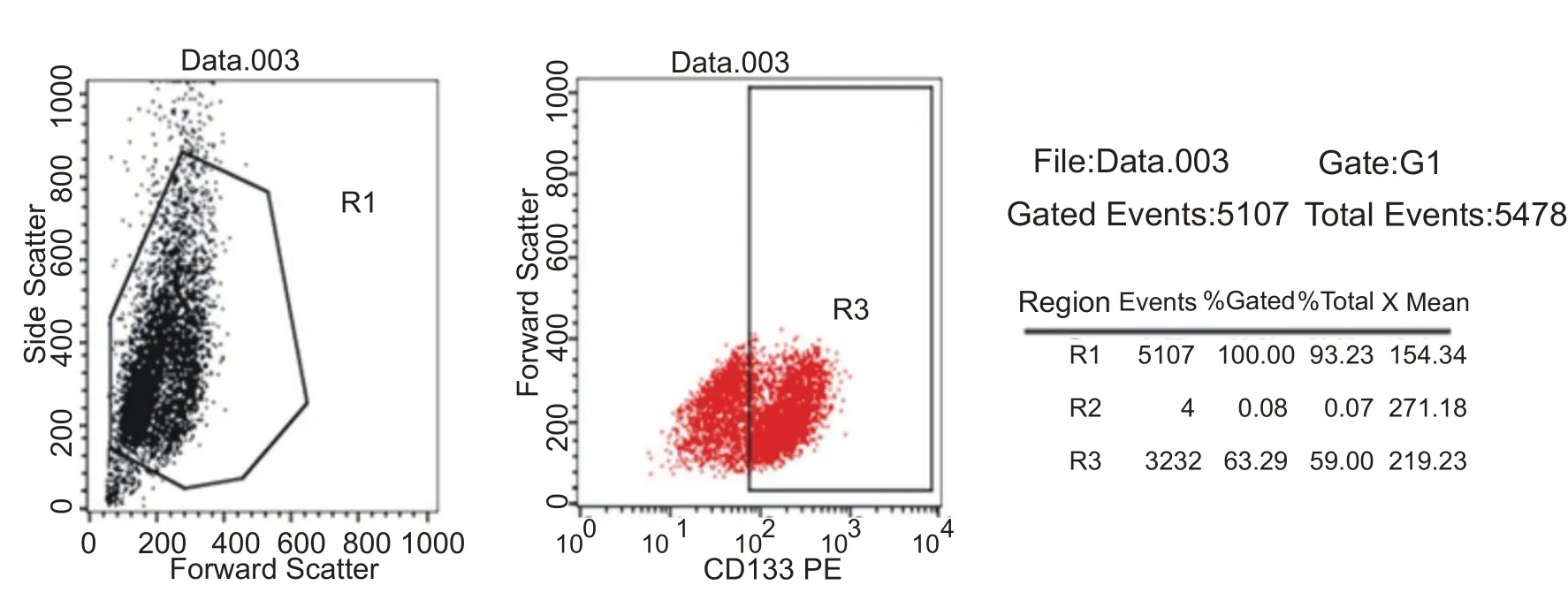
图3 流式细胞仪检测CD133表型
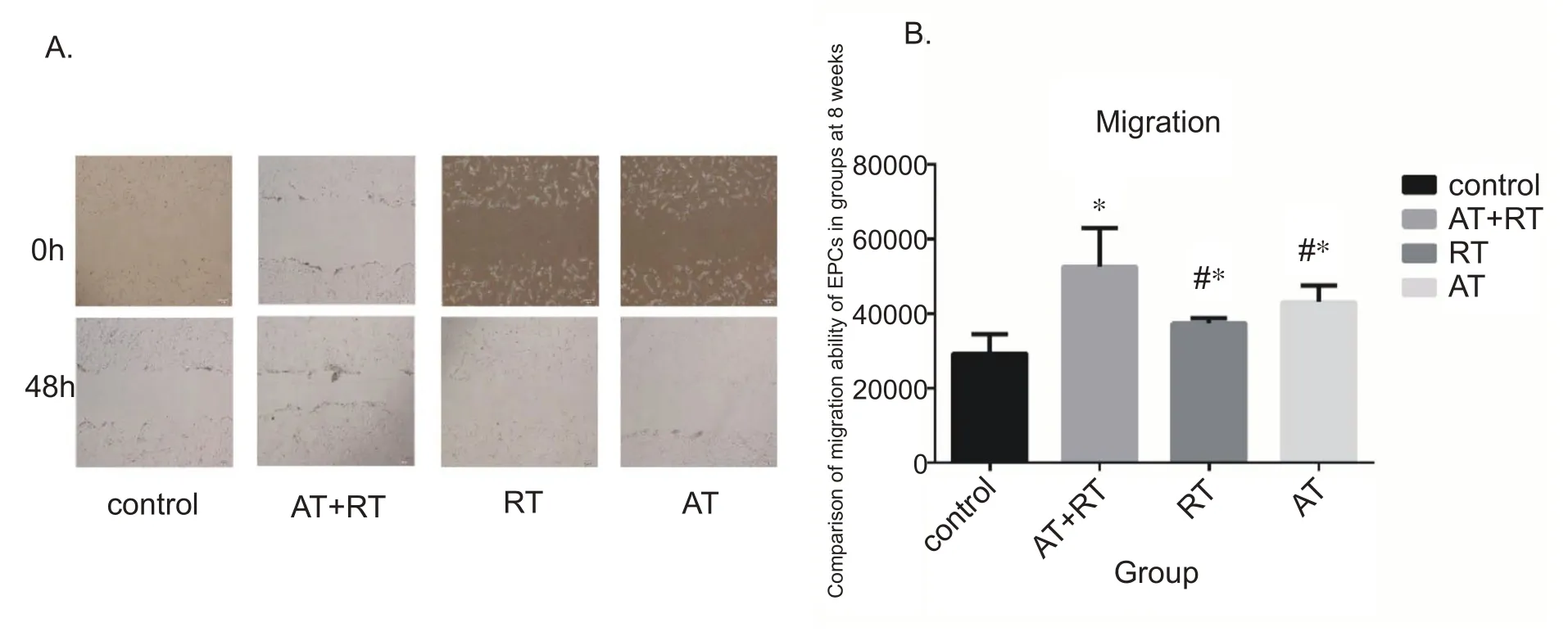
图4 各组EPCs在干预8周后的迁移功能比较
2.4 各组Cav-1蛋白表达的比较
经过8 周的运动干预,我们采用Western blotting法检测糖尿病小鼠EPCs的Cav-1蛋白表达水平。检测结果显示,与对照组、有氧运动组和抗阻运动组相比,联合运动组Cav-1 蛋白表达水平升高(P<0.05)。有氧运动组、抗阻运动组与对照组间差异无统计学意义(P>0.05)。见图5。
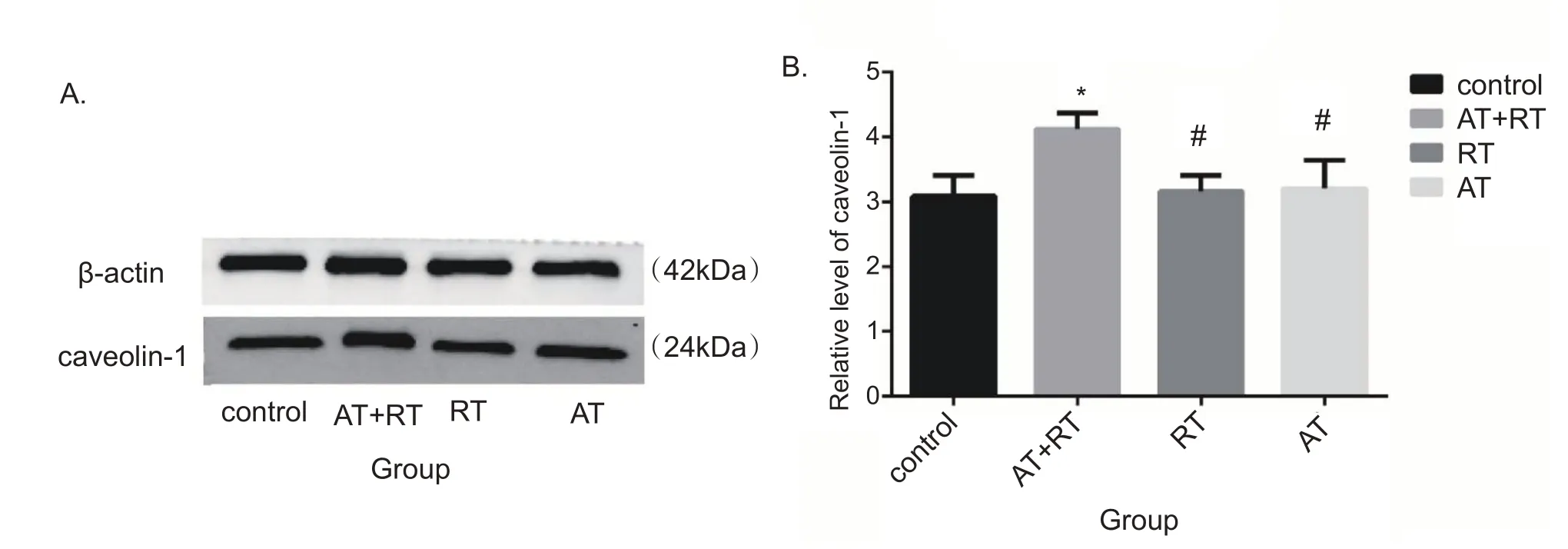
图5 各组EPCs在运动干预8周后Cav-1表达水平的比较
3 讨论
研究表明,当血管内皮受损时,EPCs 可以从骨髓动员、迁移,整合到血管网络,通过分化为成熟的内皮细胞从而修复损伤血管和生成新的血管[4,5]。而2型糖尿病会导致EPCs的迁移能力下降,影响其趋化至受损内皮进行黏附、侵袭,从而使其修复内皮的功能减弱[19]。不少研究报道称有氧运动或耐力训练能改善中老年人EPCs 的迁移能力[7,20],然而在病理状态下,不同的运动方式对EPCs的影响效果可能不同。目前,不同运动方式对2 型糖尿病患者EPCs 功能的作用尚未十分明确,相关机制也尚不清楚。本实验对糖尿病db/db 小鼠进行8周的运动训练,有氧、抗阻及联合运动三种运动方式组均呈现出较对照组更强的骨髓EPCs 体外迁移能力,提示规律的运动可提高EPCs 的迁移能力,促进EPCs 的血管内皮修复功能,与夏文豪等[20]的研究结果一致。本研究还发现,三种运动呈现出不同的促进作用效果,其中以联合运动组的运动效果最佳,其增强EPCs迁移能力的效果较单纯的有氧、抗阻运动有显著差异。本研究认为需进一步探究联合运动对2型糖尿病患者骨髓EPCs 影响的作用机制,为2 型糖尿病患者或相关血管疾病的预防、诊断与治疗以及疾病的延缓提供更好的资料。
为了探索运动改善EPCs 功能活性的可能分子机制,我们对各组糖尿病小鼠EPCs 中与内皮修复相关的Cav-1 蛋白表达量进行检测。Cav-1 是小凹蛋白家族成员之一,在内皮细胞中含量丰富[21]。血管内皮生长因子受体2(vascular endothelial growth factor recep⁃tor 2,VEGFR-2)定位于Cav-1 中,Cav-1 可通过正性或负性调控VEGFR-2 从而调节血管内皮生长因子(VEGF)的信号通路,参与EPCs的内皮损伤修复过程[22]。有研究报道,雌激素能促进EPCs 的增殖,与雌激素调控Cav-1的表达有关[23]。本研究结果显示,经过联合运动训练后Cav-1 蛋白的表达明显提高,并改善了EPCs迁移能力,提示联合运动可能通过上调Cav-1 蛋白的表达改善EPCs 的迁移能力。已有研究报道,Cav-1 缺失后,EPCs 从骨髓到外周的动员减少[24]。Wunderlich等[25]通过对Cav-1表达缺陷小鼠的研究发现,Cav-1基因的表达缺陷可导致其心血管系统出现明显的异常。Rodriguez-Feo等[26]研究发现,粥样斑块处Cav-1蛋白表达水平降低,且其低表达与不稳定斑块的形成密切相关。以上多个研究与本研究结果均表明,血管内皮的稳定修复不能缺少Cav-1。然而,也有研究表明,糖尿病状态下血管功能失调,可能与高糖所致的Cav-1 表达增高有关[27]。可见,Cav-1的表达水平高低影响着血管内皮的修复。而本研究结果显示,联合运动组明显上调EPCs 的Cav-1 蛋白表达水平,提示Cav-1 可能参与联合运动相关EPCs功能活性的改善,且其表达水平对EPCs迁移功能有促进作用;亦表明联合运动方式较单纯有氧或抗阻运动方式更能提高Cav-1蛋白表达水平,从而更好地改善EPCs功能,修复内皮损伤。
4 总结
本研究结果表明,EPCs 上调Cav-1 蛋白的表达对于其迁移功能的促进作用不可或缺,联合运动可通过提升Cav-1 蛋白的表达水平达到改善EPCs 迁移能力。本研究为采用运动及干细胞防治糖尿病血管疾病提供了新的证据。有关联合运动通过Cav-1蛋白调节EPCs的具体机制还有待进一步研究。
