基于高密度遗传图谱定位水稻籽粒大小相关性状QTL
2020-02-27张健杨靖王豪李冬秀杨瑰丽黄翠红周丹华郭涛陈志强王慧
张健,杨靖,王豪,李冬秀,杨瑰丽,黄翠红,周丹华,郭涛,陈志强,王慧
基于高密度遗传图谱定位水稻籽粒大小相关性状QTL
张健,杨靖,王豪,李冬秀,杨瑰丽,黄翠红,周丹华,郭涛,陈志强,王慧
(华南农业大学/国家植物航天育种工程技术研究中心,广州 510642)
【】通过对水稻籽粒大小相关性状进行QTL定位及候选基因的筛选,为水稻籽粒大小相关基因的精细定位、克隆及基因功能等研究奠定基础。以籼稻品种特华占搭载高空气球空间诱变后产生的特异矮秆突变体CHA-1为母本,以籼稻品种航恢7号搭载“神州八号”飞船经空间诱变后筛选出的突变体H335为父本杂交衍生出的275个RIL群体作为供试材料,利用GBS测序技术构建高密度遗传图谱,RIL群体及亲本分别于2017年早季和2017年晚季在华南农业大学实验教学基地种植。成熟收获后通过扫描仪获取水稻籽粒图像,利用SmartGrain软件获取籽粒大小相关性状表型数据。采用QTL IciMapping v 4.0软件基于完备复合区间作图法,对水稻籽粒大小相关性状进行QTL定位。构建的高密度遗传图谱包含2 498个Bin标记,总图距2 371.84 cM,标记间平均遗传图距为0.95 cM。两季共检测到26个籽粒大小相关QTL,分布于第1、2、3、4、7和9染色体上,单一QTL贡献率为0.16%—14.41%。在第1、2、3、7染色体上检测到5个QTL簇(、、、和)。其中、和与前人报道相似,和是新发现的籽粒大小相关QTL,在2个季别的不同性状中被检测在同一标记区间附近,LOD值介于4.00—8.08,贡献率为6.67%—11.38%。在2个季别下均检测到与籽粒厚度相关,LOD值介于2.94—8.59,贡献率为4.69%—14.41%。使用的高密度遗传图谱定位区间较小,结合功能注释和CREP数据库表达谱,在位点筛选到4个潜在的与籽粒大小相关的注释基因、、和。其中编码一个丝氨酸羧肽酶编码一个泛素E2结合酶;编码一个类受体蛋白激酶;编码一个TCP转录因子。在位点筛选到3个潜在的与籽粒大小相关的注释基因、和。其中编码一个驱动蛋白结构域;编码一个蛋白激酶结构域;编码一个具有去蛋白质泛素化功能的OTU-like半胱氨酸肽酶。其中编码泛素E2结合酶的和编码驱动蛋白结构域的在幼穗和授粉后的胚乳中表达量较高,推测其为最可能的调控籽粒大小的候选基因。共检测到26个水稻籽粒大小相关QTL。在第1、2、3和7染色体上检测到5个QTL簇(、、、和),其中和为新发现的控制籽粒大小QTL,并在该位点筛选到2个可能调控水稻籽粒大小相关的候选基因。
水稻;RIL群体;高密度遗传图谱;籽粒大小;QTL定位;候选基因
0 引言
【研究意义】水稻是世界上最主要的粮食作物之一,水稻产量相关的研究是作物科学领域的热门方向。千粒重是水稻产量的一个重要指标,而水稻籽粒大小是决定千粒重的主要因素之一。对水稻籽粒大小性状进行精确遗传解析,对于水稻高产优质分子育种具有重要的理论研究价值。【前人研究进展】水稻籽粒大小主要包括粒长、粒宽、粒厚等性状,前人研究表明,水稻籽粒大小由少量主效QTL和多个微效QTL所控制[1-2]。研究者已经通过不同的作图群体来定位控制水稻籽粒大小的相关QTL,如F2群体和重组自交系(RIL)群体已被广泛用于发掘水稻全基因组中的QTL。此外,与籽粒大小相关的突变体也是研究水稻器官形态发生和发育的有用材料。国家水稻数据中心显示,目前克隆的影响水稻籽粒大小的基因已经超过100多个(http://www.ricedata.cn/ontology/ontology. aspx?ta=TO:0000397)。如控制粒长的基因[3][4][5];控制粒宽的基因[6]、[7]、[8]、[9];控制粒厚的基因[10]、[11]、[12]、[13];控制千粒重的基因[14]、[15]、[16]、[17]等。是第一个被克隆的控制籽粒大小的主效QTL,其编码的蛋白对粒重起负调控作用,由于功能的缺失导致水稻籽粒变长。位点上17.1 kb的串联重复,会引起表达水平的上调,并下调邻近负调因子表达,从而增加谷粒的纵向细胞分裂,并减少横向细胞分裂,导致谷粒变得细长[4]。近年来,虽然在水稻籽粒大小的调控机制上取得了一些进展,但水稻籽粒大小的调控网络依然不够清晰。随着高通量测序技术的发展,测序成本不断降低,利用高通量测序技术可在短时间内获取大量多态性标记,根据多态性标记构建高密度遗传图谱,为重要农艺性状QTL的挖掘和鉴定提供了有效手段。彭强等[18]借助SLAF-seq技术开发的多态性SLAF标签构建高密度遗传图谱,共检测到22个稻米外观品质QTL。董骥驰等[19]基于包含2 711个Bin标记的高密度遗传图谱,在4个环境下共定位到14个影响水稻抽穗期的QTL。秦伟伟等[20]基于GBS技术获得了高密度的SNP位点,构建了包含1 262个Bin标记的高密度遗传图谱,共检测到30个玉米籽粒性状QTL。【本研究切入点】前人主要使用RFLP、SSR等分子标记连锁的原理定位QTL,但由于此类分子标记在全基因组的覆盖率较低,导致定位区间较大,不能有效地筛选到目标基因。高密度遗传图谱相比传统分子标记构建的遗传图谱,具有高通量、省时省力、定位区间小等优势,有利于进一步精确定位和筛选候选基因。【拟解决的关键问题】本研究用籼稻品种特华占空间诱变特异矮秆突变体CHA-1和籼稻品种航恢7号空间突变体H335为亲本,杂交并连续自交6代构建含有275个株系的重组自交系为作图群体,基于GBS技术构建包含2 498个Bin标记的高密度遗传图谱,在2个季别下对水稻籽粒大小相关性状进行QTL定位分析,并结合表达谱预测候选基因,为后续籽粒大小相关基因的精细定位、克隆及基因功能等研究提供有效基础。
1 材料与方法
1.1 研究材料
CHA-1是由籼稻品种特华占搭载高空气球诱变后选育出的特异矮秆突变体,H335是由籼稻品种航恢7号搭载“神州八号”飞船经空间诱变返回地面后种植筛选出的突变体。以CHA-1为母本,以H335为父本杂交产生F1,F1自交获得F2,通过单粒传法,构建CHA-1/H335的重组自交系(RIL)群体,连续自交直至第6代,最终获得包含275个株系的RIL群体。RIL群体与2个亲本于2017年早季和2017年晚季重复种植于华南农业大学实验教学基地(23.17°N,113.37°E)。早季于2017年2月28日播种育秧,3月31日移栽。晚季于2017年7月22日播种育秧,8月7日移栽。每个株系种6行,每行6株,行株距为20 cm×20 cm,均单本种植,田间管理按当地大田常规栽培要求实施。
1.2 表型调查及数据分析
成熟时单株收获,自然晾干保存,并去除空粒,对每个供试材料表型数据测定如下:每个株系随机选取约50粒饱满种子置于培养皿中,使用扫描仪(Canon CanoScan 5600F)在300 dpi下获取种子图像,利用SmartGrain[21]软件(http://phenotyping.image. coocan.jp/),参照程序说明,设置合适的精确度和芒剔除阈值,选择批量分析模式,可获得谷粒长(grain length,GL)、谷粒宽(grain width,GW)、圆度(circularity,CS)、长宽比(length-to-width ratio of grain,GLWR)、谷粒周长(perimeter length of grain,PL)和谷粒截面积(area size of grain,AS)等指标。使用电子游标卡尺随机测量10粒饱满谷粒的厚度,重复3次,取平均值,计算粒厚(grain thickness,GT)。使用全自动数粒仪随机数取1 000粒饱满种子,并用电子天平称重,重复3次,取其平均值,计算千粒重(1000-grain-weight,TGW)。利用Excel 2019对籽粒大小相关数据进行处理,使用SPSS 20.0进行统计分析,采用Origin 2017绘制籽粒大小相关性状频数分布图。
1.3 DNA提取及高密度遗传图谱的构建
采用国家植物航天育种工程技术研究中心自主开发的高通量磁珠法提取样品DNA,具体方法参考陈立凯等[22]方法。基于GBS测序,对275个RIL进行简化基因组测序,每个株系获得约0.34 Gb的数据。对原始数据进行质控过滤,共获得770 428 068双末端reads。其中96.79%可比对到日本晴参考基因组。经过序列比对和SNP标记开发,获得100 307双等位纯合的SNP位点用于Bin的划分。将连续多个SNP标记且具有相同的基因型概括为一个区块(Bin),利用其构建RIL群体的重组区块图谱(recombination bin map)。以每个重组区块作为一个标记,利用HighMap软件构建其高密度遗传图谱。
1.4 QTL定位
利用QTL IciMapping V4.0软件中的完备区间作图法对RIL群体的籽粒大小相关性状进行QTL作图及遗传效应分析,作图步长为1.00 cM,PIN设置为0.001,LOD阈值设置为2.50。并计算每个QTL对水稻籽粒大小相关性状的贡献率和加性效应,QTL命名遵循McCouch等[23]的原则。
1.5 候选基因的筛选
通过群体标记物理位置定位到水稻基因组上,基于水稻参考基因组序列,对标记区间内的候选基因进行分析,根据水稻基因组注释网站Rice Genome Annotation Project(http://rice.plantbiology.msu.edu/)对候选基因进行功能注释和分析,使用拟南芥TAIR(https://www.arabidopsis.org/)中的blast功能查找与候选基因相似的同源序列的基因功能,借助CREP[24]、RiceXPro[25]等公共数据库表达谱分析注释基因的表达特性,使用R的热图函数pheatmap绘制注释基因表达谱热图。
2 结果
2.1 亲本及重组自交系的籽粒表型分析
对RIL群体及亲本CHA-1和H335在2个季别下的8个籽粒相关性状表型值进行统计分析(表1),发现在2017年早季和晚季2个季别下,CHA-1的籽粒大小相关性状都要低于H335,而晚季下两亲本的粒长、粒宽、籽粒周长、籽粒截面积和千粒重均比早季有一定程度的增加,粒厚则变化不明显。亲本籽粒大小(图1-a)和方差分析表明,两亲本籽粒大小相关性状间存在显著或极显著的差异(表1)。在CHA-1/H335重组自交系中,籽粒大小表现为广泛的变异(图1-b),同时根据所考察的籽粒大小相关性状的频率分布及偏度、峰度检验结果,可以看出,2个季别下各籽粒大小相关性状表型频率分布均表现为正态或近似正态的连续分布(表1和图2),呈现出数量性状的特征,且存在双向超亲分离现象,符合QTL区间作图的要求。

表1 亲本CHA-1和H335及重组自交系2个季别下的籽粒大小性状表现
GL:粒长;GW:粒宽;GT:粒厚;GLWR:长宽比;CS:谷粒圆度;PL:籽粒周长;AS:籽粒截面积;TGW:千粒重。*表示在0.05水平差异显著;**表示在0.01水平差异显著。下同
GL: grain length; GW: grain width; GT: grain thickness; GLWR: length-to-width ratio of grain; CS: circularity; PL: perimeter length of grain; AS: area size of grain; TGW: 1000-grain-weight. *: significant at<0.05; **: significant at<0.01. The same as below
2.2 籽粒相关性状之间的相关性
对2个季别下RIL群体籽粒大小相关性状的相关性分析(表2),表明粒长与粒厚、谷粒截面积、谷粒周长、长宽比、千粒重呈极显著正相关,其中,由于粒长为谷粒截面积、谷粒周长、长宽比、千粒重的构成因素,谷粒周长与粒长的相关性最高(≥0.987),而谷粒圆度则与粒长呈极显著负相关。对于简单性状(粒长、粒宽、粒厚)的分析,表明粒宽与粒长无明显相关性(=0.062,早季),说明粒长和粒宽有着不同的遗传基础,但是粒宽与粒厚具有较高的正相关性系数(=0.555,晚季),这与前人研究结果相符[26-27]。除长宽比和谷粒圆度外,所有籽粒大小相关性状都与千粒重呈极显著正相关,其中,粒厚与千粒重的相关性最高(≥0.666)。结果表明,粒厚是决定千粒重最关键的性状,而粒长和粒宽对谷粒周长、谷粒截面积、谷粒长宽比和谷粒圆度及千粒重等复合性状具有不同程度的影响。

a:亲本粒型籽粒大小差异(10粒宽);b:部分重组自交系籽粒大小差异
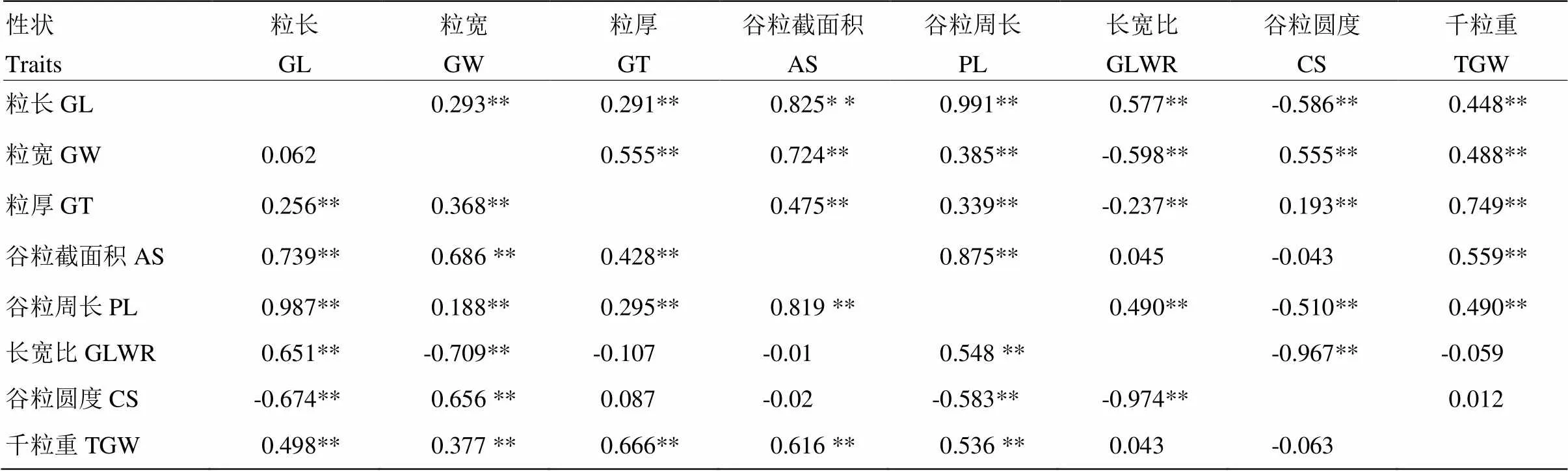
表2 CHA-1/H335重组自交系群体籽粒大小性状间相关性分析
左下:早季;右上:晚季 bottom left: Early season; top right: late season
2.3 CHA-1×H335重组自交系高密度遗传图谱
以水稻空间突变体CHA-1/H335组合衍生出的275份重组自交系为作图群体,利用HighMap通过最大似然法进行遗传图谱构建,共构建12个连锁群(表3),包含2 498个Bin标记,平均每条染色体上的标记数为208.17个。总图距2 371.84 cM,平均每条染色体覆盖长度为197.65 cM。相邻2个Bin标记间的平均遗传图距为0.95 cM。第2、3和4号染色体上Bin标记较多,分别达316、313和309个。而第5、7和12染色体上Bin标记较少,分别为138、156和145个。第10染色体的平均图距最大,达1.77 cM,第2染色体的平均图距最小,为0.62 cM。连锁群中最大的Gap位于第10染色体上,为25.61 cM。12条染色体中Gap长度小于5 cM的比例都高于98%,表示图谱比较均匀,构建的高密度遗传图谱适合用于水稻相关农艺性状的QTL定位。
2.4 籽粒大小相关性状的QTL定位
利用构建的高密度遗传图谱,在2个季别下,结合亲本及重组自交系共277个株系的8个籽粒大小相关性状的表型数据,采用QTL IciMapping V4.0软件中的完备区间作图法对RIL群体的籽粒大小相关性状进行QTL作图及分析。在早季和晚季中共检测到26个籽粒大小相关 QTL(表4和图3),分布于第1、2、3、4、7、9染色体的不同位置,LOD值介于2.53—96.99,贡献率介于0.16%—14.41%。大部分检测到的QTL都位于同一区间或相近位置。
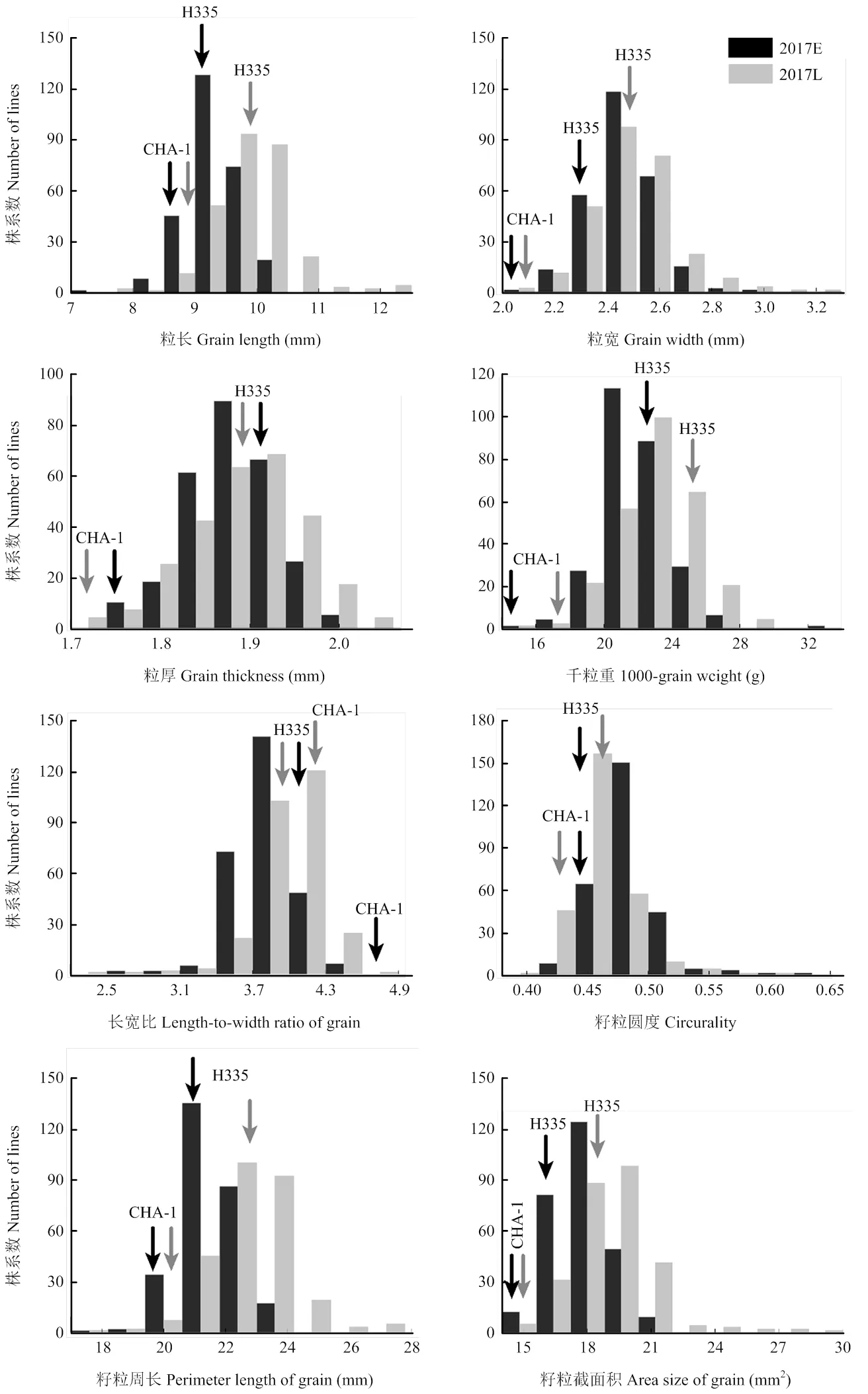
E:早季;L:晚季

表3 连锁图谱基本信息统计

GL:粒长;GW:粒宽;GT:粒厚;GLWR:长宽比;CS:谷粒圆度;AS:籽粒截面积;PL:籽粒周长;TGW:千粒重;E:早季;L:晚季
PVE:贡献率;Add.:加性效应。下同 PVE: percentage of variance explained; Add.: additive effect. The same as below
各籽粒大小相关QTL定位结果具体如下:
粒长:2个季别下共检测到5个粒长QTL,分布于第1、2和9染色体,贡献率介于0.16%—11.07%。其中,在2017年早季被检测到位于第2染色体上Block3789—Block3802区间内,贡献率为10.37%。2017年晚季定位到2个贡献率较高的QTL,分别是和,贡献率分别为11.07%和8.87%。
粒宽:2个季别下共检测到2个粒宽QTL。在2017年晚季被检测到位于第3染色体Block5332—Block5419区间内,贡献率为5.29%在2017年早季被检测到位于第3染色体Block6009—Block6012区间内,贡献率为6.50%。
粒厚:2个季别下共检测到6个粒厚QTL。分布于第3、4和7染色体,贡献率介于4.69%—14.41%。其中在2个季别下都被重复检测到,在2017年早季和2017晚季中,贡献率分别为4.69%和14.41%。
长宽比:2个季别下共检测到2个长宽比QTL。分别位于第3和第7染色体上,位于第3染色体Block6004—Block6012区间内,贡献率为4.22%。位于第7染色体Block12538—Block12681区间内,贡献率为4.81%。
谷粒圆度:2017年晚季检测到1个谷粒圆度QTL,位于第7染色体Block12538—Block12681区间内,其贡献率为4.58%。
谷粒截面积:2个季别下共检测到3个谷粒截面积QTL,分布于第2和第3染色体上,贡献率介于4.87%—11.36%。其中和分别位于第2染色体上Block3794—Block3802和Block3789—Block3802区间内,贡献率分别为7.08%和11.36%。
谷粒周长:2个季别下共检测到4个谷粒周长QTL,分布于第1、2和9染色体上,贡献率介于4.50%—11.38%。
千粒重:2个季别下共检测到3个千粒重QTL,分布于第2和第4染色体上,贡献率介于4.62%—9.92%。在2017年晚季被检测到位于第2染色体Block3805—Block3823区间内,贡献率为9.92%。在2017年早季被检测到位于第2染色体Block3892—Block3931区间内,贡献率为6.75%。在2017年晚季被检测到位于第4染色体Block6738—Block6765区间内,贡献率为4.62%。
2.5 注释基因预测分析
共定位到26个籽粒大小相关QTL,其中有14个QTL存在共定位,成簇的分布在第1、2、3和7染色体的5个区间,对共定位的QTL重新命名为、、、和(表5)。通过与前人报道QTL及已克隆籽粒大小相关基因物理位置比对,发现和为本研究新发现的籽粒大小相关QTL。基于水稻参考基因组序列及基因组注释信息,对定位区间内的注释基因进行分析,通过群体标记物理位置定位到水稻基因组上,所在区间为Block3794—Block3802,对应物理位置为Chr.2:25 435 879—25 530 071 bp,该区间包含18个注释基因。根据基因组注释(图4),在该位点筛选到4个可能影响籽粒大小的相关基因,分别为、、和,其中编码一个丝氨酸羧肽酶;编码一个类受体蛋白激酶;编码一个TCP转录因子;而编码一个泛素E2结合酶。所在区间为Block5421—Block5424,对应物理位置为Chr.3:21 695 710—21 786 126 bp。该区间包含了12个注释基因,在位点筛选到3个可能影响籽粒大小的相关基因,分别为、和,其中编码一个驱动蛋白结构域,编码一个蛋白激酶结构域,编码一个OTU-like半胱氨酸肽酶。将和两区间内共30个注释基因提交到CREP表达谱数据库(http://crep.ncpgr.cn/crep-cgi/home.pl),获得其中23个注释基因在明恢63和珍汕97中多个器官/组织和发育阶段表达谱数据,并使用R的热图函数pheatmap构建了注释基因的表达谱热图(图4)。表达谱分析表明,在水稻的根、茎、叶、幼穗及授粉后的胚乳中均有表达,但在幼穗和授粉后7 d的胚乳中表达量最高。在水稻幼穗中的表达量最高,为其他组织器官的5—200倍。和则在授粉后14 d的胚乳中的表达量较高。

表5 本研究检测到的籽粒大小相关QTL簇

图中蓝色越深代表其表达量越低,红色越深则表达量越高,基因名称后面为其基因注释信息
3 讨论
3.1 与前人QTL定位比较
近年来,随着高通量测序技术和功能基因组学的飞速发展,大量的籽粒大小相关基因被克隆报道,并通过基因编辑等技术得到了验证。已报道的水稻籽粒大小基因涉及的调控途径主要有泛素-蛋白酶体、G蛋白信号、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号、植物激素感知和稳态、表观遗传修饰以及转录调控因子等调控通路。前人研究结果表明控制相关性状的QTL并不是均匀分布在染色体上的,而是成簇分布在染色体上某个区域[29-30],形成一个QTL富集区域。目前报道克隆的籽粒大小相关QTL主要集中在第2、3、5和7染色体上。本研究定位到的与前人报道的一个控制粒长的QTL位置一致[31],同时该区间也发现了一个已经克隆的影响水稻千粒重的基因[28]。第2染色体上定位到的与刘进等[29]研究所定位到的第3染色体上同时控制粒厚和长宽比的QTL区间一致。在第7染色体上定位到了一个控制籽粒长宽比和圆度的QTL,分别是和,为同一QTL位点,命名为,在该区间内发现了已经克隆的控制粒长和粒宽的基因[4]。是一个控制粒厚的QTL,被重复定位于第3染色体Block5421—Block5424区间内,物理位置Chr.3:21 695 710—21 786 126 bp。前人研究克隆的粒型主效基因位于染色体上物理位置chr.3:16 729 501—16 735 109 bp,粒长基因则位于染色体上物理位置chr.3:25 042 315—25 051 072 bp,本研究定位的与已克隆的和的物理位置表明三者不是同一基因。水稻籽粒大小作为一个数量性状,受少数主效位点和多个微效位点所控制,且各性状之间相互影响。本研究定位到的QTL从贡献率上来说,大部分是一些微效QTL。与前人研究比较发现,部分检测到的QTL与已经定位或克隆的籽粒大小相关基因区间一致,表明本研究结果较为可靠,同时也检测到了一些新的籽粒大小相关QTL。
3.2 QTL定位+表达谱预测候选基因
水稻籽粒的大小受母体植株,胚和胚乳等不同的遗传体系所控制[32]。阐明水稻基因组中所有预测基因的功能不仅是植物分子生物学基础研究的终极目标,也是基因组学应用方面的最终目标,可以加速水稻品种的改良。通过基因表达谱分析获得有关器官/组织和发育阶段基因表达特异性的信息,可以更全面地理解基因的功能。本研究通过构建高密度遗传连锁图谱对水稻籽粒大小相关性状进行QTL定位,并基于基因组注释和表达谱分析筛选遗传位点内的候选基因。在对应的第2染色体94.19 kb物理区间内筛选到4个潜在的籽粒大小相关基因,其中编码一个丝氨酸羧肽酶OsSCP8。前人对SCP基因家族的研究表明,是一个参与ABA信号转导来调控水稻灌浆和休眠过程中重要的调控基因,在发育中的种子中特异表达,其突变体表现为籽粒变小[33]。泛素-蛋白酶体降解途径已被证实为水稻粒型重要调控途径之一[32]。如水稻中编码一个环型E3泛素连接酶,研究表明,功能的缺失将导致泛素不能转移到靶蛋白上,从而不能特异识别本应降解的底物,进而激活颖花外壳细胞的分裂,导致颖壳宽度增加[6]。编码一个泛素E2结合酶,表达谱分析表明,在水稻的根、茎、叶、幼穗、授粉后的胚乳中均有表达,在幼穗和授粉后7 d的胚乳中表达量最高,推测其可能参与了泛素-蛋白酶体降解途径介导的水稻籽粒大小调控。编码一个类受体蛋白激酶,序列比对表明,其可能存在与拟南芥相似的功能结构域,是BR信号的受体激酶,大量研究表明,BR的生物合成和信号传导参与了水稻粒型调控[34]。推测可能与BR介导的水稻粒型调控有关。编码一个TCP转录因子,TCP家族基因是植物特异性转录因子,在植物发育中起重要作用。有研究表明,在小麦幼穗中表达量较高,其突变体较野生型具有更长的籽粒[35]。研究者通过对小麦全转录组分析,在小麦中鉴定了59个TCP家族转录因子,其中在小麦籽粒中表达的有48个,表明TCP转录因子可能对小麦籽粒的发育起重要作用[36]。表达谱分析证实了在水稻幼穗中的表达量要显著高于其他组织,推测其可能与水稻幼穗的生长发育密切相关,进而影响水稻籽粒的大小。
对应第3染色体90 kb的物理区间,该区间共有12个注释基因,筛选得到3个潜在的籽粒大小相关基因,其中编码一个驱动蛋白结构域,表达谱分析表明,其在水稻幼穗中的表达量最高,为其他组织器官的5—200倍。水稻中/编码驱动蛋白,调控细胞周期和细胞壁的属性,可导致小粒[37];为驱动蛋白13基因家族成员,影响细胞纵向长度,突变体的种子表现为小粒圆形[38]。推测可能参与了小穗壳的生长发育过程,通过影响穗壳大小,进而影响水稻颖果的大小。编码一个蛋白激酶结构域,表达谱分析表明,其在授粉后14 d的胚乳中的表达量较高。编码一个OTU-like半胱氨酸肽酶,具有去蛋白质泛素化功能,表达谱分析表明,其在授粉后第14天和第21天的表达量较高。泛素化和去泛素化是可逆过程,最近研究发现,去泛素化在调控植物器官大小中同样起着重要作用,是近年来报道的一个粒宽和粒厚调控基因,具有去泛素化酶活性,主要是通过影响颖壳细胞的扩展从而控制水稻籽粒的大小和形状[13]。据此推测也可能有类似的功能。
除此之外,其他定位到的QTL区间也存在一些与籽粒大小调控相关可能性较高的注释基因,主要涉及一些泛素连接酶相关组分以及蛋白激酶相关的基因。基因注释和表达谱分析表明,编码泛素E2结合酶的和编码驱动蛋白结构域的为最有可能的调控籽粒大小的候选基因。为了进一步的确定调控籽粒大小的候选基因,下一步可对候选基因扩增后测序分析,确定其变异位点,使用实时荧光定量PCR验证表达谱数据,分析其组织表达特性,并通过转基因等手段验证其功能。
4 结论
构建了包含12条染色体的水稻高密度遗传图谱,该图谱包含2 498个Bin标记,总图距2 371.84 cM,相邻2个Bin标记间的平均遗传图距为0.95 cM。在2个季别下对材料CHA-1/H335衍生的重组自交系群体共检测到26个水稻籽粒形态大小相关QTL。在第1、2、3和7染色体上检测到5个QTL簇(、、、和),其中和为新的控制籽粒大小QTL。定位区间共有18个注释基因,定位区间共有12个注释基因,基于基因注释和表达谱分析,筛选了几个潜在的候选基因,分别是位点的、、和;位点的、和其中编码泛素E2结合酶的和编码驱动蛋白结构域的为最有可能的调控籽粒大小的候选基因。
[1] Xing Y Z, Zhang Q F. Genetic and molecular bases of rice yield., 2010, 61(1): 421-442.
[2] Huang R Y, Jiang L R, Zheng J S, Wang T S, Wang H C, Huang Y M, Hong Z L. Genetic bases of rice grain shape: so many genes, so little known., 2013, 18(4): 218-226.
[3] Fan C C, Xing Y Z, Mao H L, Lu T T, Han B, Xu C G, Li X H, Zhang Q F. GS3, a major QTL for grain length and weight and minor QTL for grain width and thickness in rice, encodes a putative transmembrane protein., 2006, 112(6): 1164-1171.
[4] Wang Y X, Xiong G S, Hu J, Jiang L, Yu H, Xu J, Fang Y X, Zeng L J, Xu E B, Xu J, Ye W J, Meng X B, Liu R F, Chen H Q, Jing Y H, Wang Y H, Zhu X D, Li J Y, Qian Q. Copy number variation at the GL7 locus contributes to grain size diversity in rice., 2015, 47: 944.
[5] Qi P, Lin Y S, Song X J, Shen J B, Huang W, Shan J X, Zhu M Z, Jiang L W, Gao J P, Lin H X. The novel quantitative trait locus GL3.1 controls rice grain size and yield by regulating Cyclin-T1;3., 2012, 22: 1666.
[6] Song X J, Huang W, Shi M, Zhu M Z, Lin H X. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase., 2007, 39: 623.
[7] Liu J F, Chen J, Zheng X M, Wu F Q, Lin Q B, Heng Y Q, Tian P, Cheng Z J, Yu X W, Zhou K N, Zhang X, Guo X P, Wang J L, Wang H Y, Wan J M. GW5 acts in the brassinosteroid signalling pathway to regulate grain width and weight in rice., 2017, 3: 17043.
[8] Xu C J, Liu Y, Li Y B, Xu X D, Xu C G, Li X H, Xiao J H, Zhang Q F. Differential expression of GS5 regulates grain size in rice., 2015, 66(9): 2611-2623.
[9] Shi C, Ren Y L, Liu L L, Wang F, Zhang H, Tian P, Pan T, Wang Y F, Jing R N, Liu T Z, Wu F Q, Lin Q B, Lei C L, Zhang X, Zhu S S, Guo X P, Wang J L, Zhao Z C, Wang J, Zhai H Q, Cheng Z J, Wan J M. Ubiquitin specific protease 15 has an important role in regulating grain width and size in rice., 2019:180 (1):381-391.
[10] She K, Kusano H, Koizumi K, Yamakawa H, Hakata M, Imamura T, Fukuda M, Naito N, Tsurumaki Y, Yaeshima M, Tsuge T, Matsumoto K, Kudoh M, Itoh E, Kikuchi S, Kishimoto N, Yazaki J, Ando T, Yano M, Aoyama T, Sasaki T, Satoh H, Shimada H. A novel factor FLOURY ENDOSPERM2 is involved in regulation of rice grain size and starch quality., 2010, 22(10): 3280-3294.
[11] Xu F, Fang J, Ou S J, Gao S P, Zhang F X, Du L, Xiao Y H, Wang H R, Sun X H, Chu J F, Wang G D, Chu C C. Variations in CYP78A13 coding region influence grain size and yield in rice., 2015, 38(4): 800-811.
[12] Chen J, Gao H, Zheng X M, Jin M N, Weng J F, Ma J, Ren Y L, Zhou K N, Wang Q, Wang J, Wang J L, Zhang X, Cheng Z J, Wu C Y, Wang H Y, Wan J M. An evolutionarily conserved gene, FUWA, plays a role in determining panicle architecture, grain shape and grain weight in rice., 2015, 83(3): 427-438.
[13] Huang K, Wang D K, Duan P G, Zhang B L, Xu R, Li N, Li Y H. WIDE AND THICK GRAIN 1, which encodes an otubain-like protease with deubiquitination activity, influences grain size and shape in rice., 2017, 91(5): 849-860.
[14] Song X J, Kuroha T, Ayano M, Furuta T, Nagai K, Komeda N, Segami S, Miura K, Ogawa D, Kamura T, Suzuki T, Higashiyama T, Yamasaki M, Mori H, Inukai Y, Wu J, Kitano H, Sakakibara H, Jacobsen S E, Ashikari M. Rare allele of a previously unidentified histone H4 acetyltransferase enhances grain weight, yield, and plant biomass in rice., 2015, 112(1): 76-81.
[15] Ishimaru K, Hirotsu N, Madoka Y, Murakami N, Hara N, Onodera H, Kashiwagi T, Ujiie K, Shimizu B, Onishi A, Miyagawa H, Katoh E. Loss of function of the IAA-glucose hydrolase gene TGW6 enhances rice grain weight and increases yield., 2013, 45: 707.
[16] Ying J Z, Ma M, Bai C, Huang X H, Liu J L, Fan Y Y, Song X J. TGW3, a major QTL that negatively modulates grain length and weight in rice., 2018, 11(5): 750-753.
[17] Lian J, Sun X J, Li Y C. GS6, a member of the GRAS gene family, negatively regulates grain size in rice., 2013, 55(10): 938-949.
[18] 彭强, 李佳丽, 张大双, 姜雪, 邓茹月, 吴健强, 朱速松. 不同环境基于高密度遗传图谱的稻米外观品质QTL定位. 作物学报,2018, 44(08): 1248-1255.
Peng Q, Li J L, Zhang D S, Jiang X, Deng R Y, Wu J Q, Zhu S S.QTL mapping for rice appearance quality traits based on a high-density genetic map in different environments., 2018, 44(8): 1248-1255. (in Chinese)
[19] 董骥驰, 杨靖, 郭涛, 陈立凯, 陈志强, 王慧. 基于高密度Bin图谱的水稻抽穗期QTL定位. 作物学报, 2018, 44(6): 938-946.
Dong J C, Yang J, Guo T, Chen L K, Chen Z Q, Wang H.QTL Mapping for heading date in rice using high-density bin map., 2018, 44(6): 938-946. (in Chinese)
[20] 秦伟伟, 李永祥, 李春辉, 陈林, 吴迅, 白娜, 石云素, 宋燕春, 张登峰, 王天宇, 黎裕. 基于高密度遗传图谱的玉米籽粒性状QTL定位. 作物学报,2015, 41(10): 1510-1518.
Qin W W, Li Y X, Li C H, Chen L, Wu X, Bai N, Shi Y S, Song Y C, Zhang D F, Wang T Y, Li Y.QTL Mapping for kernel related traits based on a high-density genetic map., 2015, 41(10): 1510-1518. (in Chinese)
[21] Tanabata T, Shibaya T, Hori K, Ebana K, Yano M. SmartGrain: High-Throughput phenotyping software for measuring seed shape through image analysis., 2012, 160(4): 1871-1880.
[22] Chen L K, Gao W W, Guo T, Huang C H, Huang M, Wang J F, Xiao W M, Yang G L, Liu Y Z, Wang H, Chen Z Q. A genotyping platform assembled with high-throughput DNA extraction, codominant functional markers, and automated CE system to accelerate marker-assisted improvement of rice., 2016, 36(9): 123.
[23] Mccouch S R. Gene nomenclature system for rice., 2008, 1(1): 72-84.
[24] Wang L, Xie W B, Chen Y, Tang W J, Yang J Y, Ye R J, Liu L, Lin Y J, Xu C G, Xiao J H, Zhang Q F. A dynamic gene expression atlas covering the entire life cycle of rice., 2010, 61(5): 752-766.
[25] Sato Y, Takehisa H, Kamatsuki K, Minami H, Namiki N, Ikawa H, Ohyanagi H, Sugimoto K, Antonio B A, Nagamura Y. RiceXPro Version 3.0: expanding the informatics resource for rice transcriptome., 2012, 41(D1): D1206-D1213.
[26] 郭咏梅, 穆平, 刘家富, 李自超, 卢义宣. 水、旱栽培条件下稻谷粒型和粒重的相关分析及其QTL定位. 作物学报, 2007(1): 50-56.
Guo Y M, Mu P, Liu J F, Li Z C, Lu Y X. Correlation Analysis and QTL mapping of grain shape and grain weight in rice under upland and lowland environments., 2007(1): 50-56. (in Chinese)
[27] 张颖慧, 谢永楚, 董少玲, 张亚东, 陈涛, 赵庆勇, 朱镇, 周丽慧, 姚姝, 赵凌, 王才林. 利用水稻籼粳重组自交系群体研究粒型性状与千粒重的相关性. 江苏农业学报, 2012, 28(2): 231-235.
Zhang Y H, Xie Y C, Dong S L, Zhang Y D, Chen T, Zhao Q Y, Zhu Z, Zhou L H, Yao S, Zhao L, Wang C L.Correlations between grain shape traits and 1000-grain weight usingrice recombinant inbred lines., 2012, 28(2): 231-235. (in Chinese)
[28] Kong W Y, Yu X W, Chen H Y, Liu L L, Xiao Y J, Wang Y L, Wang C L, Lin Y, Yu Y, Wang C M, Jiang L, Zhai H Q, Zhao Z G, Wan J M. The catalytic subunit of magnesium- protoporphyrin IX monomethyl ester cyclase forms a chloroplast complex to regulate chlorophyll biosynthesis in rice., 2016, 92(1): 177-191.
[29] 刘进, 姚晓云, 王棋, 李慧, 王嘉宇, 黎毛毛. 不同生态环境下籽粒大小相关性状QTL定位. 华北农学报, 2018, 33(2): 133-138.
Liu J, Yao X Y, Wang Q, Li H, Wang J Y, Li M M.QTL mapping of seed size traits under different environment in rice.,2018, 33(2): 133-138. (in Chinese)
[30] 逯腊虎, 杨斌, 张婷, 张伟, 袁凯, 史晓芳, 彭惠茹, 倪中福, 孙其信. 冬小麦旗叶大小及籽粒相关性状的QTL分析. 华北农学报, 2018, 33(5): 1-8.
Lu L H, Yang B, Zhang T, Zhang W, Yuan K, Shi X F, Peng H R, Ni Z F, Sun Q X.Quantitative trait loci analysis of flag leaf size and grain relative traits in winter wheat., 2018, 33(5): 1-8. (in Chinese)
[31] Wan X Y, Wan J M, Weng J F, Jiang L, Bi J C, Wang C M, Zhai H Q. Stability of QTLs for rice grain dimension and endosperm chalkiness characteristics across eight environments., 2005, 110(7): 1334-1346.
[32] 刘喜, 牟昌铃, 周春雷, 程治军, 江玲, 万建民. 水稻粒型基因克隆和调控机制研究进展. 中国水稻科学, 2018, 32(1): 1-11.
Liu X, Mou C L, Zhou C L, Cheng Z J, Jiang L, Wan J M.Research progress on cloning and regulation mechanism of rice grain shape genes., 2018, 32(1): 1-11. (in Chinese)
[33] 李志永. 水稻种子特异表达基因SCP46的克隆及功能鉴定[D]. 杭州: 中国农业科学院, 2017.
Li Z Y. Cloning and functional identification of A seed-specific gene SCP46 in rice[D]. Hangzhou: Chinese Academy of Agricultural Sciences, 2017. (in Chinese)
[34] Zhang B W, Wang X L, Zhao Z Y, Wang R J, Huang X H, Zhu Y L, Yuan L, Wang Y C, Xu X D, Burlingame A L, Gao Y J, Sun Y, Tang W Q. OsBRI1 activates BR signaling by preventing binding between the TPR and kinase domains of OsBSK3 via phosphorylation., 2016, 170(2): 1149-1161.
[35] Zhao J M, Zhai Z W, Li Y N, Geng S F, Song G Y, Guan J T, Jia M L, Wang F, Sun G L, Feng N, Kong X C, Chen L, Mao L, Li A L. Genome-wide identification and expression profiling of the TCP family genes in spike and grain development of wheat (L.)., 2018, 9: 1282.
[36] Chi Q, Guo L J, Ma M, Zhang L J, Mao H D, Wu B W, Liu X L, Ramirez-Gonzalez R H, Uauy C, Appels R, Zhao H X. Global transcriptome analysis uncovers the gene co-expression regulation network and key genes involved in grain development of wheat (L.)., 2019, 19: 853-866.
[37] Zhang M, Zhang B C, Qian Q, Yu Y C, Li R, Zhang J W, Liu X L, Zeng D L, Li J Y, Zhou Y H. Brittle Culm 12, a dual-targeting kinesin-4 protein, controls cell-cycle progression and wall properties in rice., 2010, 63(2): 312-328.
[38] Kitagawa K, Oki K, Kurinami S, Abe Y, Iwasaki Y, Kono I, Ando T, Yano M, Kitano H. A novel kinesin 13 protein regulating rice seed length., 2010, 51(8): 1315-1329.
QTL Mapping for Grain Size Related Traits Based on a High-Density Map in Rice
Zhang Jian, Yang Jing, Wang Hao, Li DongXiu, Yang GuiLi, Huang CuiHong, Zhou DanHua, Guo Tao, Chen ZhiQiang, Wang Hui
(South China Agricultural University/National Engineering Research Center of Plant Space Breeding, Guangzhou 510642)
【】Combine QTL mapping for grain size and related traits and screening for candidate genes to lay a good foundation for dissecting genes regulating rice grain size and related traits.【】A dwarf mutant CHA-1 screened from the progeny of therice variety Tehuazhan carried by high altitude balloon was hybridized with another mutant H335 selected from the progeny of therice variety Hanghui 7 induced by “Shenzhou 8” spaceflight. A population of 275 recombinant inbred lines (RILs) was structured from CHA-1 ×H335. A high-density genetic map was constructed using genotyping by sequencing (GBS) technology. The RIL population and parents were grown in the experimental base of South China Agricultural University consecutively in the early and late season in 2017. After ripening, rice grain images were scanned, and the grain size and related traits was obtained by SmartGrain software. QTL mapping for rice grain size and related traits was done with QTL IciMapping v 4.0 software based on inclusive composite interval mapping (ICIM).【】The constructed high-density genetic map contains 2498 Bin markers ,and all the markers covers 2371.84 cM with an average genetic distance of 0.95 cM/marker. A total of 26 grain-size related QTLs were repeatedly detected on Chr.1, Chr.2, Chr.3, Chr.4, Chr.7 and Chr.9 in the two seasons with single QTL contribution rate ranged from 0.16% to 14.41%. Five QTL clusters (,,,,) were detected on Chr.1, Chr.2, Chr.3, and Chr.7. Among them,,, andhave been previously reported.andwere novel grain-size related QTLs.was repeatedly detected in the same marker interval in the two seasons, and its LOD values in the early and late season were 8.08 and 4.00 with the phenotypic contribution rate 11.38% and 6.67%, respectively.was detectedto be correlated with grain thickness in the two seasons, and its LOD values in the early and late season were 2.94 and 8.59 with the phenotypic contribution rates 4.69% and 14.41%, respectively. Combined with functional annotation and CREP database of gene expression profiles, four candidate grain-size related genes including,,andwere screened out in thelocus.encodes a serine carboxypeptidase homologue;encodes a ubiquitin-conjugating enzyme;encodes a protein kinase domain containing protein;encodes aTCP domain containing protein. Three candidate grain-size related genes including,andwere screened out in thelocus.encodes a kinesin motor domain containing protein;encodes a protein kinase domain containing protein;encodes an OTU-like cysteine protease family protein. Among the genes,andwere highly expressed in the young panicle and endosperm after pollination and recognized as the most possible candidate genes for regulating grain size.【】26 rice grain-size related QTLs were detected. Five QTL clusters (,,,,) were detected on Chr1, Chr.2, Chr.3, and Chr.7, andandwere novel QTLs for regulating grain size,and two candidate genes were screened out in this locus.
rice; RIL population; high-density genetic map; grain size; grain shape; QTL mapping; candidate gene
10.3864/j.issn.0578-1752.2020.02.001

2019-05-29;
2019-07-19
国家重点研发计划(2017YFD0100104)
张健,E-mail:cheung_jane@foxmail.com。通信作者王慧,Tel:020-85283237;E-mail:wanghui@scau.edu.cn
(责任编辑 李莉)
