Resolvin D2 通 过 抑 制NF- κB通路减轻病毒性心肌炎小鼠炎症反应的研究
2020-02-27石哲玮刘胜新张银宇丁可军秦铖璠陈莹莹钱彩珍
石哲玮 刘胜新 张银宇 丁可军 秦铖璠 陈莹莹 钱彩珍
病毒性心肌炎是指由于病毒感染引起心肌组织广泛的炎症病变,随着疾病进展,可导致严重的心力衰竭以及恶性心律失常,甚至可导致年轻患者心源性猝死[1]。然而由于病毒性心肌炎的病理过程尚未完全阐明,临床上仍以对症支持治疗为主。腺病毒、肠道病毒以及巨细胞病毒是最常见的感染源,其中柯萨奇B3 病毒(coxsackievirus B3,CVB3)是一种公认的具有诱导病毒性心肌炎的肠道病毒[2]。寻找能够有效抑制CVB3 感染引起的心肌组织炎症反应的药物,可改善病毒性心肌炎患者的临床症状并降低不良事件的发生率。消退素(resolvin,Rv)家族是一类人体自身合成的具有促进炎症消退作用的新型多不饱和脂肪酸衍生物。Serhan 等[3]率先报道从动物炎症消退过程中释放的炎性渗出液中可分离得到Rv。近来的研究表明,Rv 在多种炎症相关疾病,包括骨炎、牙周炎、急性胰腺炎等疾病的发生、发展中发挥着重要的保护作用[4-6]。Tian 等[7]的研究结果表明RvD2(resolvin D2,RvD2)作为Rv 家族成员之一能够通过抑制核因子κB (nuclear factor-kappaB,NF-κB)通路下调脂多糖诱导的小胶质细胞炎症反应,并改善神经性退行性疾病的临床症状。本研究通过腹腔注射CVB3 病毒构建病毒性心肌炎动物模型,初步探讨RvD2 能否通过Toll 样受体(toll-like receptors,TLR)4 抑制NF-κB 通路从而下调病毒性心肌炎小鼠体内炎症因子的表达,为病毒性心肌炎临床治疗方案的制定提供一定的理论和实验依据,现报道如下。
1 材料和方法
1.1 实验动物及细胞、病毒株 健康清洁级雄性BALB/C 小鼠,体重(20±2)g,购于上海斯莱克实验动物有限公司,动物生产许可证编号:SCXK(沪)2012-0002。雄性BALB/C 小鼠饲养在温州医科大学实验动物中心,动物使用许可证号:SYXK(浙)2015-0009。Hep2 细胞由中国科学院上海生命科学院细胞资源中心提供。CVB3 Nancy 株购于美国ATCC 公司。病毒经Hep2 细胞活化增殖,细胞病理损伤达75%以上时收获,其滴度为107TCID50/0.1ml。
1.2 试剂及仪器 RvD2 购于美国Cayman chemical公 司, 兔 抗 小 鼠 白 介 素(interleukin,IL)-1β(ab9722)、肿瘤坏死因子(tumor necrosis factor,TNF)-α(ab1793)和TLR4(ab22048)单克隆抗体均购于英国Abcam 公司;兔抗小鼠NF-κB(#8242)单克隆抗体购于美国CST 公司;兔抗小鼠p-NF-κB(BS4737) 单克隆抗体购于上海西宝公司;抗GAPDH(MB001)单克隆抗体、辣根过氧化物酶标记羊抗兔IgG 均购于美国Bioworld 公司;ELISA 检测试剂盒购于上海博谷生物科技有限公司;HE 染色试剂盒、分离胶缓冲液、浓缩胶缓冲液等均购于中国Solarbio 公司;ECL 显色液购自美国Advansta 公司;其它生化试剂均为进口分装或国产分析纯化、酶标仪购于美国Thermo Fisher Scientific 公司;垂直电泳仪购于美国BIO-RAD 公司;显微镜购于日本Olympus 公司。
1.3 方法
1.3.1 模型建立与分组 CVB3 经Hep2 细胞活化增殖,细胞病理损伤达75%以上时收获,测定其滴度用于造模。采用随机数字表法将40 只BALB/C 小鼠分为4 组:正常对照组、RvD2 对照组、心肌炎组、RvD2 治疗组。正常对照组给予腹腔注射0.2ml0.9%氯化钠溶液。除正常对照组和RvD2 对照组外其余各组均采用腹腔接种1.0×106滴度CVB3 0.2ml 建立病毒性心肌炎动物模型。RvD2 对照组小鼠给予RvD2 腹腔注射给药,RvD2 治疗组小鼠在腹腔接种CVB3 24h 后给予RvD2 腹腔注射给药,RvD2 剂量均为0.25ng/g,1 次/d,持续7d。于治疗7d 后通过注射过量水合氯醛处死小鼠,留取血清标本,立即开胸摘取心脏,放入PBS 中,将心腔内的血挤干净,切取心尖部心肌组织用4%多聚甲醛固定,剩余心肌组织储存于-80℃冰箱内。
1.3.2 IL-1β、TNF-α 水平检测 将正常对照组、RvD2 对照组、心肌炎组和RvD2 治疗组小鼠处死后立即摘除眼球取血,将全血在室温下放置1h,待全血自然凝固并析出血清后,放入离心机内,4℃2 000g 离心10min,待离心完成后吸取黄色上清液,将待测血清存放于-80℃冰箱内保存。按照ELISA 检测试剂盒中的说明书步骤依次检测小鼠血清IL-1β、TNF-α 水平。1.3.3 心肌组织炎症细胞浸润情况评分 切取正常对照组、RvD2 对照组、心肌炎组和RvD2 治疗组小鼠心尖部心肌组织并用4%多聚甲醛固定24h。固定过程结束后用清水冲洗残留的多聚甲醛,经梯度脱水、石蜡包埋、固定,然后行石蜡切片。按照HE 染色试剂盒中的实验步骤染色,染色后光镜下观察各组心脏组织炎症细胞浸润情况。请本院病理科医生根据半定量评分标准对病理切片中炎症细胞浸润情况进行评分,无病变计0 分,病变累及心肌<25%计1分,25%~<50%计2 分,50%~<75%计3 分,75%~100%计4 分。
1.3.4 心肌组织内IL-1β、TNF-α、TLR4、NF-κB、p-NF-κB 和GAPDH 蛋白表达测定 留取心尖部心肌组织后,称量剩余心肌组织并放入装有适当体积裂解液(含蛋白裂解液及蛋白酶抑制剂)的匀浆管中,通过匀浆机裂解心肌组织,冰上裂解30min,离心后超声破碎3 次,放入离心机内12 000g、4℃离心30min 后取上清液通过考马斯亮蓝染色法测定蛋白浓度,准备蛋白样品。用10%SDS-PAGE 胶分离后,300mA 转膜,用5%脱脂奶粉封闭2h,加入抗IL-1β、TNF-α、TLR4、NF-κB、p-NF-κB 和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)蛋白Ⅰ抗中4℃孵育过夜,第2天用TBS-Tween 洗涤3 次后,孵育于Ⅱ抗中2h,再次洗涤3 次,加ECL 液曝光、显影、定影。用扫描仪扫描曝光胶片,用Image Lab 软件分析条带灰度值。IL-1β、TNF-α、TLR4 以GAPDH 蛋白作为参照,检测蛋白表达水平;p-NF-κB 以NF-κB 蛋白作为参照,检测蛋白磷酸化水平。
1.4 统计学处理 采用SPSS22.0 统计软件。计量资料以表示,多组比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 4 组小鼠血清IL-1β、TNF-α 水平比较 见表1。
由表1 可见,4 组小鼠血清IL-1β、TNF-α 水平差异均有统计学意义(均P<0.05)。正常对照组与RvD2 对照组小鼠血清IL-1β、TNF-α 水平差异均无统计学意义(均P>0.05);与正常对照组相比,心肌炎组小鼠血清IL-1β、TNF-α 水平增加(均P<0.05);与心肌炎组相比,RvD2 治疗组小鼠血清IL-1β、TNF-α 水平降低(均P<0.05)。
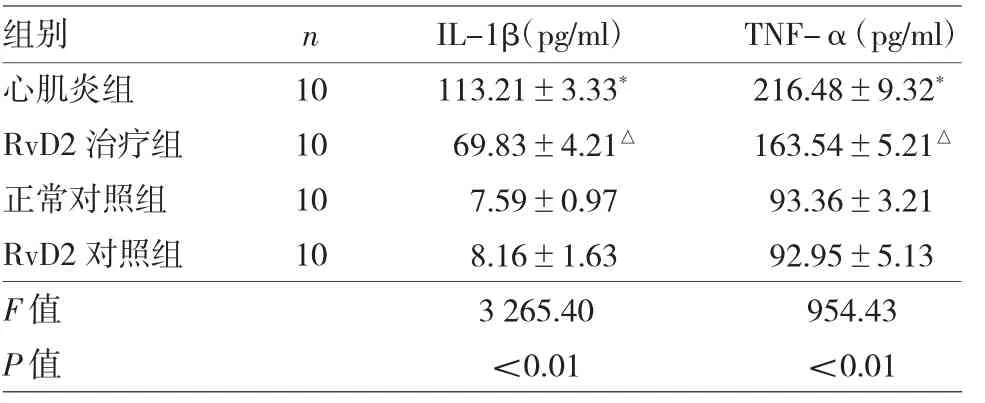
表1 4 组小鼠血清IL-1β、TNF-α 水平比较
2.2 4 组小鼠心肌组织炎症细胞浸润情况比较 见图1。
由图1 可见,与正常对照组比较,RvD2 对照组小鼠心肌组织内无炎症细胞浸润,评分为0 分,差异无统计学意义(P>0.05);与正常对照组比较,心肌炎组小鼠心肌组织内有大量炎症细胞浸润(评分2.5分),差异有统计学意义(P<0.05);与心肌炎组相比,RvD2 治疗组小鼠心脏组织内炎症细胞浸润明显下调(评分1.3 分),差异有统计学意义(P<0.05)。2.3 4 组小鼠心肌组织内炎症因子IL-1β、TNF-α蛋白表达水平比较 见图2。
由图2 可见,4 组小鼠心肌组织内炎症因子IL-1β、TNF-α 蛋白表达水平差异均有统计学意义(均P<0.05)。正常对照组与RvD2 对照组小鼠IL-1β、TNF-α 蛋白表达水平差异均无统计学意义(均P>0.05);与正常对照组相比,心肌炎组小鼠IL-1β、TNF-α 蛋白表达水平显著上调(均P<0.05);与心肌炎组相比,RvD2 治疗组小鼠IL-1β、TNF-α 蛋白表达水平显著下调(均P<0.05)。
2.4 4 组小鼠心肌组织内TLR4 蛋白表达水平及NF-κB 蛋白磷酸化水平比较 见图3。
由图3 可见,4 组小鼠心肌组织内TLR4 蛋白表达水平及NF-κB 蛋白磷酸化水平比较差异有统计学意义(P<0.05)。与正常对照组相比,RvD2 对照组小鼠心肌组织内TLR4 蛋白表达水平和NF-κB 蛋白磷酸化水平差异无统计学意义(均P>0.05);与正常对照组相比,心肌炎组小鼠心肌组织内TLR4蛋白表达水平和NF-κB 蛋白磷酸化水平显著上调(均P<0.05);与心肌炎组相比,RvD2 治疗组小鼠心脏组织内TLR4 蛋白表达水平和NF-κB 蛋白磷酸化水平显著下调(均P<0.05)。

图1 4 组小鼠心肌组织内炎症细胞浸润情况比较(A:4 组小鼠心肌组织病理染色图,HE 染色,×200;B:4 组小鼠心肌组织炎症细胞浸润情况评分,与正常对照组比较,*P<0.05;与心肌炎组比较,△P<0.05)
3 讨论
病毒性心肌炎是指由于病毒感染引起的心肌局限性或弥漫性的炎症性病变,属于感染性心脏疾病。目前尚无特异性治疗方法,临床上主要以抗病毒和对症支持治疗为主。虽然现有的抗病毒治疗可有效控制病毒扩增,但是在抑制心脏炎症方面现有的临床药物尚不能发挥满意的疗效。因此,寻找能够有效改善病毒性心肌炎患者体内炎症反应的药物,有利于改善病毒性心肌炎患者的临床症状和远期预后。

图2 4 组小鼠心肌组织内炎症因子TNF-α、IL-1β 蛋白表达水平比较(A:TNF-α、IL-1β 和GAPDH 蛋白电泳图;B:4 组小鼠心肌组织内TNF-α 蛋白表达水平比较;C:4 组小鼠心肌组织内IL-1β 蛋白表达水平比较。与正常对照组比较,*P<0.05;与心肌炎组比较,△P<0.05)
Rv 家族在不同疾病过程中发挥重要的保护作用。RvD2 作为消退素家族重要成员之一,是在炎症消退期间由白细胞产生的脂质介质,可以调节从炎症反应直至组织修复的全过程[11],且在不同疾病过程中发挥重要的保护作用。Croasdell 等[12]研究指出RvD2 能够减弱脂多糖(lipopolysaccharide,LPS)诱导的炎症反应。Charles 等[13]的研究表明RvD2 可增强吞噬介导的细菌清除以及器官保护作用。Spite 等[14]的研究发现RvD2 可以保护脓毒症小鼠免受白细胞浸润和细胞因子过度生成而造成的组织损伤,同时增强机体清除微生物的能力,从而减少败血症引起的小鼠死亡。本研究结果表明,给予病毒性心肌炎小鼠RvD2 治疗可以显著减少心肌组织内炎症细胞浸润,并抑制病毒性心肌炎小鼠血清和心肌组织内炎症因子IL-1β 和TNF-α 的表达。可能是由于RvD2 是一种有效的内源性抗炎介质[15],因此相较于其他体外合成的化学药物,这种新的治疗方法可以减少药物对宿主身体机能的影响,治疗上具有更大的潜力。

图3 4 组小鼠心肌组织内TLR4 蛋白表达水平及NF-κB 蛋白磷酸化水平比较(A:TLR4、p-NF-κB、NF-κB 和GAPDH 蛋白电泳图;B:4 组小鼠心肌组织内TLR4 蛋白表达水平比较;C:4 组小鼠心肌组织内NF-κB 蛋白磷酸化水平比较。与正常对照组比较,*P<0.05;与心肌炎组比较,△P<0.05)
既往的研究表明,RvD2 可以通过RvD2/DRV2轴激活细胞内的信号通路增强巨噬细胞对细菌的清除能力[13],通过下调TLR4 受体表达从而抑制LPS 诱导的炎症反应[12],还可通过与其受体G 蛋白偶联受体18(G protein coupled receptor 18,GPR18)结合从而增强血管内皮细胞的迁移能力[14]。为了明确RvD2 在病毒性心肌炎小鼠体内发挥抗炎作用的具体机制,本课题组进一步检测了炎症通路相关蛋白的表达。本研究结果表明,RvD2 治疗可显著下调TLR4 蛋白表达以及NF-κB 蛋白磷酸化水平。由此可见,RvD2 对病毒性心肌炎小鼠体内炎症因子表达的调控作用可能与TLR4/NF-κB 信号通路相关。
在本实验中,我们通过腹腔注射CVB3 病毒构建急性病毒性心肌炎动物模型,RvD2 对照组和RvD2 治疗组每日均给予相同剂量的RvD2 腹腔注射治疗。ELISA 检测结果表明RvD2 可以有效抑制心肌炎小鼠血清中炎症因子表达。HE 染色以及炎症因子IL-1β、TNF-α 蛋白检测结果表明RvD2 可以有效缓解心肌炎小鼠心脏组织内炎症反应。与此同时,RvD2 治疗后心肌炎小鼠心脏组织内TLR4 蛋白表达水平以及NF-κB 蛋白磷酸化水平均明显下调。RvD2 可能通过抑制TLR4/NF-κB 信号通路进而降低病毒性心肌炎小鼠体内的炎症反应,最终改善病毒性心肌炎小鼠的预后。RvD2 对病毒性心肌炎小鼠炎症反应的抑制作用为相关抗炎药物的研发提供了理论和实验基础,有望改善病毒性心肌炎患者的临床症状和远期预后。
本实验的局限之处是未设立NF-κB 蛋白激动剂处理组。在研究抗炎机制方面,虽然发现RvD2 能够抑制NF-κB 蛋白磷酸化,但是尚不能完整证明RvD2 是通过NF-κB 信号通路下调心肌炎症反应。因此,RvD2 对病毒性心肌炎小鼠心脏组织炎症反应的保护作用机制还有待进一步研究。
