纯磨玻璃结节肺腺癌临床及影像学特征与病理分类的相关性
2020-02-26武卫杰岳松伟王会霞吕东博高剑波
武卫杰,岳松伟,王会霞,吕东博,高剑波
(郑州大学第一附属医院 放射科,河南 郑州 450052 )
随着MDCT技术的广泛应用,肺部纯磨玻璃结节(pure ground-glass nodule,pGGN)的检出率也日益增高。pGGN病变可由多种原因引起,其中肿瘤性病变病理分类多为不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinomainsitu,AIS)、微浸润性腺癌(minimally invasive adenocarcinoma,MIA),但也可为浸润性腺癌(invasive adenocarcinoma,IAC)[1]。对病理分类为AAH、AIS、MIA的pGGN多采取肺段或楔形切除术,对IAC多采取肺叶切除治疗[2-4]。因此,术前对肺恶性pGGN进行病理分类,判断病灶浸润程度,对指导临床医生采取合理的治疗方案有重大意义。本研究探讨pGGN肺腺癌临床及影像学特征与病理分类的相关性,以期指导临床医生采用合理的治疗方案。
1 资料与方法
1.1 研究对象回顾性分析2017年10月至2019年5月郑州大学第一附属医院收治的胸部CT表现为pGGN的患者的临床资料。纳入标准:(1)通过手术病理或经皮穿刺活检病理证实为肺腺癌,有完整病理报告,病理亚型经病理证实;(2)术前完成常规胸部CT。排除标准:(1)CT图像有严重伪影,导致病灶不易观察和测量者;(2)肺内多发GGN或为mGGN。最终纳入102例pGGN肺腺癌患者,依据病灶浸润程度分为A组50例(AIS 22例,MIA 28例)和B组52例(IAC 52例,包括腺泡为主型16例,贴壁为主型22例,乳头为主型14例)。收集的临床资料包括年龄、性别、肿瘤史、吸烟史、高血压史、糖尿病史。
1.2 扫描方法采用GE Discovery CT扫描。扫描范围为自胸廓入口处至肺底。管电压为120 kVp,管电流为100~600 mAs,旋转速度为0.5 s,扫描层厚和层间距为5 mm,螺距为1.375∶1。重建层厚及层间距均为1.25 mm。
1.3 图像分析
1.3.1结节的影像学定性指标 将所有图像导入GE HealthCare ADW 4.7工作站进行分析及测量。由两名具有10 a以上丰富胸部影像诊断经验的放射科医生独立阅片,当诊断意见不一致时再共同商讨决策。评估指标:结节的位置(左肺上叶、左肺下叶、右肺上叶、右肺中叶、右肺下叶),密度均匀度(均匀、欠均匀、不均匀),形状(圆形、椭圆形、多角形、不规则形),瘤肺界面(清晰、不清晰),边缘(光滑、分叶、毛刺、分叶+毛刺),内部及周边征象(空泡征、空气支气管征、胸膜凹陷征、异常血管征)。密度均匀指病变内无任何透亮区。密度不均匀指的是病变内有3个以上透亮区。介于两者之间为密度欠均匀。
1.3.2结节的影像学定量指标 分析方法与结节的影像学定性指标一致。(1)最大径:测量病灶最大轴面的最长径,连续测量3次取平均值。(2)平均CT值、体积、质量:将图像导入GE Lung VCAR AW 4.7软件进行测量,启动Lung VCAR Single模块,选出病灶层面,对GGN进行自动分段,显示分段的pGGN以及在VR分段视图上自动算出的结节体积(mm3)和平均CT值(HU),然后将平均CT值转换为假定物理密度ρ(mg·mm-3)即CT值+1 000,根据公式m=ρ·V·10-3(mg)得出pGGN质量[5]。
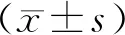
2 结果
2.1 一般资料A组和B组平均年龄分别为(52.18±9.61)、(55.92±11.33)岁。两组年龄比较,差异无统计学意义(t=1.795,P=0.076>0.05)。两组性别、呼吸道症状、肿瘤史、吸烟史、高血压史、糖尿病史情况比较,差异无统计学意义(均P>0.05)。见表1。
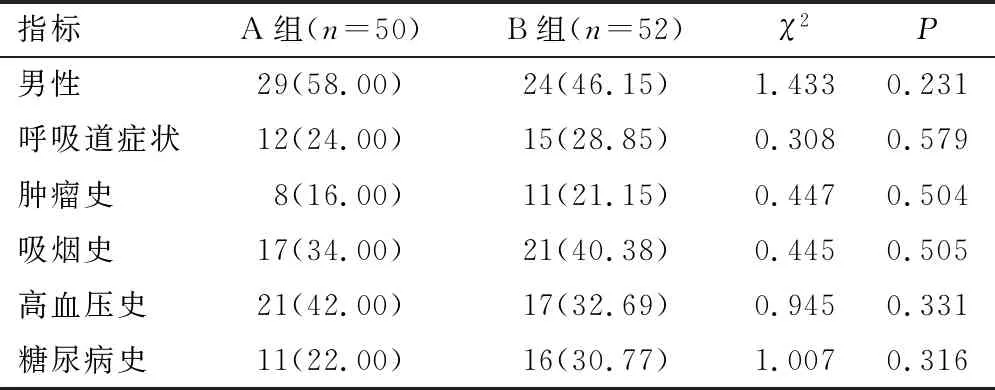
表1 两组一般资料比较[n(%)]
2.2 病灶影像学定性指标B组病灶出现密度不均匀、瘤肺界面清晰、异常血管征的比例均高于A组,差异有统计学意义(均P<0.05)。两组病灶的部位、形状、边缘、空泡征、空气支气管征、胸膜凹陷征分布情况比较,差异无统计学意义(均P>0.05)。见表2。
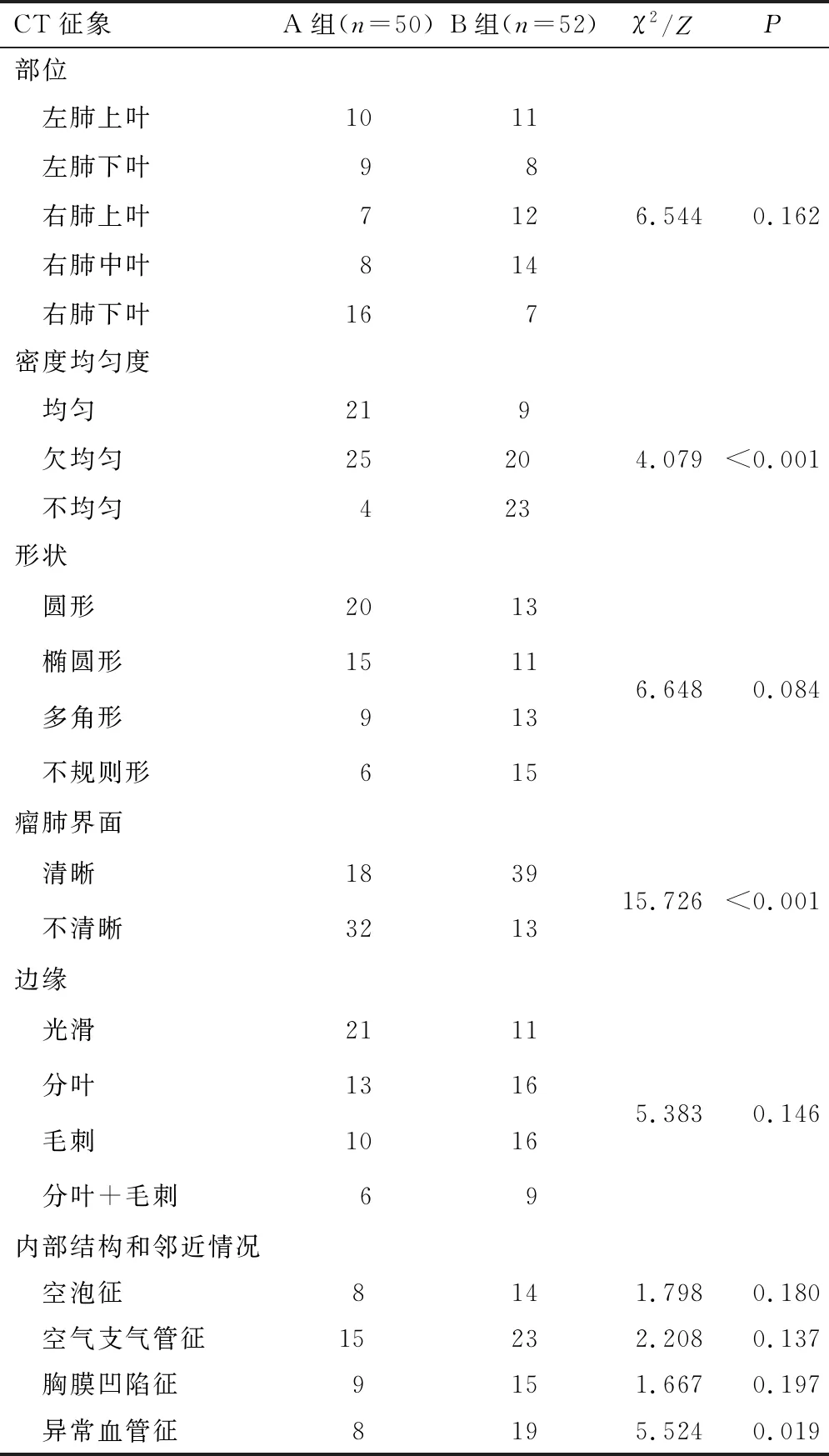
表2 两组病灶影像学定性指标比较
2.3 病灶影像学定量指标B组病灶的体积、质量大于A组,差异有统计学意义(均P<0.05)。两组病灶的最大径、平均CT值比较,差异无统计学意义(均P>0.05)。见表3。
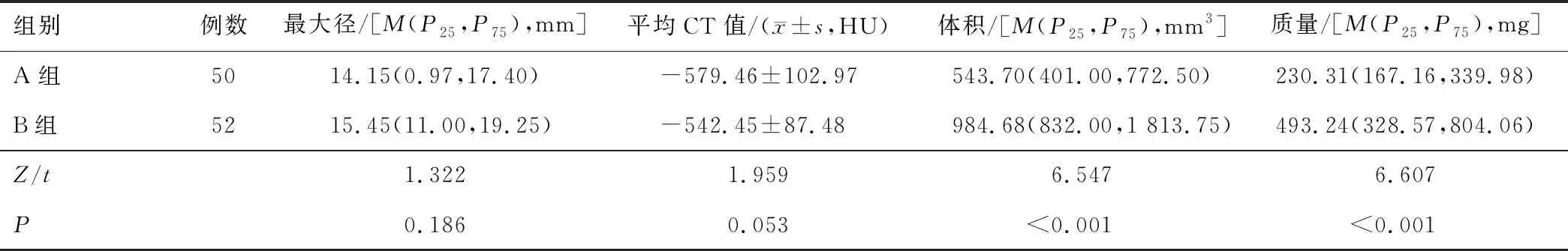
表3 两组病灶影像学定量指标比较
2.4 病灶体积及质量的ROC曲线分析结果通过病灶体积、病灶质量诊断pGGN肺腺癌病理亚型的最佳阈值分别为843 mm3、289 mg。所对应的AUC、敏感度、特异度见表4。
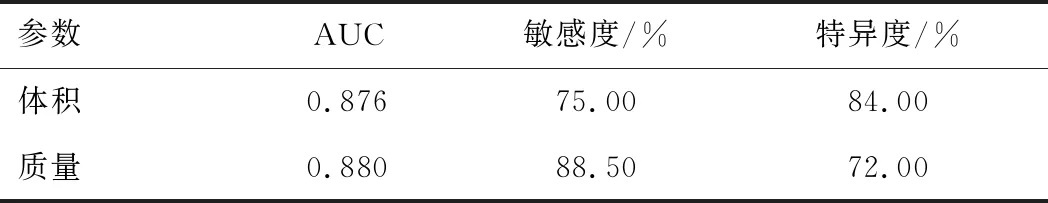
表4 两组病灶体积及质量ROC曲线分析结果
3 讨论
pGGN不含实性成分,在纵隔窗上不显影,在肺窗上表现为局灶性密度增高影,且不掩盖其内走行的血管及支气管影。pGGN肺腺癌病理分类不同,治疗方式及预后也不同。目前,MDCT检查是筛查与诊断pGGN肺腺癌的主要手段。因此,依据其影像学特征对pGGN肺腺癌进行正确的病理分类,有助于指导个体化治疗。
本研究结果显示,两组患者性别、年龄、呼吸系统疾病史等临床资料无明显差异,但由于本研究未纳入mGGN患者且病灶数量较少,病灶的病理分类与患者的一般资料是否有关有待于进一步研究。本研究显示,B组病灶出现密度不均匀的比例高于A组,与金鑫等[6]研究结果基本一致。考虑原因为B组病灶相较于A组浸润程度增加,对支气管活瓣作用的影响更大,导致病灶内部出现多个小透亮区。在本研究中,B组病灶出现瘤肺界面清晰的比例高于A组。吴芳等[7]研究发现,瘤肺界面清晰是提示pGGN浸润性的一个重要CT征象。导致IAC瘤肺界面清晰的病理机制可能为病灶内部浸润成分增加,呈堆积式生长,或肿瘤生长迅速推压邻近肺组织形成假包膜。AAH及MIA由于浸润成分相对较少,瘤组织排列稀疏,生长范围较松散,导致出现模糊的瘤肺界面。异常血管征是指穿通于pGGN中的血管扭曲扩张,管壁僵硬,走形僵直及血管集聚等异常征象。异常血管征可以预测病变浸润性[8-9]。B组病灶出现异常血管征的比例高于A组。推测原因可能为病灶浸润程度的增加导致病灶内部微环境改变、瘤组织高代谢和高血供,从而出现供血血管的异常改变。
pGGN的大小与其浸润性有关,pGGN越大,提示恶性等级越高[10]。葛欢等[11]研究发现,病变大小不是鉴别pGGN病理分类的独立影响因素。分析原因可能为pGGN大小的测量方法不同。本研究选择了最大径及体积反映pGGN病灶的大小,结果显示,两组最大径无明显差异,而B组病灶体积大于A组。最大径为人工测量所得,存在一定的测量误差,且只考虑了结节最大截面的最长径,不能全面反映结节在三维空间的大小,存在一定的评估偏差。体积参数是由软件对pGGN进行自动分割测量并显示三维图像所得,排除了人工测量参数所致的误差,能更真实地反映结节在三维空间的大小,准确性、可重复性更高。两组平均CT值无明显差异。这可能是因为pGGN多为早期肺腺癌,体积小,密度低。综合结节体积和CT值参数计算质量后比较,B组病灶质量大于A组。其鉴别两组病灶的最佳阈值为289 mg。Hwang等[12]研究显示,质量参数是鉴别IAC的独立危险因素。Lim等[13]研究表明,结节的质量甚至可以判断患者预后。这可能是因为计算结节的质量时,在考虑pGGN大小的同时,也兼顾了结节CT值的变化。相比于体积和CT值参数,质量测量能够更加全面地反映结节的整体情况。
综上所述,结合pGGN的体积、质量、密度均匀度、瘤肺界面、异常血管征进行综合分析,有助于pGGN肺腺癌病理分类的鉴别诊断,从而指导临床医生选择合适的治疗方案。本研究为单中心研究,样本数量较少,所选取的病例只局限于恶性pGGN,需要进一步研究多中心病例或扩大样本量。
