AECA、VEGF在自身免疫性肺气肿大鼠中的表达及甲泼尼龙琥珀酸钠的干预效果
2020-02-26张朝杰尚会娜孙广信
张朝杰,尚会娜,2,孙广信
(1.郑州市第一人民医院 呼吸内科,河南 郑州 450000;2.遵义医科大学,贵州 遵义 563000)
近年来有研究[1-2]表明,抗血管内皮细胞抗体(anti-endothelial cells antbodies,AECA)及血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)参与慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的发生及恶化,其作用机制尚不清楚,能否被常规免疫抑制剂(甲泼尼龙琥珀酸钠,简称甲强龙)逆转鲜少报道。本研究通过建立自身免疫性肺气肿大鼠模型,观察甲强龙对血清、支气管肺泡灌洗液(bronchial alveolar lavage fluid,BALF)中AECA、VEGF水平及肺泡隔细胞凋亡指数等的影响及各指标相关性,为肺气肿的防治提供一定科学的依据。
1 材料与方法
1.1 实验动物及材料大鼠AECA、VEGF试剂盒(武汉博士德生物工程公司);注射用甲强龙(美国辉瑞公司有限公司);550酶标仪(美国Bio-Rad公司);DL-低速大容量离心机(上海安亭科学仪器厂);BX41TF型光学显微镜(日本OLYBUS公司);完全弗氏佐剂(美国sigma公司);原位细胞凋亡末端转移酶标记技术(TUNEL)检测试剂盒(瑞士Roche公司)。健康清洁SD雄性大鼠30只[许可证号:SCXK(豫)2017-016,NO:0201754,郑州大学医学院实验动物中心提供],鼠龄为10周左右,体质量为(180.0±30.0)g。本实验上报郑州市第一人民医院医学伦理委员会备案。
1.2 实验方法
1.2.1自身免疫性肺气肿大鼠模型组、干预组及对照组的建立 采用随机数表法将30只SD大鼠分为对照组、模型组、干预组。参照文献[3]的方法建立自身免疫性肺气肿模型:取4~6代人脐静脉内皮细胞1×107加入1 mL完全弗氏佐剂,制备成“油包水”乳状液,注入模型组大鼠腹腔内。给予干预组大鼠上述等量的人脐静脉内皮细胞和完全弗式佐剂悬浮液,同时给予甲强龙10 mg·kg-1·d-1[4]。对照组大鼠仅接受1 mL完全弗式佐剂腹腔内注射。在实验室按昼夜节律采光12 h,通风条件良好,室内温度保持在20 ℃左右,每隔3 d消毒1次。大鼠自由取食、饮水。全部营养饲料购于郑州大学实验动物中心。21 d后处死所有大鼠,随后进行如下检测。
1.2.2大鼠肺组织病理标本制作及形态学定量分析 参照文献[5]的方法行支气管肺泡灌液术、肺组织分离及相关处理。于左肺行支气管肺泡灌洗收集BALF(回收率80%~90%),离心取上清液,移入无菌瓶,保存于-70 ℃冰箱中待测。结扎左主支气管、右中上肺支气管,40 g·L-1多聚甲醛注入右下肺,胸膜铺平,右下肺边缘膨胀变锐,30 min后取出右下肺,放入多聚甲醛中固定24 h。石蜡包埋、切片,常规苏木素-伊红(hematoxylin-eosin staining,HE)染色,光镜下观察HE染色的肺组织,按张程等[6]所叙述的方法计算平均内衬间隔(mean liner intercept,MLI)和平均肺泡数(mean alveolar number,MAN)。
1.2.3细胞因子检测 采用酶联免疫吸附法(enzyme-linked immuno-sorbent,ELISA)测定血清、BALF中AECA、VEGF水平,严格按ELISA试剂盒说明书进行操作。
1.2.4肺泡隔细胞凋亡检测 采用TUNEL法检测肺泡隔细胞凋亡情况,按试剂盒说明书步骤进行,计算各组中肺泡隔细胞凋亡指数(apototic index,AI)。AI为TUNEL阳性细胞数占肺泡隔总细胞数的百分比,每例标本取3张切片,每张切片观察5个高倍视野(×400)。

2 结果
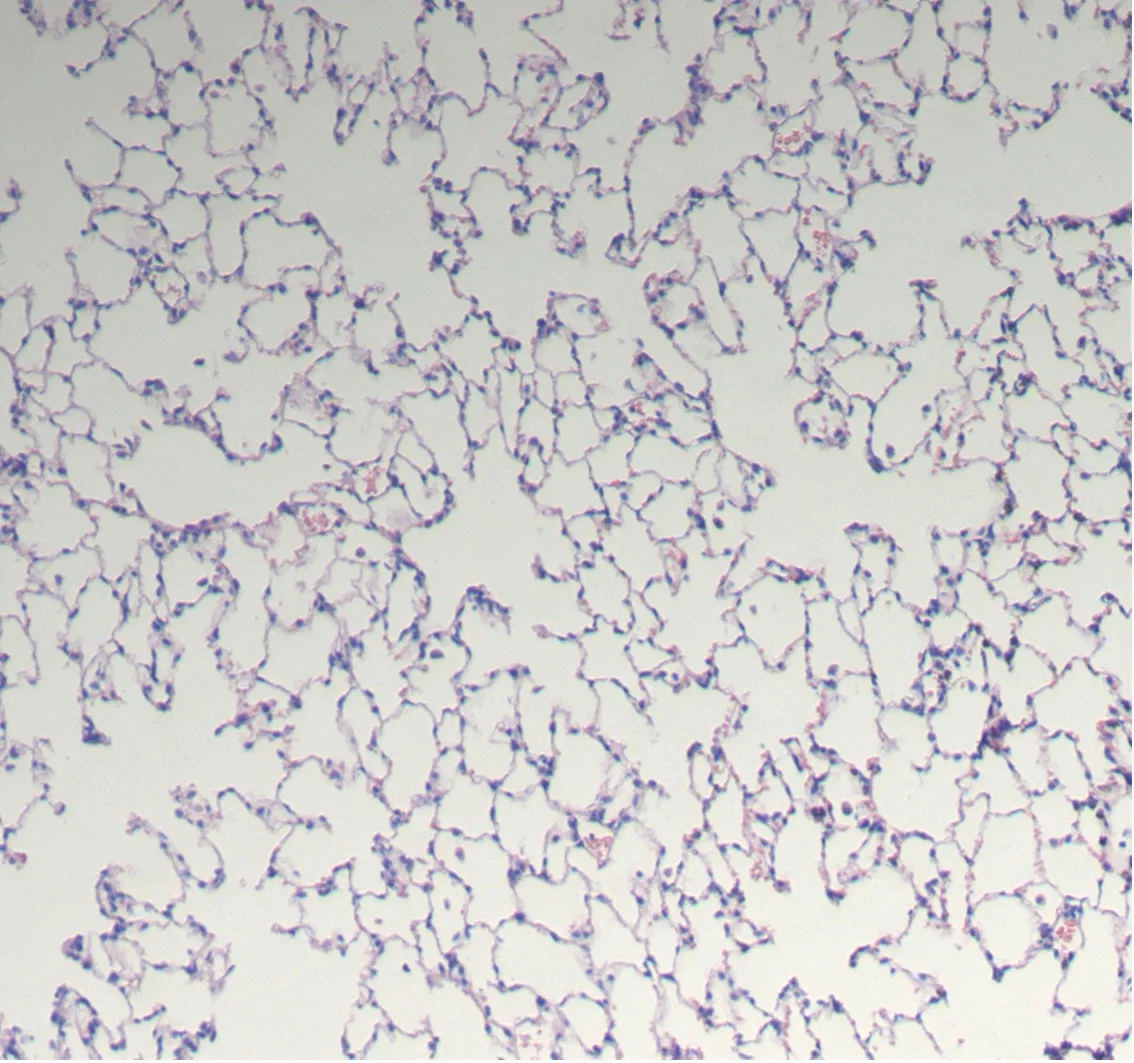
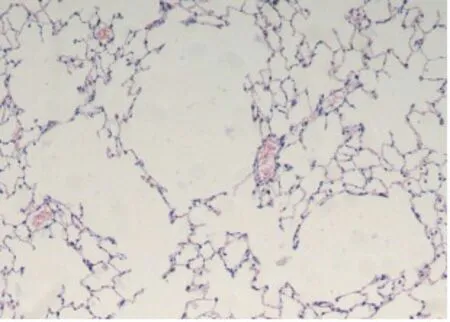
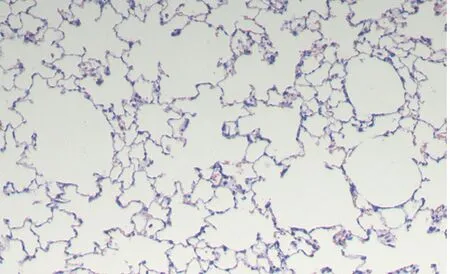
2.1 肺组织HE染色切片对照组气道结构清楚,气管内表面纤毛整齐规整、丰富,未见脱落现象,肺组织结构完整,肺泡隔清晰可见,有少许炎症细胞浸润。模型组及干预组气道及肺泡内可见较多炎症细胞浸润,纤毛脱落、倒伏,肺泡隔变薄甚至部分断裂,相互融合,形成肺大泡。干预组较模型组变化轻。见图1。模型组MLI较对照组高,MAN较对照组低,差异有统计学意义(均P<0.05)。干预组MLI较模型组低,MAN较模型组高,差异有统计学意义(均P<0.05)。见表1。
A
B
C
A为对照组,B为模型组,C为干预组。
图1各组大鼠肺组织病理染色结果(HE染色,×100)

表1 3组大鼠MLI、MAN比较
注:与对照组比,aP<0.05;与模型组比,bP<0.05; MLI—平均内衬间隔,MAN—平均肺泡数。
2.2 各组大鼠AECA、VEGF水平比较模型组血清及BALF中AECA水平高于对照组,VEGF水平低于对照组,干预组血清及BALF中AECA水平低于模型组,VEGF水平高于模型组,差异有统计学意义(均P<0.05)。见表2。
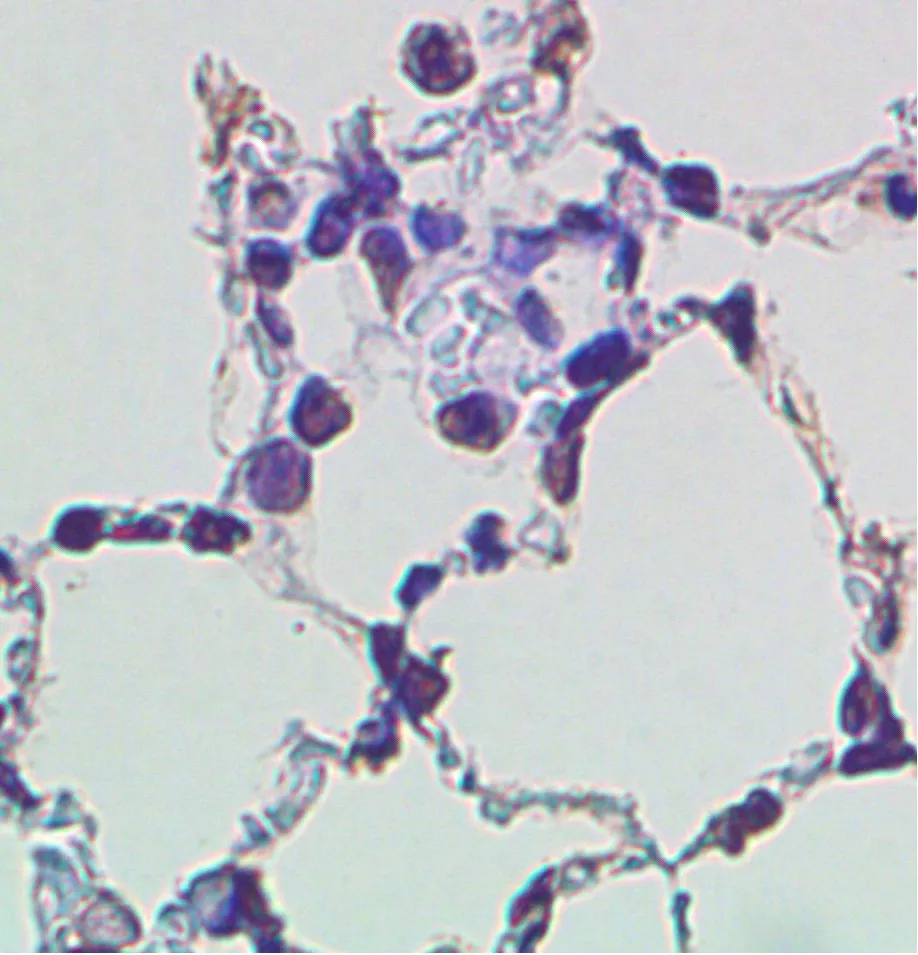
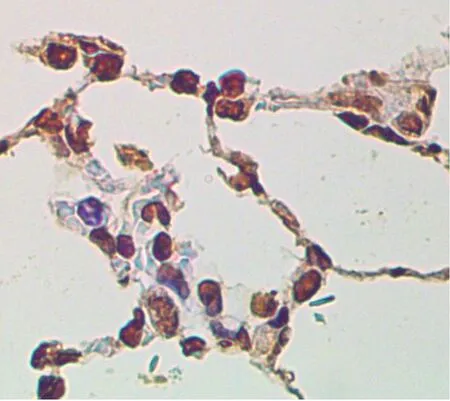
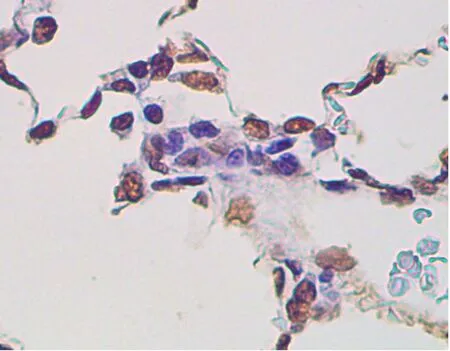
2.3 各组AI比较对照组、模型组、干预组的AI分别为8.73±3.26、25.68±5.49、14.25±4.32。模型组AI比对照组高,干预组AI比模型组低,差异有统计学意义(均P<0.05)。见图2。

表2 各组大鼠AECA、VEGF水平比较
注:与正常对照组比,aP<0.05;与模型组比,bP<0.05;AECA—抗血管内皮细胞抗体,VEGF—血管内皮细胞生长因子,BALF—支气管肺泡灌洗液。
2.4 各组指标相关性模型组、干预组大鼠血清AECA水平与VEGF水平呈负相关(r=-0.652,P<0.05),AECA水平与AI呈正相关(r=0.524,P<0.05),VEGF水平与AI呈负相关(r=-0.564,P<0.05)。模型组、干预组BALF中AECA水平与VEGF水平呈负相关(r=-0.546,P<0.05),AECA水平与AI呈正相关(r=0.638,P<0.05),VEGF水平与AI呈负相关(r=-0.513,P<0.05)。
A
B
C
A为对照组,B为模型组,C为干预组。
图2各组大鼠肺泡隔细胞凋亡情况(TUNEL法染色,×400)
3 讨论
AECA是一种可与血管内皮细胞表面结构抗原结合导致血管内皮细胞退化和凋亡的抗体[7]。焦油、尼古丁等外源性化合物在肺部沉积,诱导自身免疫反应发生,抗核抗体、抗组织抗体及AECA等自身抗体显著增多[2-3,5],VEGF减少[8],导致肺泡间隔血管内皮细胞退化,肺泡间隔破裂,导致肺气肿形成。张璐等[5]发现吸烟致肺气肿大鼠血清、BALF中AECA较对照组增多,提示AECA可能参与肺气肿的形成。本实验发现模型组血清、BALF中AECA水平增高,VEGF水平降低,AECA水平与VEGF水平呈负相关,与AI呈正相关,说明AECA水平升高及VEGF水平降低可能促进肺泡隔细胞凋亡,导致肺泡隔变薄,部分肺泡破裂融合,肺形成气肿。
甲强龙是临床常用的高效、速效糖皮质激素类药物,具有较强的抗炎、免疫抑制、抗休克等作用。有关资料显示,糖皮质激素可能通过抑制AECA的过度表达,缓解类风湿关节炎等自身免疫系统疾病的进程。张璐等[5]研究显示甲强龙干预的吸烟致肺气肿大鼠AECA水平低于未干预组,表明糖皮质激素可能干预AECA的表达而抑制肺气肿形成。韩婧等[8]发现糖皮质激素可能参与控TNF-α、MMP-9、VEGF、VEGFR-2表达及抑制肺泡隔细胞凋亡,从而抑制大鼠自身免疫性肺气肿形成。本研究发现干预组大鼠血清、BALF中AECA水平较模型组低,VEGF水平较模型组高,肺泡隔细胞凋亡数较少,AECA水平与VEGF水平呈负相关,提示糖皮质激素可能通过抑制AECA的过度表达,提高VEGF的表达,从而抑制肺泡隔细胞凋亡,对肺气肿的治疗有一定作用。
综上所述,AECA、VEGF参与自身免疫性肺气肿大鼠肺泡隔细胞凋亡,其机制可能为AECA表达增高导致VEGF表达下降,甲强龙可能通过影响AECA、VEGF水平导致肺泡隔细胞凋亡下降,进而抑制肺气肿的形成。
