骨髓间充质细胞在聚醚醚酮片和纯钛片表面的体外生物相容性比较
2020-02-26连克乾张昕周捷宇廖燕芬司姗姗
连克乾, 张昕, 周捷宇, 廖燕芬, 司姗姗
1.中山大学附属第一医院口腔科,广东 广州(510080); 2.南方医科大学口腔医院番禺院区种植修复科,广东 广州(511400); 3.南方医科大学口腔医院综合急诊科,广东广州(510280)
目前纯钛(titanium,Ti)被普遍应用于临床的牙种植体材料,但在种植失败的病例中,其逐渐展露出因应力遮挡效应导致的植体周围骨吸收、基台折裂、种植体周围炎、本体感受器缺乏、骨整合时间长及远期存活率不确切等缺点[1⁃2]。聚醚醚酮(polyetheretherketone,PEEK)已被应用于医学各个领域,包括骨、关节、脊柱和颅骨颌面部的骨缺损修复和植入物更换,以及心脏瓣膜及整形外科。PEEK具有良好的机械性能,其弹性模量为3~4 GPa,接近骨松质,弯曲强度大于140 MPa,拉伸强度大于93 MPa[3],在口腔医学领域也引起国内外学者广泛关注。但对于PEEK作为牙种植体原材料在生物相容性方面与纯钛相比较的效果尚不确切。本实验比较了骨髓间充质细胞在PEEK和Ti表面的体外生物相容性,旨在探究PEEK是否具有优于Ti的体外生物相容性,为PEEK应用于牙种植体原材料方面提供研究基础。
1 材料和方法
1.1 主要材料和仪器
聚醚醚酮棒(深圳大蓝塑业有限公司),钛棒(日本住友集团),热场发射扫描电镜JSM⁃6330F(日本电子株式会社),Alamarblue(Sigma⁃Aldrich公司,美国),全自动酶标仪Infinite200(Tecan公司,瑞士),碱性磷酸酶AKP测试盒(南京建成生物工程研究所),BCA蛋白定量试剂盒(康为世纪公司,中国),茜素红(天津市天新精细化工公司),十六烷基吡啶(Sigma⁃Aldrich公司,美国)。
1.2 细胞培养
骨髓间充质细胞来源自出生3~4 d的SD乳鼠[SD乳鼠来源于中山大学动物实验中心,实验动物质量许可证号SCXK(粤)2011⁃0029],实验中对动物处置符合动物伦理学要求,于体外分离提取原代细胞,并传代培养至第3代或第4代细胞用于各组实验(图1),细胞接种于各个试件表面的接种密度为1× 105个/mL。
1.3 茜素红染色矿化结节情况
为研究SD乳鼠骨髓间充质细胞在体外成骨诱导环境下分化为成骨细胞的能力,采用1%茜素红染色,倒置显微镜下观察,骨髓间充质细胞在加入成骨诱导剂培养7 d、14 d后,形成矿化结节的情况如图2所示。
Figure 1 Morphology of the bone marrow mesenchymal cells observed by inverted microscopy图1 倒置显微镜下骨髓间充质细胞形态

Figure 2 Alizarin red staining mineralization nodules图2 茜素红矿化结节染色
1.4 试件制备
将直径为10 mm的PEEK棒和Ti棒切割成厚度为1 mm、直径为10 mm的圆片状PEEK片(PEEK组)和Ti片(Ti组),用200#、500#、1200#的碳化硅砂纸逐级打磨抛光。依次用丙酮、无水乙醇、超纯水超声清洗10 min,高温高压(103.4 kPa,121.3℃,30 min)消毒灭菌后干燥备用(图3)。

Figure 3 PEEK and Ti images图3 PEEK片和Ti片实物图
1.5 扫描电镜观察细胞的黏附形态
PEEK组和Ti组各组内随机选取试件,每个时间点每组设置5个平行试件。将骨髓间充质细胞按照相同密度(1×105个/mL),相同接种量(600 μL)接种于各试件表面,分别于1、4、24 h终止培养,扫描电镜观察试件表面细胞形态。
1.6 Alamarblue方法检测细胞的黏附和增殖能力
PEEK组和Ti组各组内随机选取试件,每个时间点每组设置5个平行试件,且每个时间点设置空白孔和背景孔。将骨髓间充质细胞按照相同密度(1× 105个/mL)、相同接种量(600 μL)接种于各试件表面,分别于1 h、3 h、1 d、3 d终止培养,将各试件置于等量Alamarblue溶液中,孵育24 h,全自动酶标仪检测570 nm和600 nm波长下样本的吸光度值。各试件吸光度值计算公式:OD=OD570nm⁃OD600nm。
1.7 碱性磷酸酶(alkaline phosphatase,ALP)活性检测
PEEK组和Ti组各组内随机选取试件,每个时间点每组设置5个平行试件。将骨髓间充质细胞按照相同密度(1× 105个/mL)、相同接种量(600 μL)接种于各试件表面,于接种24 h后成骨诱导培养,分别于成骨诱导培养的第7、14天终止培养,按照碱性磷酸酶试剂盒说明书操作,全自动酶标仪测定520 nm波长下,各组吸光度OD值。同时按照BCA蛋白定量试剂盒说明书操作测定蛋白浓度,全自动酶标仪测定560 nm波长下各组吸光度,绘制标准曲线,计算样品中的蛋白浓度。通过BCA蛋白定量分析公式和ALP试剂盒计算公式,得到各个时间点PEEK组和Ti组的细胞ALP活力值(金氏单位/gprot)。
1.8 茜素红染色矿化结节半定量检测
PEEK组和Ti组各组内随机选取试件,每个时间点每组设置5个平行试件,且每个时间点设置背景孔和空白孔各1个。将骨髓间充质细胞按照相同密度(1× 105个/mL)、相同接种量(600 μL)接种于各试件表面,于接种24 h后成骨诱导培养,分别于成骨诱导培养的第7、14天终止培养,加入1%茜素红溶液及10%十六烷基吡啶水溶物,于562 nm波长全自动酶标仪处检测处吸光度,去除背景值后的OD值与矿化结节的矿化程度成正比。
1.9 统计学分析
采用SPSS 13.0软件对结果进行统计分析。本研究数据类型为计量资料,数据用均数 ±标准差表示。对于两组独立样本数据,若满足正态性和方差齐性采用两独立样本的t检验进行统计推断;若两样本所属总体均符合正态性,但方差不齐,则采用校正的t检验。检验水准α=0.05。
2 结果
2.1 扫描电镜下细胞黏附形态观察
为比较骨髓间充质细胞在PEEK片和Ti片试件表面的黏附形态,扫描电镜下观察骨髓间充质细胞的形态如图4所示。复合培养1 h后,细胞在PEEK片和Ti片表面均呈圆球状突起,未完全铺开伸展,边缘部分铺展于试件表面;复合培养4 h后,试图在各试件表面伸展,形态不规则,可见明显的板状伪足;复合培养24 h后,细胞在各试件表面完全伸展铺平,伪足明显,呈典型成骨细胞形态,大多数为梭形、多角形。表明骨髓间充质细胞在PEEK片和Ti片试件表面均可黏附、增殖生长,且形态无明显差异。

Figure 4 SEM showing the morphology of bone marrow mesenchymal cells cultured on PEEK and Ti substrates after 1,4 and 24 hours图4 扫描电镜下PEEK与Ti试件表面骨髓间充质细胞接种1 h、4 h、24 h的形态
2.2 Alamarblue方法检测细胞的黏附和增殖能力
Alamarblue法检测显示(表1),PEEK组与Ti组1 h的 OD值为0.321±0.010与0.285±0.008,差异有统计学意义(t=5.354,P=0.001);PEEK组与Ti组3 h的 OD值为0.323±0.008与0.296±0.012,差异有统计学意义(t=4.018,P=0.004)。uPEEK⁃uTi的95%置信区间也表明PEEK组的OD值高,即骨髓间充质细胞在PEEK组表面培养1 h、3 h时的活细胞数均高于Ti组。
比较骨髓间充质细胞在各组试件表面的增殖能力(表1),结果表明:PEEK组与Ti组1 d的 OD值为0.233±0.020与0.220±0.007,差异有统计学意义(t=3.690,P=0.015);PEEK组与Ti组3 d的OD值为0.182±0.007与0.127±0.011,差异有统计学意义(t=9.071,P<0.001)。 uPEEK⁃uTi的95%置信区间也表明PEEK组的OD值高,即骨髓间充质细胞在PEEK组表面培养1 d、3 d时的活细胞数均高于Ti组。
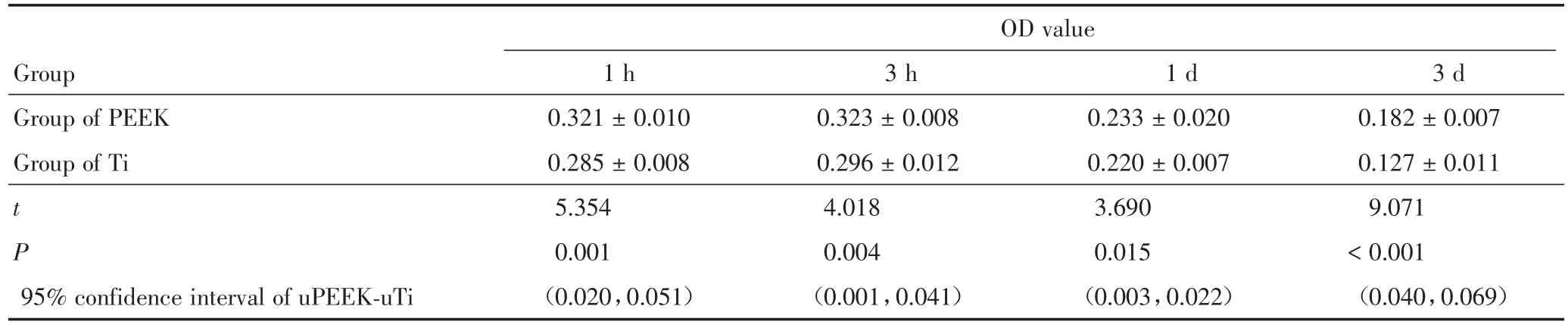
表1 骨髓间充质细胞在各组试件表面培养的黏附与增殖情况Table 1 The adhesion and proliferation of the bone marrow mesenchymal cells on all substrates x±s
2.3 ALP活力测定
测定成骨诱导下骨髓间充质细胞在各组试件表面的ALP活性(表2),在PEEK组与Ti组培养7 d后,活力值为(10.849±0.949)gprot与(4.888±0.784)gprot,差异有统计学意义(t=10.831,P<0.001);在PEEK组与Ti组培养14 d后,活力值为(7.050 ± 1.001)gprot与(4.938 ± 0.712)gprot,差异有统计学意义(t=4.385,P=0.001)。uPEEK⁃uTi的95%置信区间也表明,培养7 d、14 d时PEEK组的细胞ALP活性高于Ti组。
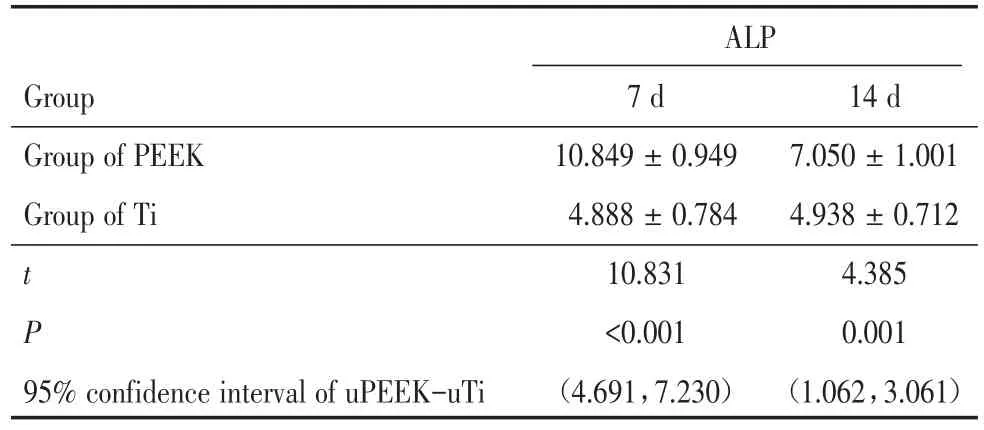
表2 成骨诱导的骨髓间充质细胞在各组试件表面培养7 d、14 d后的碱性磷酸酶活性Table 2 ALP activity of the osteogenesis induced bone marrow mesenchymal cells cultured on all substrates for 7 and 14 days x±s,gprot
2.4 茜素红染色矿化结节半定量测定
成骨诱导的骨髓间充质细胞在各组试件表面接种培养7 d、14 d后,经茜素红染色,十六烷基吡啶矿化结节半定量分析(表3),在PEEK组与Ti组培养7 d后,OD值为0.552±0.181与0.296±0.055,差异有统计学意义(t=3.026,P=0.031);在PEEK组与Ti组培养14 d后,OD值为1.034±0.233与0.583± 0.080,差异有统计学意义(t=4.100,P=0.010)。uPEEK⁃uTi的95%置信区间也表明PEEK组的OD值高,即PEEK组的矿化程度高于Ti组。
3 讨论
牙种植体材料是否具有良好的细胞黏附增殖性能,是评价其生物学性能的重要指标之一。当牙种植体植入颌骨内,周围血液及组织液中的蛋白便迅速吸附至种植体表面,以此诱发之后的细胞与种植体直接或间接的黏附作用[4]。细胞黏附是细胞增殖分化等后续细胞行为的首要步骤,也是细胞与牙种植体最早发生的反应。在1~4 h细胞黏附行为最为旺盛,24 h后定植于种植体表面的细胞,便开始增殖行为。理想的牙种植体材料应有利于细胞的早期黏附,能促进细胞的增殖并为细胞生长提供合适的微环境[5]。ALP是成骨分化的早期生化指标[6]。ALP活性的高低可反映成骨分化的程度及功能状态,其活性越高,说明成骨方向分化越明显,成熟度越高,细胞活力旺盛。因此分化早期可用ALP活性判断细胞的成骨分化能力,后期的成骨指标主要采用形成矿化结节的能力来判断。

表3 成骨诱导的骨髓间充质细胞在各组试件表面培养7 d、14 d的矿化程度Table 3 The mineralization of the osteogenesis induced bone marrow mesenchymal cells cultured on all substrates for 7 and 14 days x±s
本实验对PEEK与Ti进行了体外细胞生物相容性的比较,通过骨髓间充质细胞在PEEK材料表面的黏附、增殖和成骨能力评价PEEK的细胞生物相容性,探讨PEEK作为牙种植体新材料的可能性。扫描电子显微镜观察结果显示,骨髓间充质细胞在PEEK片和Ti片试样表面均可黏附,并无明显差异,说明PEEK和Ti均有细胞黏附能力;但在Alamarblue检测实验中观察到不同时间点,PEEK组的活细胞数均高于Ti组,说明PEEK组的黏附及增殖情况均优于Ti组。碱性磷酸酶试剂盒和茜素红染色矿化结节半定量分析,结果表明PEEK组的ALP活性和矿化程度均高于Ti组。
国内外学者在PEEK及其复合物的生物相容性方面已有很多探索,PEEK及其复合材料被认为是一种先进的生物材料,用于治疗创伤、关节成形术或组织丢失损伤[7]。近年来有关PEEK性能的报道,揭示了其机械性能优于现有的牙科金属材料[8]。PEEK的弹性模量为3~4 GPa,加入碳纤维后可以将弹性模量提高到18 GPa,接近骨皮质的弹性模量(15 GPa)。在生物相容性方面,PEEK对人体器官既没有诱变作用,也没有细胞毒性的证据,这说明其具有良好的生物相容性。PEEK在纳米水平进行修饰后,可以提高其生物活性和骨传导性能。纳米粒子(如TiO2、HAF、HAp等)可与PEEK结合形成具有生物活性的纳米复合材料[9]。另外,Nakahara等[10]在动物体内研究中将涂层和未涂层的碳纤维增强PEEK及钛合金种植体分别进行兔股骨拔出试验,结果显示涂层的碳纤维增强PEEK种植体于植入的第6周界面剪切应力消失,而涂层的钛合金种植体于植入的第12周界面剪切应力才消失;于之后2周再对未涂层碳纤维增强PEEK和钛合金样品进行评估,得出了与人类成骨细胞相似的反应,在该研究中未涂层的碳纤维增强PEEK植体的剪切强度显著低于涂层的植体剪切强度。此结果表明PEEK及其复合材料能够比Ti更早达到骨结合,这与本文的体外细胞生物相容性实验中得到的结果相呼应,即PEEK的细胞生物相容性优于Ti。
尽管PEEK具有良好的生物相容性、射线可穿透性、弹性模量与骨组织接近,但它是一种生物惰性材料,无法形成良好骨结合。目前已有大量研究通过PEEK及其复合物表面改性的方法来提高生物活性[11]。比如使用地塞米松加负载米诺环素的脂质体(Dex/Mino脂质体)修饰的PEEK表面具有良好的稳定性和细胞相容性,并具有增强抗菌、抗炎和骨整合能力[12]。还有通过快速环境温度磺化处理PEEK表面,以提高其亲水性和骨传导性,用于骨植入[13]。也有利用加速中性原子束处理技术,增强了PEEK的体内外生物活性,提高植入性医疗器械的生物活性等[14]。由此可见PEEK表面修饰可增强其作为牙种植体植入材料的细胞黏附、增殖、生物相容性和成骨性能;PEEK还能影响生物膜结构,减少种植体周围炎症的发生[15]。将来需要对PEEK种植体进一步研究和更多的临床对照试验,使它可以取代Ti成为牙种植体材料。
