疫苗研发的沉默与远见
2020-02-25陈晶金焱马可欣宋玮
陈晶 金焱 马可欣 宋玮

2020年2月12日,湖南宁乡高新区与湖南卫健委核定的长沙金域医学检验实验室合作,对于园区一些企业的员工进行新冠肺炎核酸检测,医务人员将取样后的拭子装进有取样溶液的试管中保存。图/ 新华
“可能我们会牺牲,但至少我们迎着炮火冲上去了。穿过炮火,就是一片光明。”春节期间,斯微生物CEO李航文在一个深夜这样回复《财经》记者。
斯微生物是此次新型冠状病毒疫苗研发的参与者之一,也是其中为数不多的民营创业公司。对于一家创业公司来说,参与其中意味着极大的机遇,也意味着重大的社会责任、巨大的商业风险与全国的关注。
2003年,北京科兴曾是SARS疫苗研发的主要参与者之一,他们当时经过8个月的攻关,完成了一期临床。但正在关键阶段,SARS疫情结束,疫苗二期临床就此终止。科兴不仅颗粒无收,且为此停掉了成品疫苗生产线,出现了持续亏损。
17年后,当新冠病毒在中国蔓延,曾经斗志昂扬的科兴却表现沉默。1月23日,《财经》记者致电科兴相关人员,对方表示暂不参与此次研发。
当年决定投入SARS疫苗研发时,科兴还是一家创业公司。今天的科兴已经是一家市值4亿美元的美股上市公司。
2月9日,中国疫苗协会微信公号发布消息称17家公司机构正在开展新冠病毒疫苗的研制工作,其中包括科兴控股。记者再次致电科兴,对方表示仍处在非常早期阶段。
新冠病毒疫情爆发后,不断有人问:自2003年SARS爆发以来,冠状病毒已经进攻了人类三次,每一次都给人类带来了巨大的痛苦,可时至今日,为什么我们还没有完成临床试验的冠状病毒疫苗产品?
多位接受《财经》记者采访的专家、学者表达了类似的观点:重大传染性疫苗的研发之路有时颇为漫长、不可预测且代价昂贵。
它的诞生不仅需要科学家努力,更需要政府支持,需要大的资方和药厂接手。如果病毒不再传播,疫苗也就失去了商业意义,企业没有动力再投入。
事实证明,不同类型的冠状病毒从未远离我们。每当遇到重大疫情,政府首要工作重点是建立物理障碍,例如在城市内部或对城际交通进行封锁,以阻止疾病传播。
但在医学专家们眼里,改变游戏规则的最佳方式,或许是识别病毒并找到疫苗和药物来解决它。
“哪怕只有万分之一的可能,我们也要付出百分之百的努力去尝试,这就是科学研究的魅力。”清华大學医学院钱天翼博士说,虽然疫苗可能没有解决当时想解决的疾病,但是不断积累的认知,对后续研发有帮助。
也许,进行疫苗研发的意义即在于此。没有疫苗人类永远只能做被动防御;有了疫苗,人类才有主动出击的机会。
商业公司疫苗研发难题
事实上,针对严重急性呼吸道综合症(SARS)、中东呼吸综合症冠状病毒(MERS),全球都曾在疫情爆发初期集中火力投入疫苗研发,但人类研发疫苗的速度追不上病毒认输的速度。
正如一位科普博主的比喻,当人类磨好了刀举到空中准备砍敌人的时候,敌人已经跑了,这把刀就只能悬在空中。
北京科兴当年就遇上了这样的情况。全球SARS疫情即将结束的时候,正是科兴进行疫苗研发的关键阶段。结果,研发人员们没日没夜地干了两个多月之后,非典疫情基本结束,也意味着科兴牵头研发的疫苗没有了可供进行试验的病人,短期内也就没有了用武之地。
新疫苗未能获得国家采购并不是最大的损失,损失在于为了投入研发丧失的商业机会成本。科兴此前研发出的甲乙肝疫苗和流感疫苗,均因主攻SARS疫苗研发而在那期间停产。
尹卫东后来在公司内部的讲话中提到,在研发的关键阶段,前期国家支持的资金已经用完,公司靠着十多位同事从家里凑了200万元,才给全体员工继续发了三个月的工资。
SARS一期临床试验结果表明,36位受试者均未出现异常反应,其中24位接种疫苗的受试者均产生了抗体,初步证明该疫苗安全有效。但由于疫情已经结束,二期临床迟迟没有获得审批。
另一支研究团队获得一期临床资格后,由于国家经费迟迟没有获批,因此也暂停了研究。
2003年夏天SARS疫情基本结束,国内所有非典相关研发项目先后停摆。
据了解,在SARS、甲流等传染病爆发后,原国家食品药品监督管理局都曾开放过新药、新疫苗研发的绿色审批通道,而一旦疫情结束,绿色通道就会关闭。
此后,还有部分欧美国家学者在继续研究SARS疫苗,不过据医疗垂直媒体Medscape报道,许多基金会、制药公司和政府都在2003年以后先后停止了对研发机构的资金支持。
从目前统计数据看,新冠病毒在短短几十天之内已经蔓延全球,仅在中国就已有6万多人确诊,1500多人死亡。若无法有效救治,代价将会更大。
但一位疫苗研发者告诉记者,国内开发完成一支疫苗的成本至少上亿,而如果要加快速度,成本只会更高。仅靠责任担当或员工从家里凑钱支撑,是不大可能研发成功的,即使侥幸成功,这种模式也无法复制,更不值得推广。
疫苗研发要靠三股力量
科兴的例子证明,大型传染性病毒疫苗研发是一个综合性、长周期、高成本的社会工程,需要商业公司的责任与自觉,但不能只靠商业公司自行探索。
科学家、政府机构、生物医药企业构成了疫苗研发的三股力量,而且缺一不可。政府为疫苗研发提供资金及审批等政策支持;科研机构进行临床前研发;生物医药公司则负责临床研究、批量生产。
科研力量往往是最有动力、理想和决心进行疫苗研发的,他们是这场漫长之路的引路人。
“但能不能做到疫苗上市,不取决于我们的研发。”清华大学医学院钱天翼博士对《财经》记者表示。他所在的张林琦教授团队长期从事新冠病毒研究,去年在MERS病毒研究上取得了突破性进展。
钱天翼说,科研院校更多是临床前研究,一般由学校或国家的科研经费支持。他们团队目前收到了腾讯公益基金会、水滴筹等机构的600万元资金支持。但要推出上市,这600万元无疑杯水车薪,最终还是需要大型生物医药企业接手。
埃博拉病毒疫苗(Ervebo)的研发之路可供借鉴。1980年前后由两位科学家费德曼(Feldmann)和史蒂文·琼斯(Steven Jones)最早在实验室里开始研究埃博拉病毒(纤维病毒科埃博拉病毒属下数种病毒的通用术语),他们曾多次向美国政府机构申请资助,但申请被一再拒绝,因为该病毒当时仅出现在贫穷的非洲国家,疫苗研发缺乏动力。
2014年,埃博拉病毒肆虐西非,加拿大政府捐赠了200万美元,这在科学研究上已是一笔巨款。这笔捐赠来自加拿大国防计划,提供资金支持的初衷不是为了防止疫情,而是为了打击生物恐怖主义。
到了生产阶段,整个计划由BARDA(美国生物医学高级研究和发展局)和默克公司接手,才得以进行。而前者为此投入了超过1.75亿美元。
图1:目前主流疫苗技术生产流程
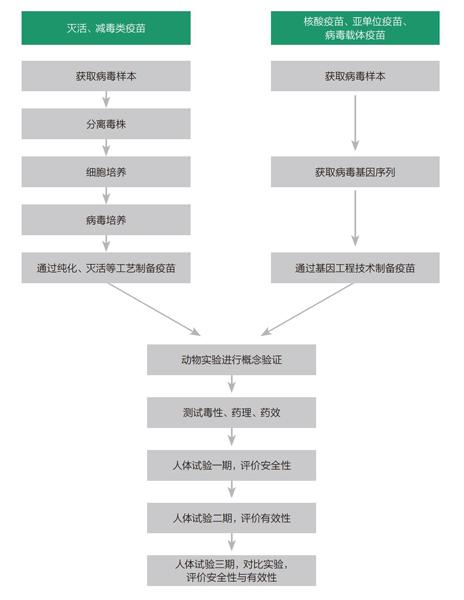
资料来源:《财经》记者根据采访及公开内容整理。制图:颜斌
2018年春,当埃博拉病毒在刚果民主共和国赤道省爆发时,疫苗投入使用。2019年12月19日,FDA(美国食品和药品监督管理局)终于批准了针对18岁以上人群的埃博拉病毒(EVD)疫苗Ervebo的上市。
从1976年埃博拉病毒第一次爆发,到疫苗上市,已经过去了40多年。正因为这个病毒在历史上多次爆发,大药企在后期才有动力进入。
而在整个过程中,世界卫生组织负责人曾数次指责医药行业,称药企对利润的无止境追求是当时尚未做出埃博拉疫苗的原因之一。
疫苗很可能赶不上本次疫情
此次新冠病毒从武汉爆发后不久,科学家们就测出了该病毒的全基因组序列,并于1月11日在网上共享。此举使病毒学家和免疫学家几乎可以立即开始研究疫苗。
从全球看,参与方有美国国立卫生研究院(NIH)下的国家过敏和传染病研究所(NIAID)和生物科技公司Moderna(NASDAQ:MRNA)。NIAID所长安东尼·S·福西(Anthony S. Fauci)在接受《財经》记者采访时表示,他已经开始与Moderna合作研发疫苗,并且将在大约三个月内开始人体第一期试验。
同时,俄罗斯卫生部、昆士兰大学、医药公司Novavax(NASDAQ:NVAX)也宣布开始了新冠病毒的疫苗研发工作。
中国投入疫苗研发的团队包括:中国疾病预防控制中心;香港大学袁国勇教授团队、清华大学张林琦教授团队,以及艾棣维欣与Inovio(NASDAQ:INO)、斯微生物与上海东方医院、武汉博沃与GeoVax(OTCQB:GOVX)等公司合作团队。
它们各自采取的技术路线不同,张林琦教授团队、武汉博沃与GeoVax是通过腺病毒技术研发;艾棣维欣与Inovio通过DNA技术平台;斯微生物与上海东方医院合作;Moderna与美国国立卫生研究院(NIH)合作,后两者都是通过mRNA技术平台研发;还有一部分机构在尝试灭活、减毒类疫苗。
不同技术路径决定的是,疫苗最终研制出来的时间长短、安全性和有效性程度。
美国国立卫生研究院一位不愿具名的科学家在接受《财经》记者采访时表示,目前研发疫苗的多种技术路线中各有优劣,但他相信核酸疫苗技术(DNA/mRNA)相对来说会更快。
传统的灭活、减毒类疫苗制成所需时间漫长,它需要经过以下几个步骤:
首先筛选毒株,找到能代表病毒抗原特征的病毒;接着通过在体外通过鸡胚或者细胞培养病毒,作为以后大规模生产疫苗的种子病毒。并通过灭活、提纯等制备候选疫苗,这些候选疫苗需要在动物身上做筛选,选出合适疫苗后再进行毒理、药理、药效研究,之后进入一二三期临床人体试验,证明安全有效后才可以申请生产许可证,进行量产。
而对于核酸疫苗(DNA/mRNA)而言,在制备阶段便可大大节省时间。因为不再需要通过体外鸡胚或者细胞合成蛋白,直接在体内即可合成——这可能会节省几个月的时间——对于新冠病毒疫苗的研发而言,几个月就是生死线。
“核酸疫苗相当于直接在外卖APP上点单吃饭,而灭活、减毒类疫苗则相当于要从买菜开始一步步做起。”李航文打了个比喻。
灭活、减毒疫苗制备时间长,但技术相对成熟,目前已有多款上市疫苗。腺病毒技术也已经有疫苗特批上市:由国内研发成功的以腺病毒为载体的埃博拉疫苗二期临床完成后,由于缺乏三期临床条件,实现了附带条件批准上市。
核酸疫苗制备时间短,但问题在于mRNA与DNA技术目前尚未有完成临床试验的成品疫苗。
mRNA技术从上世纪90年代开始研发。安东尼·S·福西(Anthony S. Fauci)对《财经》记者表示,mRNA是基因的载体DNA和表达产物蛋白质的中间步骤,负责在细胞核中转录得到DNA上的遗传信息,并在细胞质中由核糖体帮助翻译得到蛋白片段。
mRNA疗法是向患者体内直接递送mRNA,mRNA导入细胞后,利用患者细胞内相应元件直接翻译出蛋白片段的方法。
这一技术因为美国生物科技公司Moderna的崛起而受到关注。2018年Moderna上市筹集了6.043亿美元,创造了生物技术行业有史以来最大的IPO融资纪录。目前Moderna已经有三个项目获得了快速通道资格(FTD)。
这意味着该公司的mRNA药品在提交上市申请后如果符合相关标准则有资格进行加速审批和优先审查,此外也有资格进行滚动审查。
Moderna曾在40天内完成癌症疫苗的制备,并在2019年6月进行了一期临床研究,初步证明了其安全性、耐受性与免疫原性。不过,Moderna采用的mRNA技术目前还没有一款成品药上市,均处于研发阶段。
Moderna此次和NIH合作,也参与到这次新冠病毒疫苗竞赛中。据其2019年Q3数据,其Q3总营收为1700万美元,净亏损为1.232亿美元。
在疫苗研制的多个阶段中,最复杂的就是早期候选疫苗(株)的开发、制备和筛选,如果候选疫苗在动物实验中被证明是安全和有效了,那就相当于成功了一半。
“但这个阶段往往是反复的,可能几个小样被证明都无效或不安全,又得重头开始。”艾棣维欣董事长张璐楠说。
Inovio和艾棣维欣已经在短期完成了多个候选疫苗的制备,正在进行动物实验筛选免疫原性最强的候选疫苗。
Inovio是一家美国生物企业,据2019年Q3数据,其Q3总营收为86.7万美元,净亏损为2310万美元。中国将病毒全基因组序列公布的第二天,该公司就启动了新冠病毒的研发计划,并在两天之内就设计出一种针对刺突蛋白的DNA疫苗。
艾棣维欣成立于2009年,专注研究基因工程疫苗、DNA疫苗、新型疫苗佐剂技术。为了投入此次疫苗研发,该公司于2月10月公布了3000万元的B+轮融资。
斯微生物同样完成了候选疫苗的制备,准备与中国疾控中心病毒预防控制所合作进行疫苗筛选。斯微生物与艾棣维欣两家公司筛选完成并进入后续药效学实验的时间,均估计在今年2月底。
斯微生物2016年在上海张江成立,在国内较早搭建起了mRNA合成平台和LPP纳米递送平台,用于mRNA疫苗的研发。此次为了新冠疫苗研发,也于近期开始了A+轮融资。
采取腺病毒技术进行研发的张林琦团队预计,在今年2月底完成疫苗制备,4月将完成筛选与动物实验。斯微生物预估如果走审批绿色通道,将在4月开始一期临床试验,这一速度基本与Moderna匹敌。
此前,李兰娟院士表示三个月完成疫苗制备,这意味着4月才能开始动物实验。另一个团队——香港大学袁国勇教授团队时间最晚,袁此前表示将在一年内完成临床试验。
到了临床人体试验阶段,不管何种技术路线,都面临同样问题——临床试验阶段的时间难以省去,且耗时较长。
疫苗本身的安全性和有效性也直接影响审批速度。在临床一、二、三期试验中,每个阶段都要审批疫苗的效用,这也是所有疫苗研发中耗时最长的阶段。一旦出现问题,研发就会被叫停。
不过,临床试验可能会加速。有专家表示,疫情扩散下,政府管理部门在保证疫苗安全的前提下,可能会提前向疫苗企业授予生产许可证,允许其将二三期临床试验融合到疫苗使用过程中去做。
也有企业表示,如果审批通过,一、二期临床试验可能合并做。
多位参与疫苗研发的专家接受《财经》记者采访时称,目前最乐观估计,完成二期临床也需要8个月,其中4个月完成临床前阶段,4个-5個月完成临床1期-2期。这还是建立在一二期临床可合并进行,且审批通畅的情况下。
疫苗研发有其自己的周期和规律,人们无法脱离规律行事,有公司或机构宣称3个月、6个月就完成疫苗研发,多指的是完成临床前阶段,距离人们真正用上疫苗还有一段距离。
如果按照目前多数专家的预测,本次新冠病毒疫情若能在3月至4月内结束,那么部分疫苗研发机构的行动,很大可能赶不上本次疫情,不排除再次出现SARS期间商业公司疫苗研发半途而废的情况。
估值逻辑决定企业动力
从历史经验看,疫苗的研发本质上不是技术问题,而是商业投入的远见问题,是社会给商业公司回报是否合理的问题。
李航文说,现在公司已经顾不上效益原则了,在最大程度上用钱换时间。平常测候选的抗原样本只会选两三个,失败再换样本,但现在同时选了十几个样本上来,“有可能的都试一试”。
李航文希望“不算小账算大账”,“如果我们成功了,会被大家记住,那带来的将会是无形资产。”
艾棣维欣则拿到了CEPI(流行病防范创新联盟)的资助,不过董事长张璐楠预估从研发、制备到临床每个阶段CEPI的资金最多只能覆盖30%-50%成本,其余大部分都需要公司和合作伙伴自己承担。
国内创新疫苗仅临床前的研发阶段,张璐楠预估通常就需要2000万元的投入。
为此,张璐楠通过一周的时间快速谈好了3000万元的B+轮融资,这家目前估值4亿元的生物医药公司上一轮融资花了半年,这也是行业内的平均融资速度。
资本环境决定了研究机构的取向。一个明显的对比是,A股多家医药上市公司均表示对疫情关注,但2月前尚无上市公司宣布参与疫苗研发,未上市公司响应更快。
国外已经进入研发阶段的Novavax、Moderna、Inovio三家公司均已在纳斯达克主板上市,据2019年Q3财报数据,三家公司目前均未实现盈利,均有多个在研新药。
张璐楠分析,这体现了两国资本市场对生物医药公司不同的估值逻辑。
国外资本市场多长线投资者,医药公司只要有研发能力,即使长期亏损也能获得投资,而国内生物技术类的创业公司主要依靠风险投资支持进行新药研发。
随着2019年国家设立科创板,并为未盈利的生物医药公司设立了“第五套”IPO上市标准,中国资本市场对生物医药公司的估值逻辑将逐渐趋向于美国。
中商产业研究院在《2018-2023年中国疫苗行业发展前景及投资机会研究报告》中称,中国疫苗企业多且同质化,研发能力弱;而美国疫苗市场由默克、诺华、辉瑞等制药巨头垄断,研发能力强。
背景是中国一类疫苗由政府买单,民众免费接种,接种率在99%以上远高于美国;而二类疫苗则需自费,民众自愿接种,且保险覆盖率低,因此接种率在2%左右,远低于美国。
李航文说,此次病毒尚未找到中间宿主,且传播速度较快,存在无症状患者的情况。这表明这种病毒可能会在人群中长期存在,更需要研发出疫苗,找到主动应对的方法。“不能总是这么手忙脚乱的。”
美国传染病专家安东尼·S·福西告诉《财经》记者,疫苗研发与量产使用有时间差存在,疫苗研究的意义也是基础科学存在的意义。“通过疫苗研究,我们可以研究新的策略、新的物体和对象,人类也将获得新的经验。”
冠状病毒从未远离我们。正如美国历史学家麦克尼尔在著作《瘟疫与人》中所言:“传染病在历史上出现的年代遭遇人类,未来也将会和人类天长地久地共存,而且,它一定会和从前一样,是人类历史中的一项基本参数及决定因子。”
重大疫情来临之时,考验的是政府、全国医疗体系的应急应对能力,他们是冲在前线的人,而对于科学家和商业公司而言,开发药物、制备疫苗、研究疾病,则是终身的使命。
