血清及支气管肺泡灌洗液GM试验在侵袭性肺曲霉病早期诊断中的价值分析
2020-02-25吴跃刚
辛 娜,吴跃刚
(1.西安医学院第一附属医院 检验科,陕西 西安710077;2.西安市华山中心医院 呼吸内科,陕西 西安710043)
侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)是由曲霉引起的支气管肺部真菌感染,免疫功能低下者是其主要高发人群。随着社会老龄化、危重患者广谱抗生素的长期应用, IPA的发病率也在不断上升[1]。IPA临床症状往往缺乏特异性,易被基础疾病所掩盖,病死率较高。半乳甘露聚糖(galactomannan,GM)试验是早期诊断曲霉菌感染的一种常用血清学方法,然而目前GM 试验试剂盒应用说明大多局限于血清样本,鉴于支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF) 和血清标本来源和性质的不同,其GM 试验阈值的设定仍存在诸多争议。本研究通过比较IPA 患者的血清及BALF的GM抗原,评估GM试验在不同阈值下的诊断效能,探讨血清及BALF标本GM试验在IPA早期诊断中的价值。
1 资料与方法
1.1 研究对象选取 2018 年 1 月至2018年8 月经确诊及临床诊断的IPA患者25例作为病例组,符合《侵袭性肺部真菌感染的诊断标准与治疗原则(草案)》诊断标准,选取同期就诊的非肺曲霉病的患者作为对照组(n=75)。患者一般情况差异无统计学意义(P>0.05),具有可比性,见表1。
1.2 仪器与试剂GM 试剂盒:美国BIO-RAD曲霉菌抗原检测试剂盒(酶联免疫法)(伯乐生命医学产品上海有限公司,货号:7J0051);Thermo MULTISKAN FC型全自动酶标仪读取吸光度(OD值)。
1.3 标本采集
1.3.1BALF收集 按常规支气管镜操作规程进行BALF采集,注入20 ml 37℃灭菌生理盐水对病变部位进行支气管肺泡灌洗,回收5-10 ml BALF装入一次性无菌硅塑瓶中及时送检。将待测BALF用一次性无菌吸管转移至10 ml离心管,10 000 r/min 离心 10 min后吸取上清液600-800 μl,-40℃保存待测。
1.3.2血清标本 行支气管镜检查当日采集静脉血3 ml,3 500 r/min 离心10 min,4℃冰箱保存待测。
1.4 GM试验采用一步法酶免夹心微孔板方法,检测血清和BALF标本中的半乳甘露聚糖。按照试剂盒说明书中的操作步骤进行操作。每次实验均设阴性对照、阳性对照、临界值对照以验证实验结果的有效性。结果计算:GM指数(I值)=待测样本OD值/临界值对照OD值均值,根据GM指数进行GM试验阳性阈值的界定。
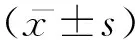
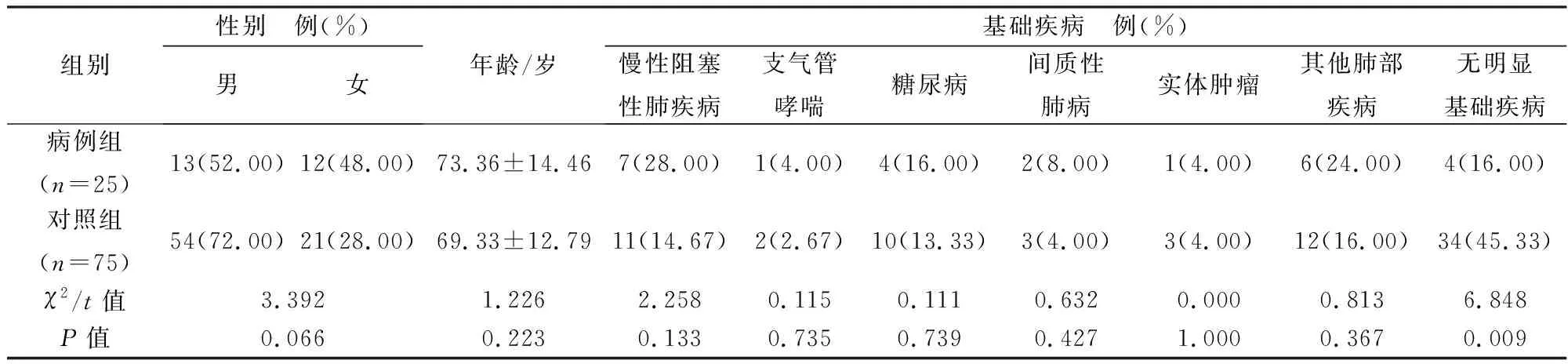
表1 两组患者一般情况比较
2 结果
2.1 两组血清及BALF标本GM试验I值比较两组血清及BALF标本GM试验I值差异均有统计学意义(t=3.73、5.46,P均<0.05);对照组和病例组血清与BALF GM试验I值差异均有统计学意义(t=5.03、7.46,P均<0.05)。见表2。

表2 两组血清及BLAF标本GM试验I值比较
注:★与病例组比较P<0.05;#血清与BALF标本比较P<0.05
2.2 ROC 曲线分析运用ROC曲线下面积评估两种不同标本类型GM试验对IPA的诊断效率,结果显示BALF GM的曲线下面积(0.837)高于血清GM(0.761)。表明BALF GM试验的诊断价值一定程度上高于血清GM,见表3。

表3 曲线下面积
2.3 血清及BALF标本GM 试验诊断 IPA 结果的评估分别以0.5、0.8、1.0、1.2、2.0作为诊断阈值,计算各诊断阈值下GM 试验诊断IPA 的敏感性、特异性、约登指数。以约登指数最高为原则,确定诊断阈值,本研究得到血清GM实验,以≥0.5为诊断阈值;BALF GM试验以≥0.8为诊断阈值,见表4、图1。
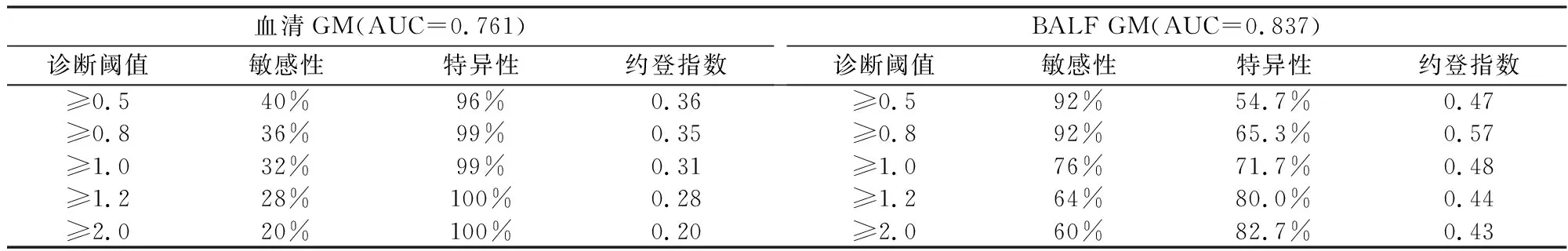
表4 血清及BLAF GM试验不同阈值下诊断效率评估
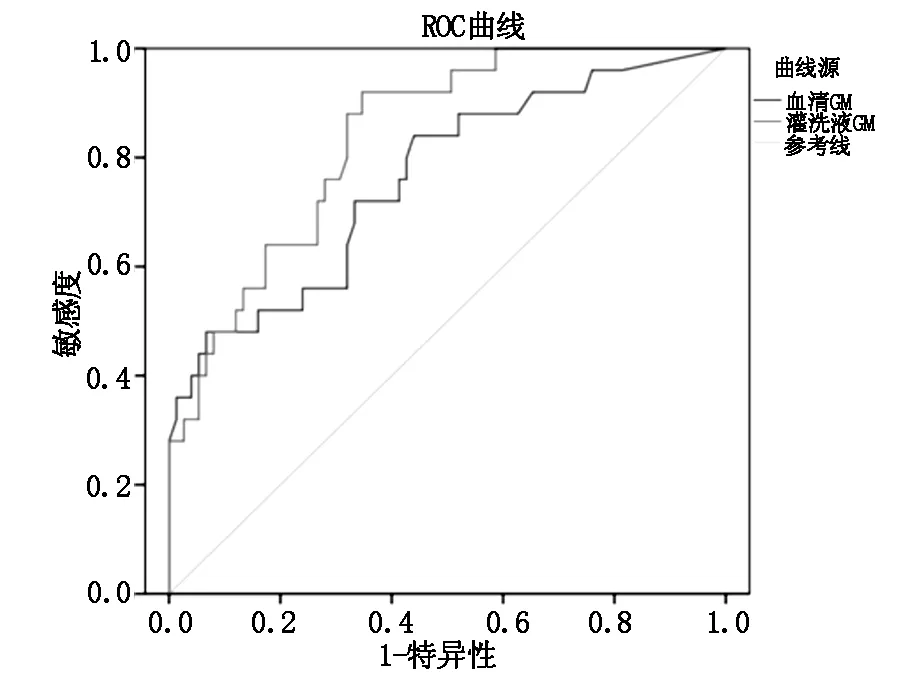
图1 血清GM和BLAF GM标本诊断IPA的ROC曲线
3 讨论
侵袭性肺曲霉病是重要的机会性深部真菌感染,对人体健康危害极大[2]。半乳甘露聚糖(GM)是曲霉菌细胞壁的组成成分,检测患者血清中GM 抗原水平是曲霉菌感染早期诊断的敏感指标[3,4],因此临床医生应高度重视曲霉菌感染的早期诊断,以助于及时采取有效的治疗措施。
GM试验常用的标本类型是血清和BLAF。在曲霉菌局部感染时,由于菌丝少,释放的GM抗原量少,以及释放入血后很快被清除等原因,导致血清GM试验容易产生假阴性结果。同时,由于真菌感染早期并未进入血液,故血清中峰浓度出现较迟,不利于IPA 的早期诊断。而支气管肺泡灌洗时无菌生理盐水能够直接到达肺部感染病灶,在BALF中存在大量的吞噬细胞,能将真菌吞噬后释放较多的半乳甘露聚糖,从而提高早期诊断的敏感性[5]。目前,血清标本的GM试验大多以0.5作为诊断阈值。由于BLAF和血清标本来源和性质的不同,BLAF进行GM试验时其诊断阈值的选择[6],或敏感性、特异性的评价还存在较大差异[7]。ZOU 等[8]一项Meta 分析指出,当cut-off值为0.50时,BALF-GM的敏感度达0.87,特异度 0.89,诊断效率较血清 GM 具有优势。而有文献研究则考虑当 cut-off 值为 0.80 时,BALF-GM诊断效益最高[9]。国内也有学者认为将BALF-GM试验的I值设定为≥2.1为阳性结果,对 IPA 更具诊断价值[10]。不同研究对于BALF-GM试验最佳界值和敏感度等评价存在区别,可能与具体操作及收集方法的差异、实验人群选择的不同相关。有研究显示[11]采用小剂量灌洗对重症呼吸衰竭患者安全性较高,避免在灌洗过程中将霉菌及定值菌等播散到远处,引起感染或炎症加重的风险。因此本研究所有BALF的采集均采用小剂量灌洗,排除因灌洗量不同造成试验结果的差异。
本研究中,病例组和对照组血清及BALF标本GM试验I值差异有统计学意义,并且同组内血清标本与BALF标本GM试验的I值也存在显著性差异,这也提示,血清标本和BALF标本GM检测使用同一诊断阈值可能存在一定的不足。比较不同阈值下血清及BLAF GM试验诊断IPA的效能,结果显示当血清GM界值≥0.5时,敏感性40%,特异性96%,约登指数最大为0.36。而BALF GM界值≥0.5时,敏感性92%,特异性54.7%;界值≥0.8时,敏感性92%,特异性提高到65.3%,约登指数最大为0.57;界值≥1.0时,敏感性显著下降,只有76%。约登指数是综合评价筛查试验准确性的方法,指数越大说明筛查试验的准确性越高、效果越好。因此,本研究认为血清 GM界值设定为0.5较合适,而BALF GM界值设定为0.8较合适,具有较高的敏感性和相对较好的特异性。
目前文献报道血清GM试验诊断IPA的敏感度、特异度分别为60%-100%、80%-100%[12],而在肺泡灌洗液中,如果以吸光度>0.5作为IPA的诊断标准,其敏感度、特异度可达 80%-93%、89%-98%[13,14]。本研究中血清GM试验和文献比较敏感性偏低,只有40%,分析原因可能是因为本研究病例组样本量较少,多为年老体弱的ICU患者,合并严重基础疾病,造成试验结果存在一定程度上的偏倚。然而也有文献表明GM试验在不同研究对象中的结果存在一定差异[15],推测 GM 试验可能需要根据不同的基础疾病或免疫力等而设定不同的最佳界限值,这方面可能需要更多的研究去证实。本研究中BLAF GM试验和文献比较特异性偏低,只有65.3%,分析原因可能是对照组中部分患者临床诊断为吸入性肺炎,普遍存在误吸病史,可能食物中的GM抗原进入呼吸道导致假阳性,也有可能是BALF样本与外界空气环境为开放性,使一些青霉菌、曲霉菌污染样本,导致GM实验呈现假阳性。
综上所述,血清标本和BALF标本GM试验在IPA的早期诊断中都有重要的价值,BALF 标本 GM 试验的诊断效能一定程度上高于血清标本。由于血清及BALF GM试验的敏感性和特异性有所差别,临床应用中建议多次送检同时结合不同标本类型进行综合判断,从而更好的发挥GM试验在IPA早期诊断中的价值。
