低温与氮肥耦合对水稻生理指标的影响
2020-02-25余小芬线罕英邱学礼邹炳礼张素华刘关所张云芬曾黎琼杨树明
余小芬,线罕英,邱学礼,邹炳礼,张素华,刘关所,张云芬,曾 民,曾黎琼,杨树明*
(1.云南省农业科学院农业环境资源研究所,云南 昆明 650205;2.普洱学院,云南 普洱 665000;3.云南省农业科学院生物技术与种质资源研究所,云南 昆明 650205;4.石林县鹿阜街道办事处农业综合服务中心,云南 石林 652200)
【研究意义】水稻是世界近30亿人口的主粮[1],为缓解人口快速增长及经济发展对粮食需求不断增加的矛盾,提高水稻产量将是保障中国乃至全球粮食安全的有效途径。尽管中国水稻高产育种已有较大突破,但是各稻作区的生态环境及水稻生产差异较大,低温与氮素利用率低仍是限制水稻增产的关键因子。据统计,中国因冷害平均每年损失稻谷30~50亿kg[2],云南常年冷害面积46.7~53.3万hm2,减产约20 %[3]。为获高产,部分稻田年均化学氮肥用量已达500 kg·hm-2以上[4],过量施用氮肥不仅增加生产成本,还有加剧环境污染的风险[5]。因此,如何挖掘水稻自身对耐冷、氮素高效利用潜力以缓解低温对水稻增产的限制,以及高氮用量产生的环境负面效应,已成为稻作生产中亟待解决的问题。【前人研究进展】在正常温度下,水稻体内氧自由基维持在较低的水平,但受到低温胁迫时会产生大量的活性氧积累,严重伤害水稻细胞膜。然而,水稻在受到低温刺激后,自身能启动应激反应,如提高过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性等[6],进而清除产生的过多氧自由基,降低水稻细胞膜的伤害。低温会导致水稻叶片丙二醛(MDA)升高,加重膜体系损伤[7],耐冷越强的品种,MDA增加量越少,作为胞质渗压剂、酶和细胞结构保护剂的可溶性糖、可溶性蛋白含量升高,从而增强水稻自身抵抗低温的能力[8]。在氮素与水稻生理特性方面,施用氮素粒肥可维持水稻叶片较高的SOD、POD酶活性,减少MDA的积累和对细胞膜脂的伤害[9]。叶面喷施有机氮和无机氮可提高水稻体内POD、CAT酶活性,降低MDA含量,显著增加可溶性蛋白含量,从而提高水稻产量和蛋白质含量[10]。高氮-低温互作下水稻POD、SOD和CAT活性对低温的应答能力下降,但MDA、可溶性糖和可溶性蛋白含量升高[11]。【本研究切入点】以往研究大多为低温或氮肥单因素设计,而关于低温与氮耦合对水稻不同生育期的根、叶生理特性的复合效应研究鲜有报道。【拟解决的关键问题】以纯系耐冷氮高效I16和冷敏氮低效I67为材料,设置不同温度和氮肥因素,系统研究水稻根系和叶片生理指标对低温与氮肥的时段效应差异,以期为水稻耐冷、氮高效育种及栽培提供理论依据。
1 材料与方法
1.1 供试材料
供试材料为云南省农业科学院生物技术与种质资源研究所从云南强耐冷稻种丽江新团黑谷近等基因系[十和田×(十和田4/丽江新团黑谷BC3F9)]BC4F8群体(105个株系)中筛选的2份近等基因系,即耐冷氮高效I16和耐敏氮低效I67。人工气候室低温(17℃)下,I16结实率和氮吸收率分别为78.9 %和33.38 %,I67结实率和氮吸收率分别为20.5 %和25.75 %[12]。
1.2 水培试验及低温处理
水培试验于2018年在云南省农业科学院试验场进行。将供试水稻材料种子浸种消毒2 d后,3月20日播种,田间湿润育秧,5月3日选取3~4叶期的健壮秧苗,单株移植到容积4 L的水培盆中,每盆3株,注入3 L培养液,每个处理重复10次,每7 d更换营养液1次,直到试验结束。水培营养液参照国际水稻研究所(IRRI)的完全营养液配方[13],稍加修改配方中的NH4NO3质量浓度,设置极低氮(N10, 10 mg·L-1)、低氮(N20, 20 mg·L-1)、中氮(N40, 40 mg·L-1)、高氮(N60, 60 mg·L-1) 4个氮水平。在水稻移栽后25 d开始在人工气候室中进行低温(LT)和常温(NT)处理,低温和常温的白天/夜间平均温度分别为17 ℃/15 ℃和30 ℃/25 ℃,6:00-18:00,18:00-次日6:00,精度±0.5 ℃,设定相对湿度50 %,室内光照与外界自然光照一致,直至成熟。在水稻分蘖期每处理选取正常植株12株挂牌标记,供取样分析。
1.3 测定项目及方法
在水稻分蘖期、孕穗期、开花期和灌浆期分别取标记植株根、叶样品。按照李合生等[14]方法测定POD、CAT、SOD酶活性及MDA、可溶性糖、可溶性蛋白含量,每个样品重复测定3次,取平均值。
1.4 低温和氮肥处理的耦合效应
参考徐国伟等[15]方法分别计算低温和氮肥(中氮N40或高氮N60)耦合效应。
耦合效应=[(低温与N40或N60-常温与N10)-(常温与N40或N60-常温与N10)-(低温与N10-常温与N10)]/2
1.5 数据处理
试验数据采用Excel 2010和SPSS 19.0软件进行绘图及统计分析。
2 结果与分析
2.1 低温与氮耦合对水稻根、叶生理指标的影响
2.1.1 低温与氮耦合下水稻根、叶POD活性的变化 由图1~2可知,在相同施氮水平下,与常温相比,低温处理后水稻根叶POD活性显著升高。在2个温度条件下,根、叶POD活性随水稻生育进程,呈先升高后下降的趋势。在正常温度下,根系和叶片POD活性随着施氮量的增加而增加,而在低温胁迫下,根、叶POD活性随着施氮量的增加先升高后降低,说明重施氮肥反而降低根叶POD活性。从不同供试材料和器官比较看,在水稻同一生育期及相同氮水平下,I16的根、叶中POD活性高于I67,叶片高于根系,说明在低温条件下,耐冷氮高效品种POD活性对氮素的响应强于冷敏氮低效品种,叶片响应强于根系。
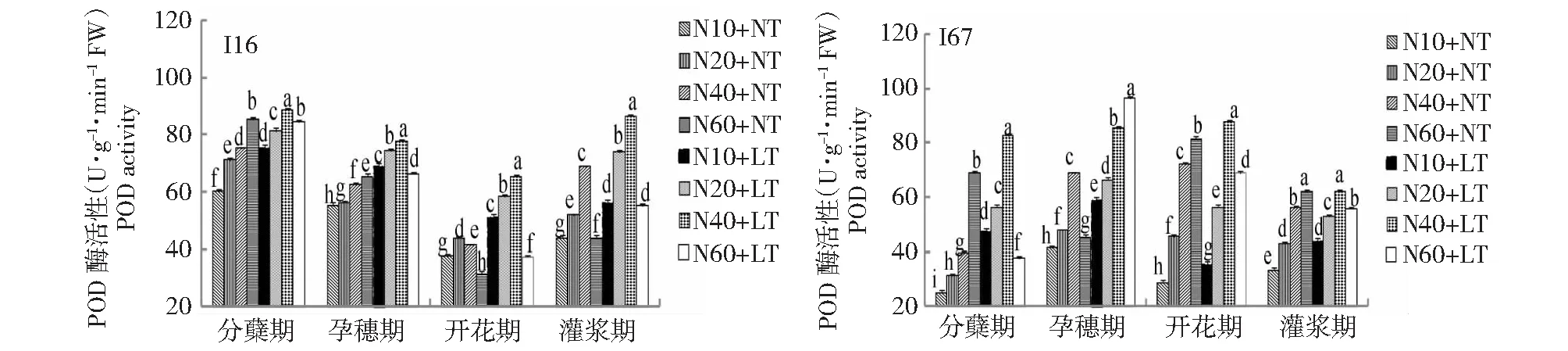
同一时期图柱上不同小写字母表示P<0.05水平差异显著,下同Different lowercase letters in column at the same stage indicate significant difference at P<0.05 level. The same as below
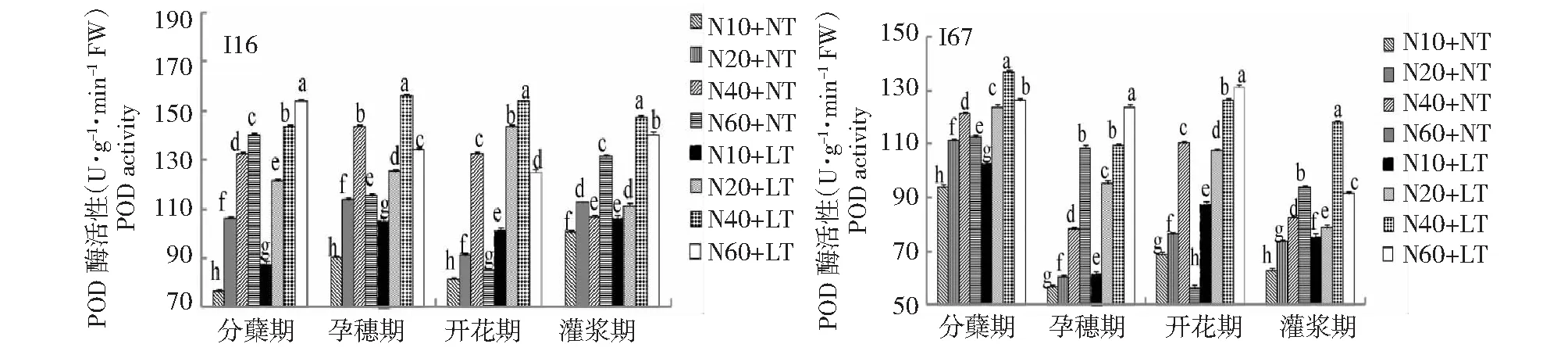
图2 低温与氮耦合下水稻叶片POD酶活性的变化Fig.2 Changes of POD activity in leaves of rice under the low temperature combined with nitrogen
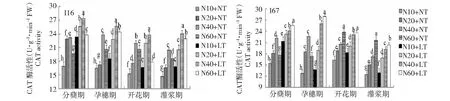
图3 低温与氮耦合下水稻根CAT酶活性的变化Fig.3 Changes of CAT activity in roots of rice under the low temperature combined with nitrogen
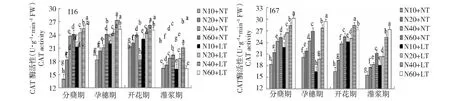
图4 低温与氮耦合下水稻叶片CAT酶活性的变化Fig.4 Changes of CAT activity in leaves of rice under the low temperature combined with nitrogen
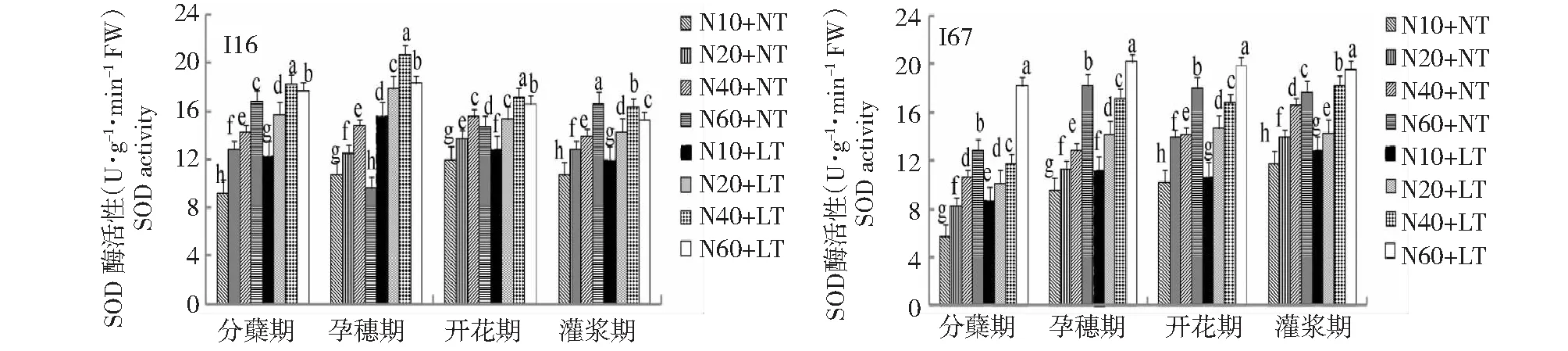
图5 低温与氮耦合下水稻根SOD酶活性的变化Fig.5 Changes of SOD activity in roots of rice under the low temperature combined with nitrogen
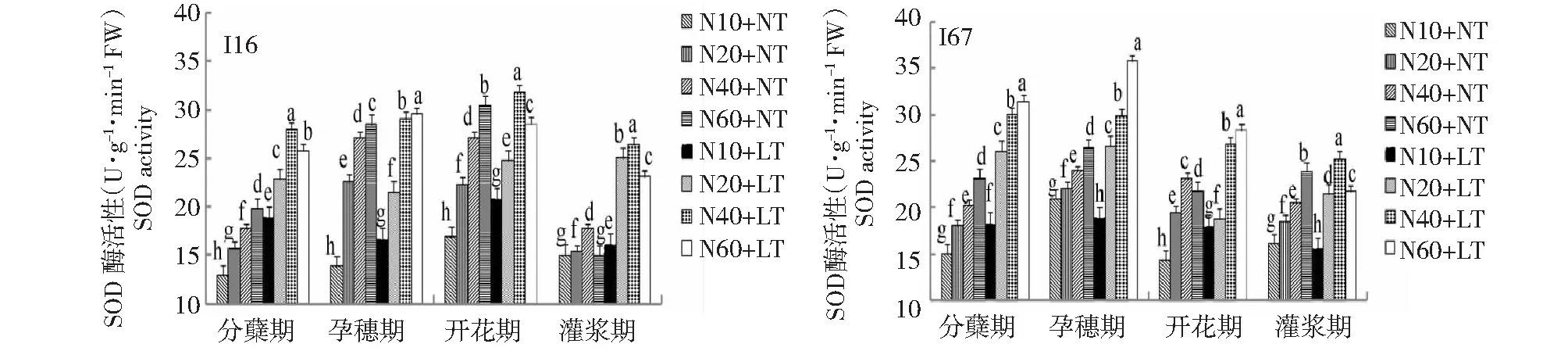
图6 低温与氮耦合下水稻叶片SOD酶活性的变化Fig.6 Changes of SOD activity in leaves of rice under the low temperature combined with nitrogen
2.1.2 低温与氮耦合下水稻根、叶CAT活性的变化 由图3~4可知,在2个温度条件下,根、叶CAT活性在水稻分蘖期—开花期维持较高活性,灌浆期显著下降。在相同施氮水平下,与常温相比,低温处理提高了水稻根叶CAT活性。在2个温度条件下,水稻根系和叶片CAT活性均随着施氮量的增加而增加,但不同材料最强CAT活性所需施氮水平不同:I16和I67根叶中CAT活性分别以中氮、高氮最强,说明轻施氮肥促进耐冷氮高效品种根、叶CAT活性的提升,其耐冷性增强。
2.1.3 低温与氮耦合下水稻根、叶SOD活性的变化 由图5~6可知,在相同施氮水平下,与常温相比,低温条件下水稻根叶SOD活性显著升高。从生育进程看,水稻根中SOD活性以开花期、灌浆期最高,叶片中SOD活性在水稻分蘖期—开花期最高。在2个温度条件下,水稻根系和叶片SOD活性均随施氮量的增加而增加,但在正常温度下,I16和I67根叶中SOD活性均以高氮最强;而在低温下,I16和I67根叶中SOD活性分别以中氮、高氮最强,说明轻施氮肥更能增强耐冷氮高效品种根、叶SOD活性,缓解水稻低温危害。
2.1.4 低温与氮耦合下水稻根、叶MDA含量的变化 由图7~8可知,与常温相比,低温使水稻根叶MDA含量升高。从生育进程看,I16根叶中MDA含量以分蘖期最高,随后保持相对较低水平,而I67根叶中MDA含量在分蘖期—灌浆期均保持相对较高,在相同生育期及氮水平下,叶片MDA含量高于根系。在正常温度下,水稻根系和叶片MDA含量随施氮量的增加而增加,以高氮处理MDA含量最高;在低温胁迫下,根系和叶片MDA含量随施氮量增加呈先下降后升高的趋势,以低氮、中氮处理的MDA含量最低,说明重施氮肥促进MDA含量升高,加重水稻低温冷害。

图7 低温与氮耦合下水稻根MDA含量的变化Fig.7 Changes of MDA contents in roots of rice under the low temperature combined with nitrogen

图8 低温与氮耦合下水稻叶片MDA含量的变化Fig.8 Changes of MDA contents in leaves of rice under the low temperature combined with nitrogen
2.1.5 低温与氮耦合下水稻根、叶可溶性糖含量的变化 由图9~10可知,与常温相比,低温下水稻根叶可溶性糖含量升高。从生育进程看,I16根叶中可溶性糖含量以分蘖期、孕穗期较高,开花期和灌浆期显著下降;而I67根叶中可溶性糖含量在孕穗期和灌浆期均保持相对较高水平,灌浆期逐渐下降。在相同生育进程及施氮水平下,叶片可溶性糖含量高于根系。在正常温度下,水稻根叶的可溶性糖含量随施氮量的增加而增加,以高氮处理可溶性糖含量最高;在低温胁迫下,I16根系和叶片可溶性糖含量随施氮量增加呈先升高后下降的趋势,以中氮处理最高,而I67根叶可溶性糖含量则随施氮量增加而增加,高氮处理最高,说明对耐冷氮高效品种轻施氮肥更有利于提高可溶性糖含量。
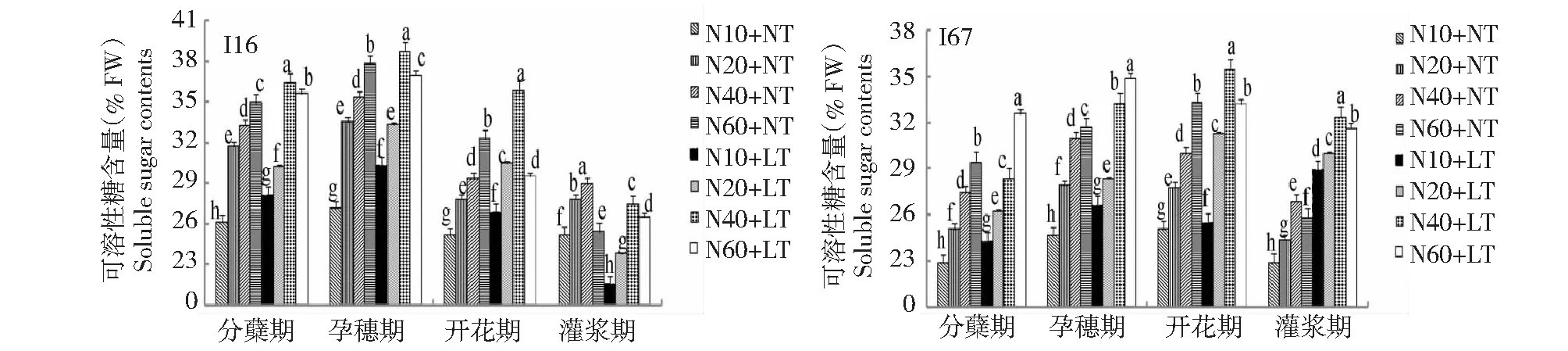
图9 低温与氮耦合下水稻根可溶性糖含量的变化Fig.9 Changes of soluble sugar contents in roots of rice under the low temperature combined with nitrogen
2.1.6 低温与氮耦合下水稻根、叶可溶性蛋白含量的变化 由图11~12可知,与常温相比,低温条件下水稻根叶可溶性蛋白含量升高。从生育进程看,水稻根叶中可溶性蛋白含量在分蘖期—灌浆期维持相对较高水平。在相同生育期及氮水平下,叶片可溶性蛋白含量高于根系。在2个温度条件下,水稻根系和叶片可溶性蛋白含量随着施氮量的增加而增加,但I16和I67根叶中可溶性蛋白分别以中氮、高氮最高,说明轻施氮肥更能促进耐冷氮高效品种根、叶可溶性蛋白含量的提升,进而提高自身的抗逆能力。
图10 低温与氮耦合下水稻叶片可溶性糖含量的变化Fig.10 Changes of soluble sugar contents in leaves of rice under the low temperature combined with nitrogen
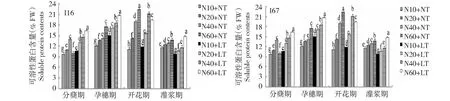
图11 低温与氮耦合下水稻根可溶性蛋白含量的变化Fig.11 Changes of soluble protein contents in roots of rice under the low temperature combined with nitrogen

图12 低温与氮耦合下水稻叶片可溶性蛋白含量的变化Fig.12 Changes of soluble protein contents in leaves of rice under the low temperature combined with nitrogen
2.2 低温与氮耦合对水稻根、叶生理指标耦合效应的影响
由表1可知,低温与氮耦合效应因不同品种类型和器官、生理指标及生育时段存在一定差异。从根系来看,I16的POD、CAT、SOD、可溶性糖和可溶性蛋白的低温与中氮耦合效应表现为正效应为主(分蘖期POD、分蘖期和孕穗期CAT除外),MDA为负效应;而POD、CAT、SOD(分蘖期和灌浆期除外)、可溶性糖和可溶性蛋白的低温与高氮耦合为负效应,MDA的低温与高氮耦合表现为正效应。I67的POD、CAT、SOD、可溶性糖和可溶性蛋白的低温与中氮或高氮(开花期POD、开花期和灌浆期CAT除外)耦合效应一致,表现为正效应,而MDA表现与I16一致。从叶片来看,I16和I67的POD、CAT、SOD、可溶性糖和可溶性蛋白的低温和中氮耦合效应呈现正效应,MDA为负效应。但I16与I67的低温和高氮耦合效应存在一定差异,其中I16叶片的POD、CAT、SOD、可溶性糖和可溶性蛋白为负效应,MDA为正效应;而I67叶片的POD、CAT、SOD、MDA、可溶性糖和可溶性蛋白的低温和高氮耦合效应均为正效应。综合分析可知,在低温下,适宜的施氮量能够促进根、叶中POD、CAT、SOD活性及可溶性糖、可溶性蛋白含量的提升,降低MDA含量。
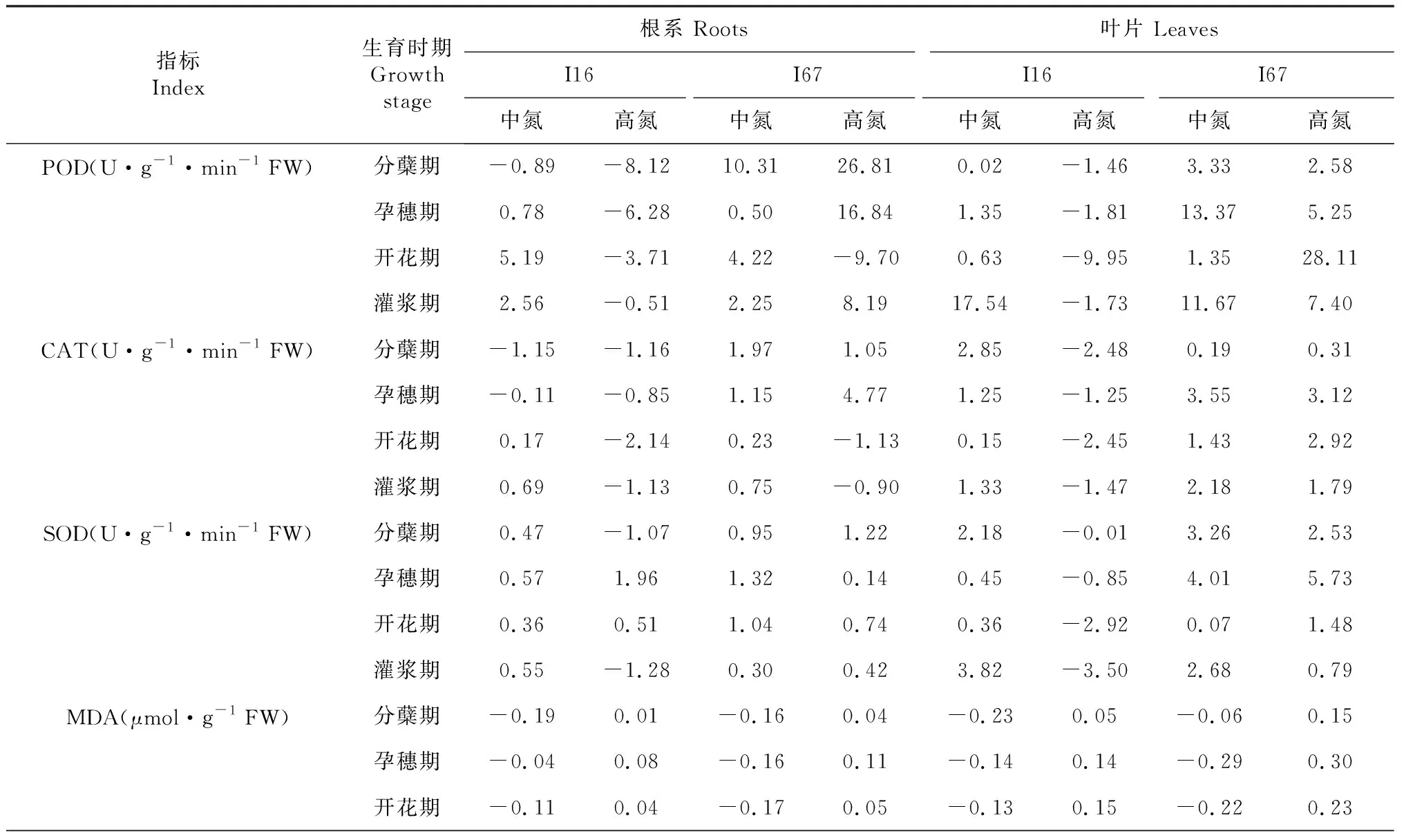
表1 低温与氮耦合对根系及叶片生理指标耦合效应的影响
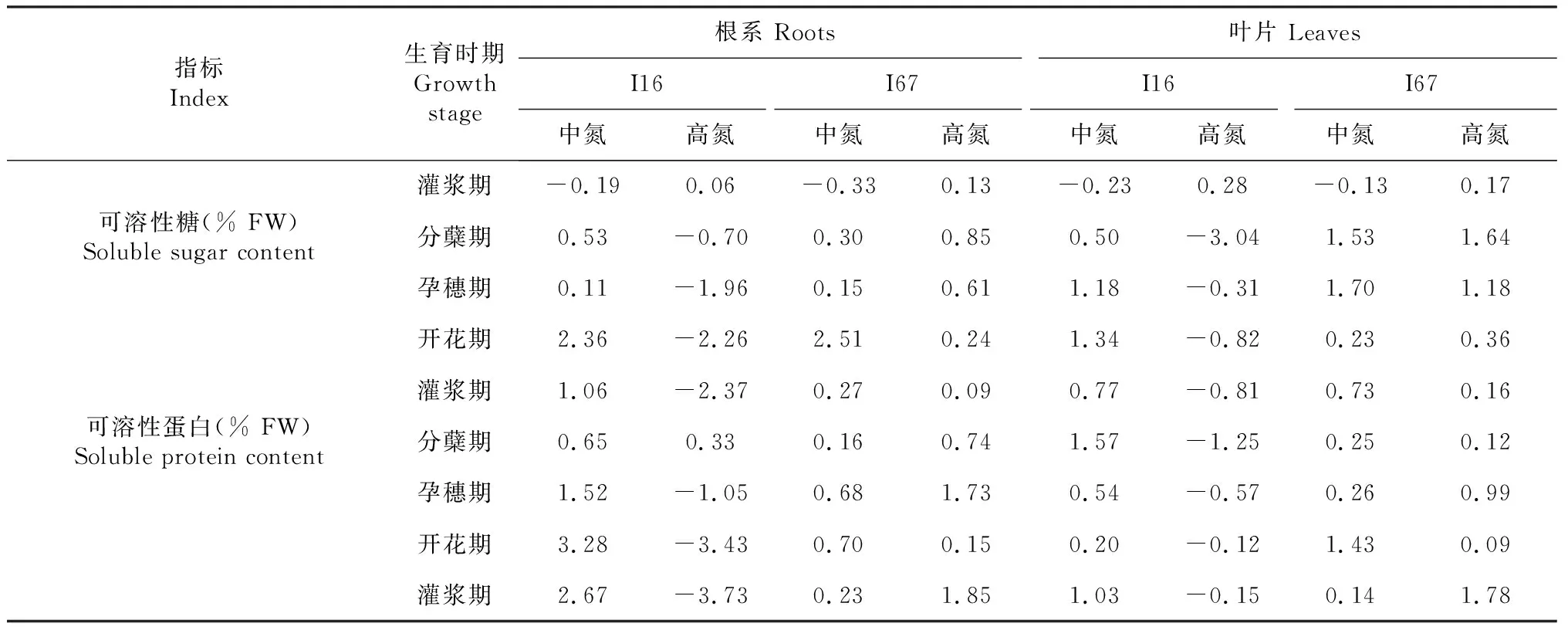
续表1 Continued table 1
3 讨 论
植物中POD、CAT和SOD活性反映了自身对低温产生的活性氧(ROS)消除和防御的能力[16]。MDA是细胞膜过氧化的产物,其含量高低是判断脂膜受损的重要指标,而可溶性糖、可溶性蛋白对细胞具有渗透调节及保护细胞膜结构稳定的作用。研究表明,轻度或短暂的低温胁迫使水稻产生应激反应,进而提高抗氧化酶的活性,清除产生过多的氧自由基,减轻低温伤害,但随着低温处理强度和持续时间的增加,抗氧化酶活性下降,低温伤害加重[17]。低温可导致水稻叶片MDA、可溶性糖、可溶性蛋白含量升高,其中过多的MDA会抑制植物抗氧化酶活性系统功能,促进膜脂氧化,而遭遇低温胁迫后水稻迅速积累的可溶性糖、可溶性蛋白含量,可为非结构性碳水化合物(NSC)[18-19]和抗氧化酶的合成提供充足的碳源和氮源,以增强稻株抗倒伏能力和体内活性氧机能,从而提高水稻自身抗逆能力[20]。通过研究表明,低温导致水稻根叶的POD、CAT、SOD活性及MDA、可溶性糖、可溶性蛋白含量显著增加,且叶片各指标变化幅度高于根系,说明水稻已启动应激反应,且提高防御活性氧的酶促和非酶促保护系统物质叶片较根系强。与冷敏氮低效I67相比,耐冷氮高效I16从分蘖期低温开始至开花期,根叶中始终保持相对较高的抗氧化酶活性及可溶性糖、可溶性蛋白含量,以及较低的MDA含量,这可能是耐冷品种与冷敏品种耐冷性的内在机理差异之一。
通过研究表明,在常温下,I16和I67的根叶中抗氧化物酶活性及MDA、可溶性糖、可溶性蛋白含量均随施氮量的增加而增加,但在低温条件下,仅有I67出现类似的结果,而I16的各项生理指标则以中氮最佳,重施氮肥反而降低POD、CAT 、SOD酶活性及可溶性糖、可溶性蛋白含量,显著增加MDA含量,前人研究有相一致的结果,即高氮素加重水稻危害是由于高氮素增加了MDA含量,降低了抗氧化物酶活性所致[9,11]。笔者用相同的丽江新团黑谷近等基因系群体,在低温与3个氮水平下,定位到与POD、CAT、MDA、可溶性糖及可溶性蛋白相关的QTL 27个,贡献率为9.27 %~29.14 %[3]。可见在寒冷稻作区的生产实践中,培育耐冷氮高效品种的基础上,适当调控施氮量是同步提高水稻抗低温的能力及缓解氮肥对土壤和水体污染的重要措施。
4 结 论
在低温条件下,适宜氮肥能够促进根、叶中POD、CAT、SOD活性及可溶性糖、可溶性蛋白含量的提升,降低MDA含量,这是施氮增强水稻耐冷性的内在机理之一。低温与氮耦合效应表现为耐冷氮高效品种强于冷敏氮低效品种,叶片强于根系。
