木薯MeHSF18基因克隆及表达分析
2020-02-25黄芷颐章玉香吴春来
曾 坚,黄芷颐,章玉香,吴春来,胡 伟*
(1.韶关学院英东生物与农业学院,广东 韶关 512005;2.中国热带农业科学院热带生物技术研究所,海南 海口 571101)
【研究意义】植物在生长过程中会经历不同逆境,包括生物逆境和非生物逆境。为适应自然环境,植物在应对这些逆境的过程中进化出了许多抵御机制[1-2]。热休克反应是植物适应环境过程中非常重要的防御机制,而作为调节热休克蛋白的关键因子,热休克转录因子能够提高植物应对热、干旱和氧化损伤等逆境的适应能力。HSF能够在转录水平上调节相关抗逆基因的表达,从而提高植物的抗逆能力,在植物响应逆境胁迫的过程中起着非常重要的作用[3-6]。【前人研究进展】HSF提高植物应对非生物逆境的研究已有许多报道,例如在番茄中过表达SlHsfA1可以提高植株的耐热性[7]。在拟南芥中过表达HSFA2可以提高植株对高盐、渗透胁迫和高氧化水平环境的耐受能力;过表达HSFA6a和HSFA6b则可以大幅度提高植株对冷和高盐的耐受水平[8-9]。在水稻中过表达TaHSFA4a还可以提高植株对重金属的耐受能力[10]。因此,HSF不同的基因在不同植株中可以提高植物应对不同逆境胁迫的能力。【本研究切入点】木薯 (Manihotesculenta) 在热带及亚热带地区被广泛种植,是三大薯类作物之一,约占全世界10 %人口的主食,同时也是工业淀粉和生物酒精生产的重要原料[11-13]。木薯具有非常好的抗旱和耐贫瘠特性,随着能源资源的紧缺,木薯作为生物质能源的潜力越来越被重视。因此,如何提高木薯在干旱胁迫下的适应能力具有重要意义。另外,木薯块根采后会出现“采后生理性变质”(post-harvest physiological deterioration, PPD),不耐储藏严重限制了木薯加工利用的快速发展[14-16]。因此,研究木薯PPD过程和响应干旱胁迫的机理具有重要意义。【拟解决的关键问题】本研究利用前期木薯转录组数据,通过PCR技术克隆得到一个热激转录因子MeHSF18基因,并对其蛋白序列,保守结构域和进化关系进行了初步分析,对MeHSF18基因在干旱胁迫、ABA处理和PPD过程下的表达模式进行了分析,以期进一步研究MeHSF18基因的功能。
1 材料与方法
1.1 材料
本研究选用适应性强和较耐旱的木薯材料SC124品种(由中国热带农业科学院热带生物技术研究所保存)进行基因克隆和后续处理。
1.2 材料处理
将木薯茎秆切成包含3~4个芽点的小节,将其种入蛭石和营养土比例为1∶1的基质中生长。待生长约60 d后,选取生长状况一致的木薯幼苗作为后续实验材料。正常生长和采用PEG-6000进行干旱模拟处理,对照植株浇灌水,处理0、3、5、7 d后采集木薯叶片样品用液氮速冻后放入超低温冰箱保存;正常生长和使用100 μmol/L ABA进行浇灌,处理0、3、5、7 d后采集木薯叶片样品用液氮速冻后放入超低温冰箱保存;
取10个月的木薯块根,选取中间部分切成5 mm左右的薄片,置于25 ℃、70 %相对湿度的培养箱内进行暗培养,分别在0、6、12、48 h取样,采集的木薯样品用液氮速冻后放入超低温冰箱保存。
1.3 基因克隆
使用天根生化科技有限公司和赛默飞世尔科技公司的RNA 提取试剂盒和反转录试剂盒进行RNA提取和反转录。根据MeHSF18基因的全长cDNA序列设计引物(P1: 5'- ATGGCGCAGCGGTCAGTTCC -3';P2: 5'- TTAGATCTTGATTTCCTTTGCGTGG -3'),以木薯叶片cDNA为模板进行MeHSF18基因扩增。扩增产物连接至pMD-18T载体,转化大肠杆菌并挑选阳性单克隆进行测序。
1.4 生物信息学分析
在NCBI中用BLAST搜索其它物种中和MeHSF18基因同源的蛋白质序列;预测亚细胞定位用Plant-mPLoc;预测保守结构域用NCBI-CDD数据库;蛋白质的等电点和分子量通过ExPASy ProtParam计算;用DNAMAN对这些序列进行比对;利用MEGA中的Neighbor-Joining (NJ)法构建进化树;用Primer 5.0软件设计引物。
1.5 基因的表达分析
将相应处理的样品提取RNA,建库并测序,这部分工作由美吉生物技术有限公司完成。测序平台是Illumina GAII (Illumina, San Diego, CA, USA)。使用FASTX-toolkit和FastQC移除接头序列和低质量序列。利用Tophat 2.0软件将clean reads和木薯基因组参考序列进行比对,将比对结果用Cufflinks来组装转录组数据。表达水平使用FPKM(Fragments per kilobase per million mapped reads)表示。
2 结果与分析
2.1 MeHSF18 基因的克隆
用拟南芥AtHSF16 基因( 登录号: At4g36990) 的蛋白质序列在数据库 (Phytozome) 进行BLASTp 比对搜索,得到木薯同源序列 (Manes.13G124500.1),根据序列设计PCR引物进行目的片段扩增(图1)。目的片段进行测序后获得一个ORF为867 bp 的序列,编码289个氨基酸 (图2),将其命名为MeHSF18。通过序列比对发现MeHSF18基因与参考序列之间总共存在3个碱基差异,都为同义突变(图2) 。将MeHSF18基因与基因组序列比对得知,该基因含有2个外显子和1个内含子。通过ProtParam对MeHSF18蛋白的理化性质进行预测,MeHSF18蛋白质的分子式为C1367H2162N396O454S8,分子量为31.67 KDa,理论等电点( pI) 为5.90,不稳定系数为32.19,属于稳定蛋白。亚细胞定位预测结果显示定位于细胞核。通过对MeHSF18基因编码的蛋白质序列进行保守结构域分析,MeHSF18基因含有HSF基因家族的保守结构域(图3),结果进一步表明克隆得到的基因为木薯MeHSF18基因。

M: Marker DL 2000;MeHSF18基因在染色体位置(B)M: Marker DL 2000; The location of MeHSF18 in chromosome 13

MeHSF18与参考序列之间存在3个碱基差异用箭头标出The three SNPs between MeHSF18 and the reference sequence were marked by arrows

图3 MeHSF18 蛋白质结构域分析Fig.3 Conserved domain analysis of MeHSF18 protein
2.2 MeHSF18 氨基酸序列同源性比对和进化分析
以MeHSF18基因蛋白质序列为探针,在NCBI 数据库中进行Blast搜索并下载相关基因的氨基酸序列,其中与橡胶树 (XP_021656118.1) 和麻疯树 (XP_012079229.1) 的氨基酸同源性最高,分别为86.94 %和83.51 %。利用DNAMAN软件进行多重序列比对(图4)发现,MeHSF18基因编码的蛋白质序列和其它植物中的HSF蛋白的氨基酸序列一致性非常高,具有HSF蛋白家族的保守结构域。在N端1~100氨基酸残基位置含有高度保守的DNA Binding Domain,在N端168~195氨基酸残基位置含有HR-A Core,HR-B Core和插入序列,表明MeHSF18基因编码的蛋白质属于HSFB家族。在C端269~280氨基酸残基位置含有核定位信号 (Nuclear localization signal, NLS)。进化树分析显示,木薯MeHSF18基因和橡胶树的HSF基因聚在一起,氨基酸序列一致性最高(图5)。同时MeHSF18基因蛋白序列与麻疯树、蓖麻、榴莲、蜜桔的HSF亲缘关系较高,序列一致性分别为83.51 %、73.31 %、69.79 %和70.40 %。

XP_021678492.1橡胶树;XP_012070195.1 麻风树;XP_015578895.1 蓖麻;EEF36489.1 蓖麻;XP_011033721.1胡杨;XP_002321069.1三叶杨;AKV56389.1小叶杨;TKS14059.1新疆杨;KAB5527533.1柳树;EOX92921.1可可XP_022741496.1榴莲;XP_002278037.1葡萄XP_021678492.1 Hevea brasiliensis;XP_012070195.1 Jatropha curcas;XP_015578895.1 Ricinus communis;EEF36489.1 Ricinus communis;XP_011033721.1 Populus euphratica;XP_002321069.1 Populus trichocarpa;AKV56389.1 Populus simonii;TKS14059.1 Populus alba;KAB5527533.1 Salix brachista;EOX92921.1 Theobroma cacao XP_022741496.1 Durio zibethinus;XP_002278037.1 Vitis vinifer

图5 木薯MeHSF18基因与其他物种HSF基因系统进化树Fig.5 Phylogenetic tree of MeHSF18 in cassava and HSF genes from other species
2.3 MeHSF18 基因的组织表达分析
为详细分析MeHSF18基因在木薯不同组织中的表达水平,从数据库中下载得到木薯11个组织的表达数据[17],分别是叶(Leaf),中脉(Midvein),叶柄(Petiole),茎(Stem),侧芽(Lateral bud),顶端分生组织(Shoot apical meristem, SAM),根(Storage root, SR),须根(Fibrous root, FR),根顶端分生组织(Root apical meristem, RAM),分化胚组织(Organized embryogenic structure, OES),松散性胚性愈伤组织(Friable embryogenic calli, FEC)。MeHSF18基因在不同组织中的表达水平不一样,在叶和SAM中的表达水平最低,在根相关的组织SR,FR和RAM中的表达水平最高(图6)。在根相关组织中的表达水平是叶中的10~20倍。这些结果表明MeHSF18基因在木薯根相关组织中有重要作用。
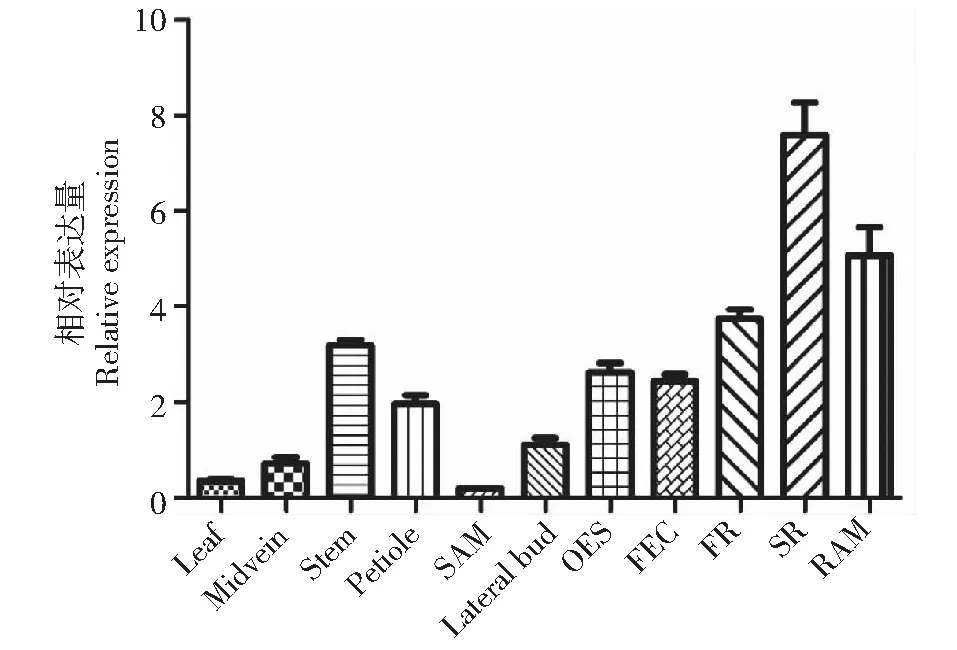
图6 MeHSF18基因在木薯不同组织中的表达分析Fig.6 Expression analysis of MeHSF18 in different tissues/organs of cassava
2.4 MeHSF18在不同胁迫条件下的表达分析
已经有研究报道指出HSF基因在植物应答非生物胁迫的过程中起作用。因此分析了MeHSF18基因在干旱和ABA处理下的表达水平。在模拟干旱的PEG胁迫条件下,MeHSF18基因的表达水平随着处理时间增加而增高,在处理后7 d达到最高,分别提高了1.5、2.4和10倍。使用ABA进行处理发现MeHSF18基因在叶片中的表达量也显著上调,处理3、5、7 d后分别上调了1.7、2.0和1.9倍 (图7)。

*表示与对照相比差异显著 (P<0.05)* represented significant difference compared to control (0 days) (P<0.05)
木薯的PPD严重影响了木薯的存储。有研究报道HSF和氧化损伤密切相关,因此分析了MeHSF18基因在木薯PPD过程中的表达水平。采后MeHSF18基因的表达水平随着时间增加而增高,6、12、48 h后分别上调了1.6、2.3和2.0倍 (图8)。

*表示与对照相比差异显著 (P<0.05)* represented significant difference compared to control (0 hours) (P<0.05)
3 讨 论
在植物中HSF基因属于多基因家族,根据结构特征可以分为A,B和C家族。本研究克隆得到的MeHSF18基因全长为867 bp,编码289个氨基酸。序列分析表明MeHSF18基因的蛋白质序列具有典型的HSFB家族的保守结构域[7],进化树分析显示MeHSF18基因与麻疯树和蓖麻等物种的亲缘关系较近。
HSF在不同的组织中有不同的表达水平。例如水稻中HSF在所有组织都有表达,没有基因特异性的只在某一个组织中表达。但是拟南芥中的AtHSF9基因则只在种子中表达[18]。本研究中MeHSF18基因在叶片中表达最低,在根相关组织中表达量最高,推测该基因主要在木薯块根中发挥作用。
HSF是植物响应非生物胁迫逆境的重要调节因子,不同的HSF对不同的逆境有不同的响应[19-20]。例如,在拟南芥中,AtHsfA9能够通过ABA信号通路提高植株应对干旱胁迫的能力,而AtHSFA2和AtHSFA8则可以提高植株应对盐和渗透胁迫的能力[21]。在水稻中,OsHSF17和OsHSF29也可以提高植株应对盐和渗透胁迫的能力[22]。另外,HSF也被认为和氧化胁迫密切相关,如OsHsfC2a和OsHsfA5被认为是ROS感知和含量积累的重要基因[23-24]。在本研究中,MeHSF18基因受到干旱和ABA的调控,表明MeHSF18基因可能通过依赖于ABA信号通路的途径来响应干旱胁迫。而MeHSF18基因在木薯PPD过程中的高表达则暗示该基因可能和氧化胁迫相关来影响木薯块根的PPD过程。对这些结果的进一步研究将有可能为木薯的抗逆和延缓PPD过程提供理论参考。
4 结 论
本研究克隆得到了木薯MeHSF18基因,该基因全长为867 bp,编码289个氨基酸残基数,蛋白保守结构域和进化关系分析显示该基因为HSFB家族成员之一。在ABA处理和模拟干旱胁迫下,MeHSF18基因的表达升高,表明MeHSF18基因可能通过依赖于ABA信号通路的途径来响应干旱胁迫。而木薯PPD过程中的高表达则推测该基因可能和氧化胁迫相关。下一步将通过对基因功能的研究来验证该基因在木薯抗旱和PPD中的作用。
