硼中子俘获治疗的进展及前景
2020-02-25童永彭
王 淼,童永彭
(深圳大学 物理与能源学院,广东 深圳 518000)
据统计,中国每年新发肿瘤病例约312万例,恶性肿瘤是我国第二位死亡原因,占死亡总数的22.32%[1],而全球每年癌症死亡人数则高达约630万人[2]。因此,癌症有效的诊断和治疗方案的开发需求很高。据资料显示,每年约有七成以上的肿瘤患者选择放射治疗[3]。随着世界各国医学水平的发展,放射治疗技术的更新日新月异。已有从传统无选择性的X、γ放射治疗,到具有一定纵向能量选择的质子及重离子放射治疗等多种肿瘤的放射治疗手段相继问世。其中,具有更高量级选择性杀灭肿瘤的硼中子俘获疗法(boron neutron capture therapy, BNCT)以其靶向深入治疗、毒副作用少、成本相对低廉等优势已经成为肿瘤治疗的热点,且目前已在诸多肿瘤病症的治疗上取得了良好的效果[4-5],并且其在医疗领域上的研究开发仍在继续。
1 BNCT原理
肿瘤放射疗法是现如今医学领域上较为普及的一种治疗方法,其原理是利用电离辐射的生物学效应,放出射线直接或间接地造成肿瘤细胞损伤。在大剂量电离辐射的照射下,生物机体及细胞大分子会造成损伤,从而导致肿瘤细胞的凋亡或坏死,即为直接作用[6]。而间接作用则是由于电离辐射作用于生物体内的水分子而产生了自由基[7],这些自由基带有不成对的电子,反应活性高,亦能够损伤DNA、蛋白质及各种生物膜等细胞的重要组成部分,从而导致肿瘤细胞功能紊乱、丧失[8]。另外,放射疗法作为一种局部治疗技术方法,其作用效果却是系统性的。该疗法除了作用于受照射部位之外,还可能使诱导死亡的细胞产生一种类似于原位肿瘤疫苗的效果[9]。
作为放射疗法的一种新型手段,BNCT在保留原有作用机理的同时,相较于传统疗法更具有新的优势,即具有更高的靶向性。它是通过将与肿瘤具有特异性亲和力的硼(10B)化合物-硼剂选择性富集于肿瘤细胞中, 然后用低能中子对肿瘤组织局部进行照射, 使俘获截面远比其他元素大的10B俘获中子形成局部核反应,继而分裂成一个α粒子和一个7Li反冲核。反应式如下:
10B+nth→11B→7Li+α+2.79 MeV 6.3%
10B+nth→11B→7Li+α+2.31 MeV 93.7%

由于释放的α等粒子碎片能量较高,而且射程较短,故对肿瘤周边组织的破坏较小,能选择性地杀死肿瘤细胞[10],原理示于图1。
2 现有放疗技术及BNCT的优势
2.1 现有放疗技术
作为最普遍的一种治疗肿瘤技术,放射疗法也在不断地革新,正逐步迈进精准治疗时代。目前现有的治疗手段分为光电子放射治疗、质子放射治疗、重离子放射治疗以及硼中子俘获治疗等。
光电子放疗中的传统方法是使用γ射线或X射线对肿瘤患处进行直接照射,因其是以指数形式进行衰减,导致在人体内的射程无法控制,故在治疗的同时亦会损伤正常的组织细胞,副作用较大[11]。近年来较为普及的三维适形放疗(3-dimensional conformal radiation therapy, 3D-CRT),其能够从各个入射角度按照肿瘤形状控制射野轮廓线,一定程度上限值了射线对正常组织的损伤,但对于与周边正常组织紧密相连的肿瘤进行治疗时,则需人为地调控照射野内部的剂量分布,难以实现[12]。基于适形放疗的缺陷,调强放疗(intensity modulated radiation therapy, IMRT)应运而生。它使用CT三维重建定位,高精度地产生符合肿瘤靶区细胞状态的照射剂量分布,但在分次治疗过程中亦难以克服人体呼吸运动造成的肿瘤形变与位移的问题[13]。而后产生了图像引导放射治疗(image guided radiation therapy, IGRT),即四维放射治疗,它在三维放疗的基础上加入时间因素,可以对运动肿瘤进行精准定位,但因其发展计划尚在设计阶段,短期之内难以实行治疗[14]。
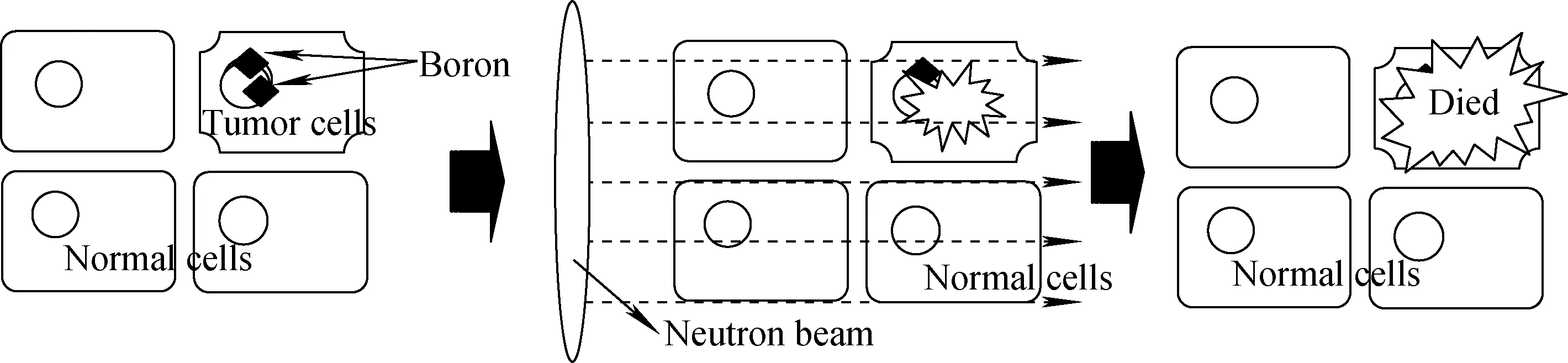
图1 硼中子俘获治疗肿瘤的原理Fig.1 The principle of boron neutron capture therapy
质子及重离子(例如碳离子)放射疗法利用其粒子的布拉格峰特性,即剂量损失集中于射程末端,能够尽量避开周围正常组织,在到达肿瘤细胞时骤停释放最大能量,来对病灶进行强力照射,因而成为了新兴的高效治疗技术[15],目前已有一些相关机构对其开展了实验研究。然而,质子放疗因设备价格昂贵及临床数据有限,尚在临床研究阶段。重离子放疗相较质子放疗具有更高的生物学效应,但也因其生物学效应过于复杂,影响因素多,故仍需大量临床研究证实其治疗效果[16]。
2.2 BNCT的优势
与上述放射疗法相比,BNCT的优势则更为突出:
1) 中子能够特异性地与肿瘤细胞中的硼发生俘获反应杀灭细胞,尤其对于弥散型肿瘤靶向性更强,定位更为精确,且克服了运动肿瘤定位困难的问题。
2) 中子发生俘获反应后,短距离释放出的粒子,其射程与细胞直径相当,故能更加确保在不影响周围健康组织的前提下杀死肿瘤细胞。
3) 该反应释放的带电粒子可以引起DNA不可修复的损伤,能更加有效地抑制肿瘤复发[17]。
4) 与质子等粒子相比,在同等能量下中子的穿透性更强[18],为深部癌症治疗提供了可能。
5) 中子的使用成本相对低廉[19]。
3 BNCT的进展历程
3.1 国外进展
使用BNCT的世界首例临床应用是于1951年在美国研究核反应堆上安装的中子照射场中进行的,但因为注入的硼化合物缺乏靶向性,没能够富集于肿瘤细胞中,导致肿瘤细胞中的硼剂浓度与正常细胞和血液中的比值较低(<1)[19],因此杀灭肿瘤细胞的效果甚微。1968年始,日本已经成功治疗了多例脑胶质瘤(glioblastoma, GBM)患者,并且经过长期跟踪观察,其患者5年生存率为58%,10年生存率为29%;由日本京都大学反应堆(Kyoto University reactor, KUR)安装的使用热中子照射设备的BNCT临床研究,从1990年2月开始定期进行。首先,该研究所的BNCT仅用于治疗恶性黑素瘤以及进行开颅手术治疗恶性脑肿瘤[20]。2002年,应用扩展到头颈部肿瘤,2003年发展为非颅脑切开术治疗脑肿瘤,直至2005年,治疗领域已经扩展至肝脏,肺和恶性胸膜间皮瘤等体内肿瘤[21]。后期,日本研究者使用手术切除肿瘤后用低能中子辐照,对脑胶质瘤患者进行治疗,治愈后长达20年无复发[22]。目前,该团队采用BNCT+X线放疗的最新疗法,但具体治疗效果尚在研究[23]。90年代起,欧洲一些国家也掀起了BNCT研究的热潮。芬兰在VTT公司的支持下,使用FiR-1反应堆进行了BNCT研究试验[24]。美国Coderre团队使用硼剂BPA对神经胶质瘤载瘤鼠进行治疗实验,且其治疗效果达到了预期[25];除此之外,美国研究团队在基于Monte Carlo方法的基础上,成功开发了临床模拟实验软件,如MacNCTplan, SRIM等[10]。2001年,意大利首次成功治疗了人类BNCT肝癌。2003年起,阿根廷进行了黑素瘤BNCT临床一期和二期试验,有效率达到约69.2%[26]。2009年初,世界上第一个基于加速器的中子辐射BNCT临床照射辐射系统在日本京都大学原子炉实验所完成,于2011年开展了细胞及动物临床实验,且2012起开始使用该系统进行临床治疗。BNCT目前已经得到了更加广泛的应用与支持。尽管有多个中断时期,截至2014年11月,已使用基于反应堆的系统进行了510次临床照射。使用各种基于加速器的辐照系统(包括C-BENS)的BNCT可以在不久的将来在多个设施中进行。 显然,BNCT从特殊的颗粒治疗转变为一般的治疗正在进行中。2017年5月,国外已有研究者正在测试基于加速器的中子源采用BNCT治疗骨肉瘤的可行性[27]。
由表1可知,目前国际上诸多国家已经开展了BNCT的研究,其使用的中子源类型由早期的热中子源,逐渐演变为超热中子源,从而提高了中子的穿透深度;并且,随着BNCT医疗技术的不断进步,BNCT治疗的癌症种类也在不断拓展,已经由脑胶质瘤发展到皮肤恶性黑色素瘤及肝、肺、胸膜癌等领域;另外,从表中得知,日本目前在国际上处于BNCT治疗的前沿,开设了多座反应堆BNCT治疗孔道,并且治疗病例以及涉及病种数最多,约占世界BNCT治疗总数的一半,美国则紧随其后[28]。
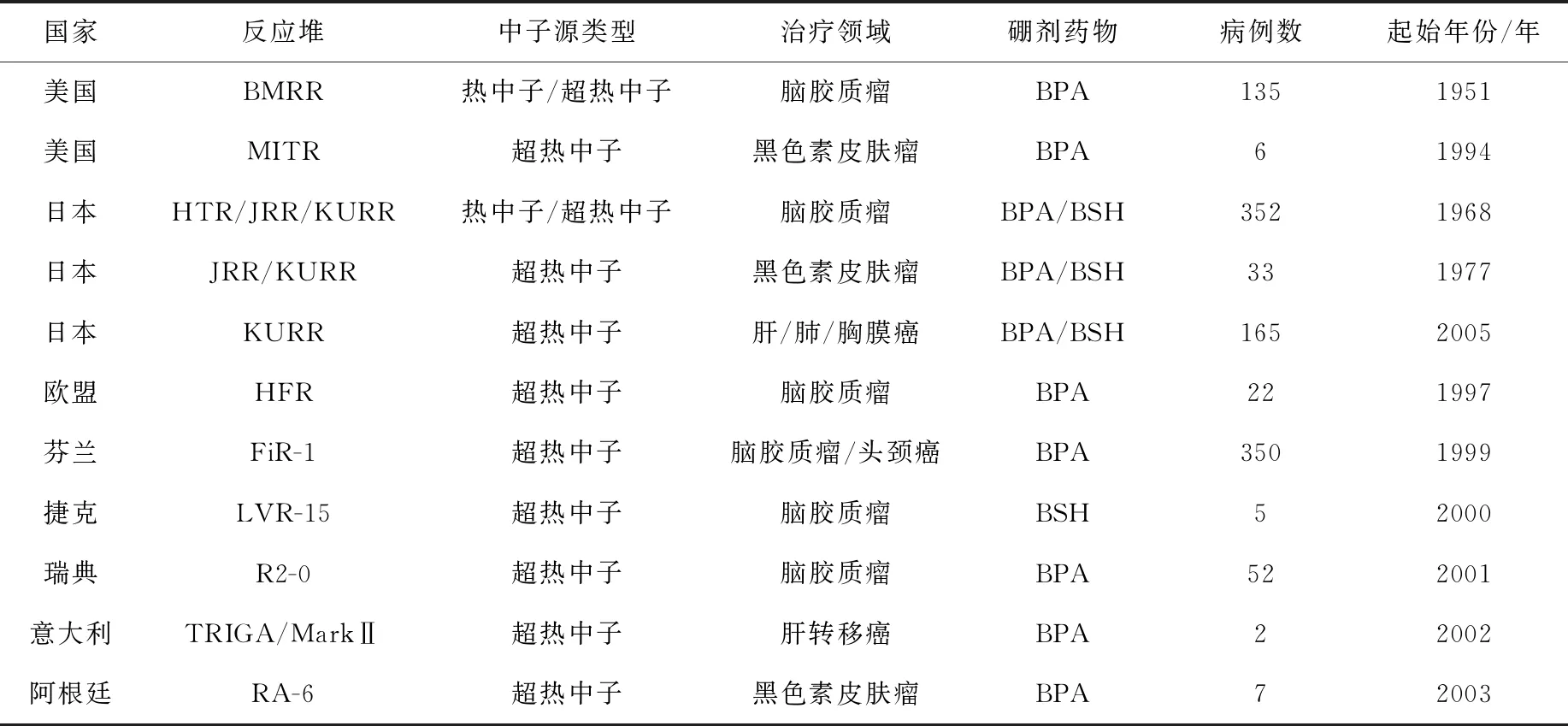
表1 世界各国BNCT临床治疗进展情况表Table 1 International BNCT clinical development
注:表中数据来源于文献[28]。
3.2 国内进展
我国的BNCT研究起步较晚。1990年6月,我国首次在北京召开了BNCT的学术研讨会,开启了BNCT科研领域的篇章;2006年10月,日本举办了第12届NCT国际大会,国内以原子能院为首等单位首次参加,并参与了一些基础项目的研究。2009年12月,我国著名核反应堆工程专家周永茂教授带领团队设计建造了中国医院中子照射器(in hospital neutron irradiator-mark 1, IHNI-1),它是世界上BNCT治疗领域上唯一的专用研究堆。其配备有2条不同能域的照射束装置,既能够开展动物试验,又能够照射治疗人体浅表以及体内脏器的肿瘤,这项发明在我国BNCT研究领域上具有里程碑式的意义[10]。2010年3月召开了医院中子照射器BNCT交流研讨会,同年,中国台湾利用改造后的清华大学泳池堆进行了复发性头颈部肿瘤的治疗,有效率高达70%[2]。2015年5月,我国使用IHNI-1首次成功治愈了一名黑色素瘤患者[29]。到目前为止,在“十二五”国家科技支撑计划项目“恶性肿瘤诊治新技术和新方法研究”子课题“硼中子俘获疗法技术研究——二元靶向放射治疗技术”的支持下,共进行了3例恶性黑色素瘤患者BNCT临床研究,并取得了研究预期效果[28]。2017年8月11日,中国科学院高能物理研究所与深圳市东阳光集团在广东东莞签署硼中子俘获治疗项目合作协议,充分结合高能所在设备研发上的领先优势与东阳光一流的肿瘤药化学能力,有望在未来五年内开发适合医院的BNCT装置,开启全国治疗肿瘤疾病的新时代[30]。目前,中子质子治疗肿瘤医院已经在上海建立并已投入治疗工作。且预计十年之内,东阳光集团与湖北省宜都市政府将联合投资建立一所BNCT肿瘤治疗中心。至此,我国的BNCT研究进入了有望在医院实施的全新阶段。
4 BNCT研究的热点问题及展望
4.1 高效含硼药物的研发
硼剂是指针对特异性癌基因或其表达产物,合成的与之有特异亲和力的硼化合物。BNCT当前的研究瓶颈主要还是研发适合的硼剂。理想的含硼药物应满足以下基本要求:
1) 硼剂量要达到要求,至少保证每克肿瘤组织吸收约10~30 μg10B,即每个肿瘤细胞含有109个10B原子,并且在照射期间,肿瘤细胞内硼浓度要保持在一定的剂量之上[31]。
2) 肿瘤细胞对正常组织以及血液的硼浓度比值(T/N),(T/B)均要保证达到3以上[32]。
3) 除了被处于分裂期的肿瘤细胞摄取之外,还可以被乏氧肿瘤细胞吸收。
4) 无毒,水溶性好[33]。
据文献报道,目前已经开发了几代含有10B的药物,并对其疗效进行了临床检验。第一代10B传递分子包括硼酸钠、硼酸和衍生物。第一代含硼分子不具备肿瘤靶向能力,不能达到足够高的肿瘤血硼比,无法达到有效的中子俘获治疗效果。因此,他们对恶性肿瘤的临床治疗已被证明为失败[34]。
在第二代BNCT试剂的研制中,强调了分子能够选择性地被肿瘤细胞吸收,或具有寻找肿瘤的特性。在临床治疗方面已有两种被美国食品及药物管理局批准的含硼药物,4-二羟基硼酰基苯丙氨酸(p-boronophenylalanine, BPA)与巯基十一碳氢十二硼烷(sulfhydrylborane, Na2B12H11SH, BSH)[35]。目前,BPA是临床应用BNCT的标准治疗药物[36],它是一种基于氨基酸(L-苯丙氨酸)结构的硼化衍生物。肿瘤细胞中的L-氨基酸转运系统与正常细胞相比,在包括大脑在内的大多数器官中都有较高的表达[37]。BPA被认为是比BSH更好的10B传递剂[38]。一般来说,以BSH为代表的无机10B化合物对肿瘤的选择性低于BPA,因为他们缺乏特异性进入细胞的系统。此外,由于BSH只有在血脑屏障被破坏时才能进入大脑,所以BSH在肿瘤浸润区的分布很差。然而,与BPA相比,BSH每分子含有12倍的10B原子,这是BSH相较于BPA的一个显著优势。与第一代硼剂相比,其二者已经在脑部、头颈部、皮肤以及肝脏部位肿瘤治疗上具有一定的疗效,且治愈后的存活期较长[39]。另外,肿瘤细胞中的硼剂浓度与正常细胞和血液中的比值(T/N,T/B)仅大于1,因此,这两种硼剂对肿瘤细胞的靶向性一般,在摄入后将迅速从血液中被清除[40]。尽管这两种硼剂在性能方面已有较大改进,但其效果距离BNCT技术所需的要求还相差甚远,新型硼剂的研发迫在眉睫。
目前,第三代硼剂也正在研发实验当中。在先前的研究中遇到的主要障碍之一是很难将足够剂量的10B分子输送到肿瘤细胞中,同时仍保持较高的肿瘤与血硼比。这些第三代硼化合物倾向于更具体地作用于靶向肿瘤细胞,即肿瘤细胞核和DNA对这些药物具有诱惑力,进而使T/N或T/B提升到较高值。如果硼原子能够被定位在核内或核附近,则产生致死作用所需的硼化合物剂量可能会大大减少。
有几种此类硼剂药物已有了初步的研究成果,第一种是由表皮生长因子受体(epidermal growth factor receptor, EGFR)介导的,与表皮生长因子( epidermal growth factor, EGF)相结合的BPA[41-42]。EGFR基因在几种人类癌症中过度表达,被认为是一个合理的抗癌治疗靶点,针对其他癌症相关基因的其他核酸序列可以根据具体需要使用。EGFR信号通路在癌细胞中的激活不仅与细胞增殖增加有关,还与血管生成、转移和凋亡减少有关。因此,与EGF相结合的硼原子能够大量结合在肿瘤细胞表面,还能够起到阻断EGFR信号通路的作用,从而抑制癌细胞的增殖。此外,临床前的数据已经证实,许多抗EGFR药物有可能会提高现有的细胞毒性药物的有效性[43]。因此,EGFR靶向治疗癌症的原理是显而易见的。具有双组分活性药物的开发,如BNCT和抗EGFR活性的硼载体,代表了一种新的癌症治疗方法[44]。
第二种硼剂是由叶酸受体(folate receptor, FR)介导的,与叶酸结合的含硼脂质体或碳纳米颗粒[45-46]。据报道,肿瘤细胞在细胞膜上存在叶酸受体的过度表达,而正常细胞则很少或根本没有叶酸受体[47-48]。因此,叶酸分子可以通过化学连接含硼粒子来提高脂质分子或纳米材料的细胞吸收效率,进而增加肿瘤细胞的中子俘获元素含量[49]。FR介导细胞内吞,能够使含硼药物被运送至细胞内,且高表达FR的HeLa 细胞可以靶向摄取含硼碳纳米颗粒等相关研究已有报道[50-51]。在此之前,单壁碳纳米管被广泛地用作生物货物,用于将具有生物活性的分子输送到细胞[52-54]。为了进行BNCT,取代的C2B10碳硼烷笼被化学连接到水溶性单壁碳纳米管上[55]。动物模型研究表明,取代碳硼烷-单壁碳纳米管复合物能选择性地聚集在小鼠乳腺癌细胞中,其最大浓度可高达每克组织22.8 μg硼,符合硼剂的治疗要求[56]。
第三种硼剂是能够被胶质瘤细胞T98G选择性摄取,且具有较高的亲水性,与卟啉相结合的硼酸盐(boronated porphyrin),即硼化卟啉[57-58]。其结构上是通过酯、醚、酰胺或碳-碳键与卟啉大环相连的碳硼烷笼。硼化卟啉对于肿瘤有较高的亲和力,定位的优势位点在肿瘤细胞溶酶体内。且其易于合成高硼含量化合物,在黑暗条件下细胞毒性较低,在肿瘤细胞内保留时间较长。另外,硼化卟啉具有良好的光物理性质,包括在可见光和近红外区域的强光吸收,光活化时产生单线态氧的能力,以及荧光特性[59-60]。因此,硼化卟啉可作为光动力疗法(photon dynamic treatment, PDT) 和硼中子捕获疗法(BNCT) 的双敏化剂,具有广阔的应用前景。此外,在临床上,硼化卟啉在荧光引导下的脑肿瘤切除术中非常实用,可以提高切除率,预期病人预后会进一步改善[61]。据报道,目前已有研究者合成了多达8个硼团簇(10B含量38%)和16个硼团簇的高硼含量硼卟啉[62],这类化合物有可能在相同剂量下向肿瘤提供更多的硼,在BNCT中提高治疗效率。此外,在用低能中子活化时,亲水性较强的八聚阴离子卟啉除了可引起肿瘤细胞损伤外,同时还可能对肿瘤血管造成损害[63]。
第四种硼剂是由透明质酸多糖(hyaluronic acid, HA)与硼酸盐结合成的离子络合物。这是一个由最具有生物化学适应性和水稳定性结构的多糖和四硼酸盐中和形成的多硼砂链组成的复合体系。由于HA具有与生物组织的多重互动性,因此它是靶向递送与其融合的活性化合物载体的理想选择[64]。它可以与成纤维细胞表面相互作用,因为它能够选择性地与细胞质膜表面的特异性受体结合[65]。由于其天然来源,HA具有生物相容性,生物可降解性和非免疫原性等有利特征,且在炎症,伤口愈合或癌症转移过程中充当细胞信号分子[66]。HA与其受体和降解酶一同起到抑癌剂的作用,抑制肿瘤的生长和转移[67]。此外,美容学领域的长期使用经验表明,即使在非常大的剂量下,HA也是低毒无害的[68]。且因透明质酸-硼酸盐络合物作为螯合配合物,在水溶液中是极其稳定的。目前,尽管已有许多有关复合多硼酸盐与HA络合的相关研究[69],但尚未发现关于此类硼剂的BNCT疗效的研究结果发表。
当前,我们的课题组正在对一种新型研究方向——EGFR抑制剂作为硼剂药物进行研究。选取一到两种核苷类EGFR抑制剂,将10B与核苷化合物相连接,那么在肿瘤细胞高效繁殖的条件下,10B能够更有效地与DNA相结合,从而大量靶向地富集于肿瘤细胞中,尤其在细胞核中,极大提高了对肿瘤细胞的杀伤力[70]。该种硼剂的优势为:第一点,EGFR的抑制剂本身就能够有效抑制肿瘤细胞增殖,同时还能对肿瘤细胞DNA的损伤修复产生抑制作用,且具有放疗增敏的特性。第二点,它在与跨膜蛋白的EGFR结合后,利用俘获反应产生的能量破坏重要的细胞膜通道位点,使细胞膜破裂,进而导致肿瘤细胞死亡。第三点,该含硼核苷类EGFR抑制剂能够被肿瘤细胞选择性吸入,与遗传基因相结合,破坏多基因靶点,继而诱导肿瘤细胞凋亡。综合这三点的效应,将极大的提高硼中子俘获选择性杀灭肿瘤的效率,降低辐射剂量[71]。由于大部分肿瘤细胞膜的EGFR远远高于正常细胞,因此特异性含硼EGFR抑制剂将选择性的富集在肿瘤细胞膜上,大大提高了T/N或T/B≥3的可能性。并由于其多重诱导细胞凋亡的作用,因此富集在肿瘤细胞上的含硼EGFR抑制剂可以在较低的浓度达到理想的效果。这样多功能性的高选择性的硼剂研究也是国际发展的方向和研究的热点[72]。
硼药本质上就是一种中子辐射增敏剂,其在肿瘤组织分布,代谢过程,尤其在细胞上特异靶点分布与中子辐射的增敏效果密切相关,只有通过比较中子辐射增敏效应及机理研究才能更好地筛选出靶向功能性(EGFR抑制剂)的核苷类硼药。
4.2 建立精确的剂量测算体系
在硼中子俘获治疗中,辐射剂量学占有重要的地位。BNCT成功施行在于依据癌组织中10B的累积量来给予相应的中子照射量,其中关键问题在于实时测量中子注量率及肿瘤组织中硼剂量[73]。对于中子注量率的计算,已有一部分报道及临床实验表明。有光纤闪烁探测器实时测量[74]、较为精准的三维计算法直接测量、更有间接测量等方法对计算结果进行验证,测量体系已相对成熟,误差亦在可控范围之内[75]。而对于肿瘤细胞内硼剂量的计算更是至关重要的,BNCT需要根据肿瘤组织中硼剂量的不同而设定辐照剂量。因此10B浓度于BNCT是一个关键性参数,其将为制定BNCT治疗方案提供剂量学的依据[18]。
BNCT治疗过程中,因血液及正常组织中的10B剂量和肿瘤组织中的10B剂量成一定比例, 早期则利用这一点,在治疗过程中,通过测量患者血液中的硼剂量,以1∶2或1∶3的比例推算出肿瘤组织中的硼剂量[76]。但此种利用估值计算的方法,导致估算出的肿瘤内的硼浓度产生一定的误差。目前的测量方法通常有3种:1)物理测量法:径迹刻触技术(track engraved technology),灵敏度高但操作繁杂,分析时间长,不能实时测量;2)化学测量法:等离子体原子光谱分析法(inductively coupled plasma atomic emission spectrometry, ICP-AES),是目前最普遍的一种测量方法,测量时间较短,但该方法需要对样品进行处理,程序多重,会对试样造成破坏;3)核测量法:即瞬发γ射线中子活化分析法(prompt-gamma neutron activation analysis, PGNAA)[77],采取微量组织血液样品装入小瓶,再快速打入反应堆内由热中子束照射,再由高纯锗探测器测量由10B裂变产生的能级为478 keV的γ射线强度,进而推算样品中10B的含量。该方法精准、快速,且无需对样品进行处理。目前,该法已在临床实验中投入使用,我国在医用中子照射器上已经建立了PGNAA系统来测量血硼浓度[78]。
然而,取样检测硼剂浓度的技术是远远不够的,毕竟在BNCT过程中,医生无法对肿瘤组织进行取样检测,获取数据。上述方法都仅仅对某一时间点,某一个肿瘤位点进行硼剂量检测,并不能提供动态下肿瘤组织各个位点中与正常组织及血液中硼浓度的比值信息,故BNCT不能够有效地设计处方剂量进行治疗。
而后,18F-BPA PET(Fluorine-p-boronophenylalanine positron emission tomography)成功问世,由示踪剂18F标记的硼剂药物18F-BPA(Fluorine-p-boronophenylalanine)注射入患者静脉后,其发射出正电子与邻近组织中的负电子发生湮没反应,放出两个能量相等方向相反的γ光子,符合电路检测到即获取信号。通过PET扫描得到影像数据,以此得到正常组织与肿瘤组织中10B 的浓度比值。该技术已被用于预测BNCT前肿瘤组织内硼剂的累积量以及估计剂量计算中10B的空间分布[79],且已适用于转移性黑素瘤、口腔复发癌等多种疾病的治疗中。
总之,虽然目前18F-BPA PET技术对于一些肿瘤病症的检测是有效的,但其对于炎症的特异性并不高,且在精度与定位方面仍存在一定的限制。因此,如何能够使其更为精准地普及至更多肿瘤的治疗中尚待进一步研究。10B进入细胞内的数量及位置是随肿瘤等级和生物化学性质而变化的,若要使BNCT成为更高精度的放疗技术,则需要更加精确且实时获取肿瘤靶区不同状态细胞内的10B浓度,以此来精准设定各个靶点的中子照射动态剂量分布,且要求其能够普遍适用于多种病症,进一步提升治疗效果。目前已有一种设想方案,即将核磁共振成像(magnetic resonance imaging, MRI)与PET相结合[80]。利用MRI的软组织密度探测能力与PET分子层面的探测能力对硼剂量进行综合测量的技术,或许会成为BNCT未来的发展方向之一。
4.3 开发适合的中子源
中子实验一般以核反应作为中子来源,常用的中子源有核反应堆中子源、加速器中子源以及放射性核素中子源[81]。目前,国际上众多国家已经开始基于反应堆的中子源开发BNCT,并在BNCT临床实验中对反应堆生成中子的特征进行了大量的研究工作。鉴于原子反应堆的使用涉及运营程序复杂,安全性低,且成本较高的问题,中子源也正朝向无核化的趋势发展。
目前,用于BNCT的基于反应堆以及加速器的中子源已经被开发出来。2009年,基于微型中子源核反应堆,周永茂院士团队成功研发了医用中子照射器IHNI-1,其具有燃料元件低浓化、反应堆高功率、寿命长(10年)且寿期内无需换料等优势,相较国内外早期微堆更适用于BNCT[82]。与此同时,基于反应堆系统及加速器系统的临床研究也一直在进行中[83]。 2009年初,日本已经建成世界首例基于加速器的BNCT临床照射系统,被称为“回旋加速器热中子源”(C-BENS)[21]。使用C-BENS的临床试验于2012年开始。北京大学目前也正在研发射频四极场加速器,朝着医院开展BNCT治疗的方向迈进了一大步[84]。2014年,由筑波大学Kumada率领的项目小组iBNCT,已在茨城中子医学研究中心开发一种以加速器为基础的BNCT设施,该设施使用8 MeV质子束来产生中子[85]。近来已有研究成果表明,中子管中子发生器也可以替代反应堆作为BNCT的中子源[86],但具体实施方案尚在研究中。2017年8月,国内中国散裂中子源与东阳光集团联合开发适合医院的BNCT装置,在已建成的3.5 MeV强流质子加速器基础上,研制我国首台基于加速器的BNCT装置,有望3年内用于实验研究[87]。
与放射性核素中子源相比,加速器中子源具有中子产额高、粒子束脉冲化、方向性强等优势。而相较于核反应堆中子源,加速器中子源则在keV能区拥有更高的中子产额,且伴随放出的γ射线较少,另外还有设备简单、成本低及安全性高等优势,故其更适用于医用BNCT。加速器中子源一般通过A(a,n)B反应发射中子,入射粒子a一般为α等带电粒子,而靶核一般选用2D,7Li,9Be等中子结合能低、能级间距大的轻核[80]。BNCT要求中子能量在keV量级(低能),且强度较高。据以往实验记载,9Be、13C等靶核反应放出的中子能量均在MeV量级,且慢化时伴随着高能γ射线放出,不符合要求。而7Li(p,n)7Be反应阈能为1.881 MeV,当入射粒子能量接近阈能(约1.9 MeV)时,反应放出能量为30 keV的中子,且中子产额也处于中等水平,故该反应从理论上可以满足BNCT对中子的医用需求[88-89]。因此,大力开展研发基于7Li(p,n)7Be反应的加速器中子源将是BNCT未来的发展方向之一。
5 结语
BNCT已经成为癌症治疗领域的的新热点,随着技术的不断进步,BNCT已经能够安全有效地治愈更多的恶性肿瘤。然而,BNCT的发展仍面临着诸多问题,首要问题便是高效硼剂的研发,而高精度的硼剂量测量体系对于治疗效果同样至关重要。除此之外,中子源也需要朝着脱离大型核反应堆的趋势进一步发展。以EGFR抑制剂作为硼剂药物,MRI/PET联合技术作为硼剂量测量体系,以及基于7Li(p,n)7Be反应的加速器中子源的设计,或将成为BNCT的重点研究方向之一。随着技术的不断发展与研究的逐步深入,BNCT必将在肿瘤治疗领域处于举足轻重的地位。
