钴粉生产过程中含钴“回收料”低成本处理与循环利用方法研究
2020-02-25黄苏勇韩厚坤王朝安朱治军
黄苏勇,韩厚坤,2,王朝安,朱治军
(1.安徽寒锐新材料有限公司,安徽 滁州 239000;2.南京寒锐钴业股份有限公司,江苏 南京 211100)
资源与环境是人类生存发展的基础。随着我国经济的高速发展,对金属的需求不断扩大也给现有采、远、冶等各个环节带来了不同的压力和影响,进而引发了资源、能源、环境等方面的严重问题,制约了我国社会和经济可持续发展。我司在从钴盐到金属钴粉生产过程中,因扬尘、洗袋、舟底粘料等原因产生以下几种主要含钴回收料:碳酸钴回收料、钴粉回收料和氧化钴回收料。因生产线未配置浸出和除杂工序,所有涉及浸出的物料均无法用常规的工艺“浸出和净化除杂”方法进行处理,从而无法实现这部分回收料循环再利用,造成大量资金的积压。
本文通过试验,寻找一套低成本处理工艺方法,实现含钴回收料循环再利用。
1 实验部分
1.1 实验原料
实验原材料为三种:碳酸钴回收湿料、钴粉回收料、氧化钴回收料。分析其超标的杂质如下。
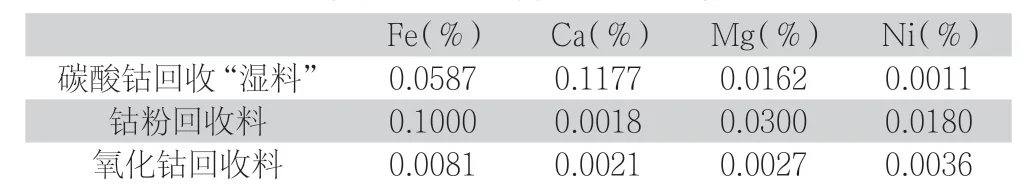
表1 各类含钴回收料主要金属杂质含量
1.2 实验原理和方法
1.2.1 碳酸钴回收料处理
碳酸钴回收料处理比较简单,用稀盐酸在常温下即可溶解。反应方程式为:
CoCO3+2HCl=CoCl2+CO2↑+H2O
此反应很容易发生,但是我们的碳酸钴中还混有氧化钴,而氧化钴在常温下几乎不与稀盐酸反应,所以在溶解之后需将不溶解氧化钴过滤掉和氧化钴回收料混合再处理。
1.2.2 钴粉回收料处理
钴粉回收料用盐酸溶解起来非常缓慢,需要加热才能进行。在反应过程有氢气产生,需要做好抽气,确保安全。反应方程式如下:
Co+2HCl=CoCl2+H2↑
1.2.3 四氧化三钴回收料处理
在整个生产体系中,为了不带入杂质,四氧化三钴回收料用盐酸处理,但在常温下很难溶解,需加热到高温。在反应过程会产生氯气,要做好尾气吸收系统。Co3O4与盐酸反应方程式:
Co3O4+8HCl=3CoCl2+Cl2↑+4H2O
2 试验过程及数据分析
2.1 碳酸钴回收湿料的处理
2.1.1 实验过程
取碳酸钴回收“湿料”108g,含水率35%,装入烧杯,加水100g 化浆,常温下搅拌,向烧杯中缓慢加入31%的盐酸126 克,反应过程中向烧杯中补充水,反应2 小时,碳酸钴基本溶解,反应终点PH 值3.5。过滤后滤渣烘干为11g,滤液488ml。滤液取样检测元素Fe、Ca、Mg、Ni、Co 含量。
2.1.2 实验现象与分析
实验过程容易冒泡,向烧杯中喷水泡沫消失。碳酸钴与盐酸容易反应,常温下即可完全溶解,反应比较剧烈,加料时需要注意缓慢加入,以免冒槽。
2.1.3 实验结果

表2 碳酸钴回收料处理后滤液杂质检测结果
工艺要求氯化钴液杂质含量≤0.0026g/L,溶液稀释58倍即可作为氯化钴溶解时加入到溶解槽溶剂,PH 值和氯化钴液一致。
2.1.4 工业化实施
用PPH 材质反应釜直接投料酸溶,实际生产时按每千克碳酸钴回收“湿料”投配1.3Kg31%盐酸,加水至5 升完全溶解后,稀释58 倍杂质即可作为溶解氯化钴的溶剂使用,常温或者适当加热缓慢溶解,为防止冒槽,需要缓慢加料。按照满负荷生产,每天大约可以处理60KG 钴金属量,每月可以处理1.8 吨钴金属量。
2.2 氧化钴回收料处理
2.2.1 实验过程
常温下,取100g31%的浓盐酸装入烧杯,加100ml 水稀释,向烧杯中加入25g 氧化钴回收料,加热到75°,溶液颜色迅速变成绿色,继续升温到85°左右,液面有气泡产生,反应过程中间断向烧杯中加少许水稀释,防干烧结糊,随反应进行,溶液颜色逐渐变成深紫色。保温3.5 小时,PH值1.5,氧化钴完全溶解。用滤纸过滤,得滤后液255ml。取样检测元素Fe、Ca、Mg、Ni、Co 含量。
2.2.2 实验现象与分析
反应过程中有氯气释放而产生轻度泡沫,过程中需监控PH 值,酸度下降需要补加盐酸直至氧化钴完全溶解。终点PH 值1.5,酸度高时加热溶解反应比较明显,因钴和氯的络合作用反应过程中溶液变成绿色,加水稀释后绿色逐渐消失。
2.2.3 实验结果

表3 氧化钴处理后滤液各元素检测结果
2.2.4 工业化实施
氧化钴回收料主要是四氧化三钴,检测杂质含量非常低,残酸酸度相对稍高,PH 值1.5 的溶解液可以进行残酸回用,残酸用来继续溶解碳酸钴回收料,消耗残酸至PH=3~4,再根据杂质的含量计算出达标所需要稀释的倍数,稀释至杂质达标后在氯化钴晶体溶解时做溶剂使用最终转化成产品。
工业化处理时,因为溶解过程中有氯化氢气体挥发出来,同时产生有毒气体氯气,需要做好氯化氢气体和氯气的吸收,以达到环保要求。氧化钴与盐酸反应化学方程式:
Co3O4+8HCl=3CoCl2+Cl2↑+4H2O
根据化学反应方程式,1 吨氧化钴生产氯气295Kg,标准状况下氯气密度约3.17Kg/m³,所以处理1 吨氧化钴产生的氯气93Nm³。对于氯气处理后的排放问题,我国有严格的标准[1],对于氯气允许的最高排放浓度、允许最高排放速率、无组织排放监控浓度要求详见表4。

表4 污染物氯气排放限值
从上表可以看出,氯气的排放标准非常严格,要达标环保的要求,必须有一套完善的氯气吸收系统。一般氯气吸收有液碱吸收法、生产液氯法等几种方法[2],各种处理方法比较如表5。
经过比较,并综合考虑废气中同时含有氯化氢气体和氯气,选择两段吸收,即一段水吸收加一段液碱吸收,水吸收可以溶解大部分氯化氢气体和部分氯气,液碱吸收剩余的氯化氢气体和氯气,吸收液储存起来交给环保公司处理。
2.3 钴粉回收料处理
2.3.1 实验过程
用烧杯装100g31%的盐酸加200ml 水稀释,加热到45℃,缓慢加入回收料钴粉20g,开始缓慢反应,钴粉加入时间为40min。1.5h 后温度升到55℃,保温继续反应。反应3h 后,往烧杯中补加31%盐酸11ml,继续保温。反应至4h,升温至80℃~85℃保温,加速反应。4.5h 后往烧杯中补加31%浓盐酸10ml。反应6h 后完全溶解,得滤液300ml,滤液酸度很高,氢离子浓度0.5mol/L。滤液取样检测元素Fe、Ca、Mg、Ni、Co 含量。

表5 氯气吸收方法及优缺点对比
2.3.2 实验现象与分析
加热到80℃~85℃,反应比较明显,而且随着酸度偏低以及溶液中离子浓度升高,反应越来越慢,整个实验过程中,没有明显的气泡产生,反应很缓慢。加强抽气,可在确保安全的前提下提高效率。反应终点酸度很高,可利用钴粉酸溶液的残酸来继续溶解碳酸钴回收料。
2.3.3 实验结果
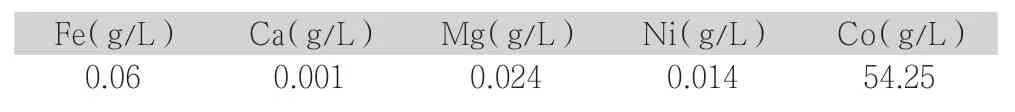
表6 处理后滤液各元素检测结果
2.3.4 工业化实施
回收钴粉酸溶后滤液酸度较高,利用此滤液残酸继续溶解回收碳酸钴,可消耗部分残酸,使溶液PH 值下降到3~4接近氯化钴溶解液的PH 值,然后过滤,将滤液杂质稀释至0.0026g/L,溶液作为溶解氯化钴晶体用。
钴粉与盐酸反应产生氢气,1 吨钴金属量产生约34kg氢气,体积为378Nm³,虽然反应速度较慢,但是通风、防火、防爆、工人培训等安全措施必须到位。
3 结语
按照传统的工艺,回收料一般都是通过浸出工序进行溶解,经过净化、萃取等,经过整个工艺流程走一遍最终变成产品,处理流程长,成本较高。我们通过溶解与残酸回收利用,使酸溶解液进入沉淀前一道工序,原料溶解工序作为溶剂使用,并入工艺的主流程,直接跳过了净化和萃取两道除杂工序,利用水稀释代替除杂,并利用稀释后的“稀溶液”溶解氯化钴晶体,做到百分之百回用,大大节约了生产成本,处理工艺也变得简单可行,一方面解决了回收料积压造成的财务成本问题,另一方面节约生产制造成本,是一种最简单最经济的处理方式。
