危重症营养风险评分在基底节区脑出血术后危重患者肠内营养支持中的应用▲
2020-02-23崔永华朱建华朱咸云孙兆欧刘存富潘国翠郑爱东
崔永华 朱建华 朱咸云 孙兆欧 刘存富 朱 玉 潘国翠 郑爱东
(南通大学附属建湖医院1神经外科,2重症医学科,江苏省建湖市 224700,电子邮箱:402403019@qq.com)
危重症营养风险(Nutrition Risk in Critically Ill,NUTRIC)评分可根据危重症患者的基础疾病情况,优化患者的营养状况评估[1]。高血压性基底节区脑出血手术患者多为病情危重、意识不清的卧床患者,NUTRIC评分可用于该类患者的营养风险评估。本研究比较不同NUTRIC评分的基底节区脑出血术后危重患者的营养状况及临床预后,为基底节区脑出血术后危重患者营养方案的制定提供指导意见,现报告如下。
1 资料与方法
1.1 临床资料 选取2016年3月至2018年2月我院收治的70例高血压性基底节区脑出血危重患者,其中男性39例,女性31例;年龄47~82(67.5±7.9)岁;格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)评分3~8(5.3±0.6)分;左侧基底节区脑出血43例,右侧基底节区脑出血27例;血肿破入脑室11例;血肿量30~70(43.6±8.8)mL。纳入标准:(1)均有高血压病史;(2)发病6 h内就诊,入院时GCS评分≤8分;(3)经头部CT检查确诊为基底节区脑出血;(4)均采用骨瓣开颅经侧裂或颞上沟手术清除血肿;(5)术后未再输血,未使用白蛋白;(6)术后24 h后即行肠内营养治疗;(7)住院时间或存活时间>1月;(8)患者均签署知情同意书。排除标准:(1)二次手术患者;(2)动脉瘤、脑血管畸形出血、淀粉样血管疾病所致的脑出血患者;(3)发病前已有精神障碍、认知障碍者;(4)合并严重心脏疾病以及肝、肾功能严重损伤者;(5)合并糖尿病及其他影响营养和代谢的疾病患者。本研究通过医院伦理委员会批准。
1.2 NUTRIC评分及分组 患者术后24 h肠内营养治疗前由责任护士应用NUTRIC评分[2]进行营养状况评估,0~4分定为低分组,5~9分定为高分组,评分内容见表1。

表1 NUTRIC评分量表
1.3 营养支持方法
1.3.1 腹腔压力监测:采用测量水柱高度的方法进行腹腔压力测量[3],12 mmHg以内为腹腔压力正常,12~15 mmHg为腹腔内压力增高Ⅰ级,16~20 mmHg为腹腔内压力增高Ⅱ级,21~25 mmHg为腹腔内压力增高Ⅲ级,>25 mmHg为腹腔内压力增高Ⅳ级。
1.3.2 胃残余量:用50 mL注射器匀速、缓慢抽吸胃内容物来测量胃残余量。
1.3.3 营养支持:(1)肠内营养支持。采用恒温器加热间断持续泵入(18 h/d),目标热量为126.52~146.44 kJ/(kg·d)[以130 kJ/(kg·d)计算]。肠内营养治疗前测定腹腔压力、胃残余量,计算胃残余量与输注速度的比值(胃残余量/输注速度),肠内营养治疗起始输注速度为30 mL/h,肠内营养开始2 h后腹腔压力正常且胃残余量/输注速度比值<2,输注速度可加倍,逐渐加至60~90 mL/h,每4 h测量一次的腹腔压力和胃残余量。腹腔压力I级时,输注速度不变;腹腔压力Ⅱ级时,减慢输注速度为25~30 mL/h;腹腔压力Ⅲ级或以上者,停止或减慢至25 mL/h以下。胃残余量>200 mL,暂停或减慢至30 mL/h以下;胃残余量≤200 mL则加至原来的速度。(2)肠外营养支持。若肠内营养起始治疗阶段不能完全满足患者营养需求时,即未达到目标热量时,静脉给予肠外营养支持,其配方包括葡萄糖、氨基酸、脂肪乳、维生素、微量元素及胰岛素。
1.4 观察指标 (1)术后第1天和第7天清晨,空腹抽取两组患者静脉血,采用免疫比浊法测定营养指标,包括血清白蛋白、前清蛋白、转铁蛋白;(2)观察肠内营养达到80%目标热量的时间,肠内营养治疗7 d内达标率,记录院感发生率、机械通气时间、重症监护时间;(3)术后1个月时病情转归情况,以格拉斯哥结局量表分级[4]表示,Ⅰ级为恢复良好;Ⅱ级为中残;Ⅲ级为重残;Ⅳ级为植物生存;Ⅴ级为死亡。
1.5 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者营养支持情况及院感发生率等指标的比较 低分组采用单纯肠内营养支持率高于高分组,肠内营养达80%目标喂养量时间、院感发生率、机械通气时间、重症监护时间均低于或短于高分组,肠内营养治疗7 d达标率高于高分组(均P<0.05),见表2。
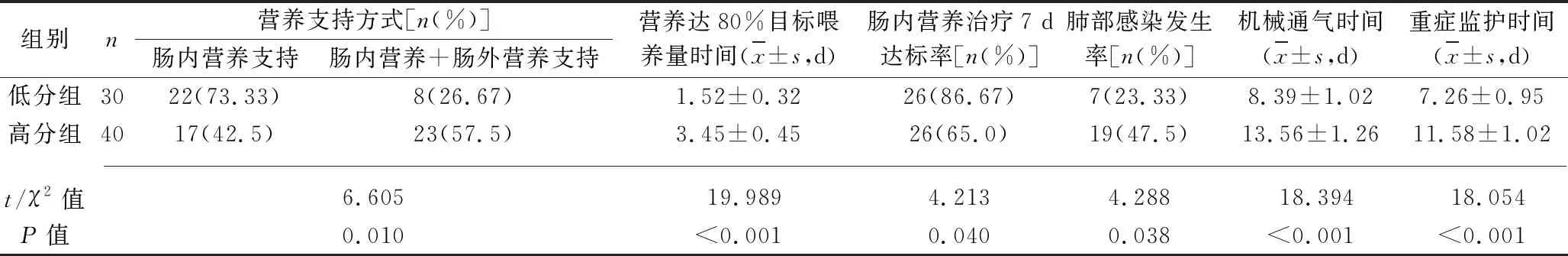
表2 两组患者营养支持情况及院感发生率等指标的比较
2.2 两组患者营养支持后营养学指标的比较 术后第1天,两组患者血清白蛋白、前清蛋白、转铁蛋白水平差异均无统计学意义(均P>0.05);术后第7天,两组患者血清白蛋白、前清蛋白均降低,转铁蛋白均升高,而低分组血清白蛋白、前清蛋白、转铁蛋白水平均高于高分组(均P<0.05),见表3。

表3 两组患者营养支持后营养学指标的比较(x±s)
2.3 两组患者预后的比较 低分组在术后1个月时恢复良好、中残、重残、植物生存、死亡分别为10例、10例、6例、2例、2例,高分组分别为6例、8例、12例、6例、8例,低分组预后优于高分组(z=-2.679,P=0.038)。
3 讨 论
脑出血术后患者由于手术创伤、麻醉和禁食等因素,机体发生严重的代谢紊乱,营养不良发生的风险较高,其可增加患者的病死率和病残率。因此,对患者进行营养风险评估,给予有效的营养支持治疗显得尤为重要。
目前临床上营养风险评估的方法较多,但均有各自的优缺点。营养风险筛查评估表是目前临床常用的营养风险评估工具,通过对患者的疾病严重程度、营养状态受损情况以及年龄评分后进行营养风险评估,并对总评分≥3分的营养不良或有营养风险者采取营养干预治疗[5-6],主要适用于住院患者的营养风险筛查,但对卧床等无法测量体重,或者合并水肿、腹水等因素影响体重测量,以及意识不清无法回答问题的患者,该工具的临床使用受到限制。主观全面评定是以详细的病史与临床检查为基础进行营养评估,不需要测量体重和检查生化指标,主要反映疾病状况,常用于评价慢性疾病或已存在营养不良的患者,但对急性营养不良的患者其评价效果不佳[7-8]。营养不良通用筛检工具根据体质指数分数、体重丧失分数、急性疾病影响分数,预测老年住院患者的死亡率和住院时间,主要用于无法测量体重的卧床老年患者的营养评估[9],但危重症患者由于沟通困难、镇静、昏迷等原因无法配合完成所有指标的测量,且测得数值并不能真实反映患者体重及体质指数。NUTRIC评分是根据患者年龄、序贯性器官功能衰竭评估(Sequential Organ Failure Assessment,SOFA)、急性生理学与慢性健康状况评分Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHEⅡ)、器官功能不全情况、入住ICU 前住院时间等方面对患者进行评分,综合了既往营养因素和疾病严重程度,对危重症患者的营养支持起到一定的指导作用[2]。
本研究中,患者的肠内营养治疗是在动态腹腔压力监测、胃残余量监测的双重指导下进行,根据患者具体情况及时调整输注速率,有利于患者安全平稳的达到目标输注量;当肠内营养供给热量不足时,则给予适量肠外营养支持。本研究发现,高分组单纯肠内营养治疗比例偏低,提示该营养支持方式无法给高分组患者提供足够热量,需要联合肠外营养支持,原因可能是高分组患者普遍存在胃肠黏膜水肿以及胃动力不足;但由于高分组患者大多存在血流动力学不稳定的情况,又在一定程度上限制了肠外营养的应用。本研究还发现高分组肠内营养达80%目标喂养量所需时间长于低分组,肠内营养治疗7 d达标率低于低分组(均P<0.05),这与NUTRIC评分越高,患者意识障碍越明显、不能自主进食,以及伴有消化道应激反应等有关。本研究结果显示,高分组手术后第7天时血清白蛋白、前清蛋白、转铁蛋白水平均低于低分组(均P<0.05),提示低NUTRIC评分者营养状况更易于纠正。有研究表明,NUTRIC评分中的APACHEⅡ评分、SOFA评分是目前应用最广泛的危重症评分表,其量化了疾病严重程度和预后,是预测患者病死率的重要指标,可用于预测危重症患者的临床结局[10-11]。研究发现,NUTRIC评分高的患者重症监护时间、机械通气时间更长,病死率更高[1,12-13],其术后并发症主要为呼吸机相关性肺炎,这与机械通气时间长、住神经重症监护病房时间长、肠内营养治疗等方面密切相关[14-15]。本研究也发现,低分组预后优于高分组(P<0.05),提示NUTRIC高分的患者预后不佳。
综上所述,NUTRIC评分高的基底节区脑出血危重患者术后营养状况相对较差,预后不佳,应给予重点关注,NUTRIC评分系统可优化基底节区脑出血危重患者术后营养状况的评估,或有助于指导肠内营养方案制定和改善患者预后。
