南美蟛蜞菊WtActin1基因克隆及表达稳定性分析
2020-02-22李红春肖雨沙王小兰宋莉英
李红春 肖雨沙 王小兰 宋莉英


摘要:【目的】克隆南美蟛蜞菊肌動蛋白基因(WtActin1),并进行生物信息学及表达稳定性分析,为南美蟛蜞菊耐热耐冷功能基因表达及调控研究提供可靠的内参基因。【方法】RACE克隆WtActin1基因,通过在线生物信息学分析软件对其氨基酸序列进行分析,并利用实时荧光定量PCR检测该基因在不同组织及温度胁迫下的表达情况。【结果】克隆获得的WtActin1基因cDNA全长1682 bp(GenBank登录号MN485900),其中5'非编码区(5'-UTR)170 bp,3'非编码区(3'-UTR)378 bp,开放阅读框(ORF)1134 bp,编码377个氨基酸残基。WtActin1蛋白分子量为41725.81 Da,理论等电点(pI)为5.31,不稳定性指数(II)为37.48,亲水性的平均值(GRAVY)为-0.166,为稳定的亲水性蛋白,无跨膜结构域和无信号肽,主要存在于细胞质中,具有Actin蛋白家族的典型特征结构,其二级结构主要由α-螺旋、β-转角、延伸链和无规则卷曲组成,三级结构同源模型为嵌合肌动(3ci5.1.A),与莴苣、橡胶草和洋蓟的同源蛋白三级结构高度相似。WtActin1基因与其他植物Actin基因核苷酸序列相似性在86.4%以上,其推导氨基酸序列相似性在94.0%以上。从基于Actin氨基酸序列相似性构建的系统发育进化树可看出,WtActin1与同为菊科的莴苣LsActin7亲缘关系最近,与传统分类学相吻合,其次是菊科的橡胶草TkActin1和锦葵科的棉花GhActin。WtActin1基因在南美蟛蜞菊根、茎、叶和花中的表达量均无显著差异(P>0.05,下同),且在高、低温胁迫下与正常温度处理的表达量也均无显著差异。【结论】WtAtin1基因属于Actin基因家族成员,在不同组织及温度胁迫下均能稳定表达,可作为内参基因用于南美蟛蜞菊耐热耐冷功能基因研究。
关键词: 南美蟛蜞菊;肌动蛋白基因(Actin);内参基因;基因克隆;表达稳定性;温度胁迫
中图分类号: S451 文献标志码: A 文章编号:2095-1191(2020)11-2626-10
Cloning and expression stability analysis of WtActin1
gene from Wedelia trilobata
LI Hong-chun, XIAO Yu-sha, WANG Xiao-lan, SONG Li-ying*
(College of Life Sciences, Guangzhou University, Guangzhou 510006, China)
Abstract:【Objective】In this study,actin gene WtActin1 was cloned from Wedelia trilobata and its bioinformatics and expression stability were analyzed to provide an appropriate reference gene for the expression and regulation of functional genes with cold and heat resistance in W. trilobata. 【Method】The WtActin gene from W. trilobata was cloned by RACE,its amino acid sequence was analyzed by bioinformatics software,and the expression of WtActin gene in different tissues and under temperature stress was detected by real-time quantitative PCR. 【Result】The full-length cDNA of WtActin1 gene was 1682 bp(GenBank accession number:MN485900),contained a 1134 bp open reading frame encoding(ORF) 377 amino acids residues,with 170 bp in the 5' non-coding region(5'-UTR) and 378 bp in the 3'-UTR. WtActin1 protein had a molecular weight of 41725.81 Da and a theoretical isoelectric point(pI) of 5.31,instability index(II) of 37.48,average hydrophilicity(GRAVY) of -0.166. It was a stable hydrophilic protein without transmembrane domain and signal peptide. It mainly existed in cytoplasm,and had typical characteristic structure of Actin gene family. Its secondary structure was mainly composed of α-helix,β-turn,extended chain and irregular coil,the three-level structure homology model was chimeric myokinesis(3ci5.1.A),which was highly similar to that of Lactuca sativa,Taraxacum kok-saghyz and Cynara cardunculus var. scolymus. Homology comparison with other plant Actin nucleotide sequences showed that it shared over 86.4% nucleotide sequence identity and 94.0% amino acid sequence identity with Actin in other plants. Based on phylogenetic tree of Actin amino acid sequence similaruty, WtActin1 was closely related to L.sativa(LsActin7) of Asteraceae,which was consistent with traditional taxonomy,followed by T. kok-saghyz(TkActin1) of Asteraceae and Gossypium hirsutum(GhActin) of Malvaceae. The expression level of WtActin1 gene was stable in root, stem, leaf and flower of W. trilobata and there was no significant difference among them(P>0.05, the same below),and there was no significant difference between high or low temperature stress and normal temperature. 【Conclusion】The WtActin1 gene cloned in this study is a member of Actin gene family and could be stably expressed in different tissues and under temperature stress. It can be used as an internal reference gene for the study of heat and cold tolerance genes of W. trilobata.
Key words: Wedelia trilobata; actin gene(Actin); internal reference gene; gene cloning; expression analysis; temperature stress
Foundation item: Guangdong Natural Science Foundation(2018A030313478); Guangzhou Science and Techno-logy Plan Project(201707010257)
0 引言
【研究意义】南美蟛蜞菊(Wedelia trilobata)又称三裂叶蟛蜞菊、穿地龙或地锦花,为菊科(Asteraceae)泽菊属(Wedelia)的多年生草本植物,原产于南美洲及中美洲地区,现广泛分布于东南亚和太平洋许多国家和地区,被世界自然保护联盟(IUCN)列为世界最有害的100种外来入侵种之一(International Union for Conservation of Nature,2001;吴彦琼等,2005)。据研究报道,南美蟛蜞菊对高温、高光等逆境具有较强的适应性(宋莉英等,2009,2017),可能蕴藏着丰富的抗逆基因。开展南美蟛蜞菊抗逆基因克隆和抗逆基因表达模式研究有利于从分子水平上揭示其生物学功能及入侵机理,而研究其抗逆基因表达模式通常需要一个稳定表达的内参基因进行标定。已有研究证实,多数植物肌动蛋白基因(Actin)具有高度的保守性(刘曦等,2010),因此,克隆获得南美蟛蜞菊Actin基因,评估其作为内参基因的可靠性,对开展南美蟛蜞菊重要功能基因挖掘及表达调控研究具有重要意义。【前人研究进展】近年来,南美蟛蜞菊的研究主要集中在繁殖特性(杨东娟和朱慧,2008;Si et al.,2014)、化感作用(Qiang et al.,2011;柯展鸿等,2014)及环境因子胁迫响应(Qi et al.,2014 ;牛雨欣等,2019)等方面,而关于南美蟛蜞菊内参基因的相关研究鲜见报道。目前,植物中较常见的内参基因包括Actin基因、18S rRNA、28S rRNA、甘油醛-3-磷酸脱氢酶(GAPDH)基因和肽链延伸因子(ef1-α)基因等(Zhang et al.,2017)。根据植物材料、组织和处理条件的不同,所选的内参基因有所不同。由于Actin基因在植物不同组织器官内表达水平高且相对稳定,故被广泛地用作植物功能基因表达分析的内参基因(陈颖等,2003)。至今,已成功从木薯(Manihot esculenta Crantz)(许娟和罗兴录,2011)、厚藤(Ipomoea pescaprae)(郭艳等,2016)、山药(Dioscorea oppositifolia)(龚明霞等,2016)、番杏(Tetragonia tetragonioides)(叶玉妍等,2018)等多种植物中克隆获得Actin基因,且研究证实不同植物Actin基因编码的氨基酸具有高度保守性(刘曦等,2010)。燕麦(Avena sativa)Actin蛋白与其他植物Actin蛋白的氨基酸序列相似性在93%以上(琚泽亮等,2016);马缨杜鹃(Rhododendron delavayi)Actin蛋白与其他植物Actin蛋白的氨基酸序列相似性在97%以上(孙威等,2018)。【本研究切入点】Actin是许多植物功能基因表达检测的理想内参基因,但至今鲜见有关南美蟛蜞菊Actin基因克隆及表达分析的研究报道。【拟解决的关键问题】利用RACE克隆南美蟛蜞菊Actin基因(WtActin1),对其进行生物信息学分析,并利用实时荧光定量PCR检测其在不同组织及温度胁迫下的表达稳定性,为南美蟛蜞菊耐热耐冷功能基因表达及调控研究提供可靠内参基因。
1 材料与方法
1. 1 试验材料
南美蟛蜞菊采自广州大学校园。总RNA提取试剂盒(MiniBEST Plant RNA Extraction Kit)、反转录试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser和PrimeScriptTM II 1st Strand cDNA Synthesis Kit)、质粒提取试剂盒(MiniBEST Plasmid Purification Kit Ver.4.0)、TB Green? Premix Ex TaqTM II荧光定量PCR试剂盒、克隆载体pMD19-T、TDT酶、PrimeSTAR Max高保真DNA聚合酶及DNA凝胶回收试剂盒均购自宝生物工程(大连)有限公司(TaKaRa)。大肠杆菌DH5α感受态细胞为广州大学生命科学学院实验室制备保存。主要仪器设备:人工气候箱(RXZ-500E-LED智能型,宁波江南仪器厂)、PCR仪(Bio-Rad,美国)、电泳仪(北京君意东方电泳设备有限公司)、分光光度计(Biotek,美国)、凝胶成像分析系统(上海比朗仪器制造有限公司)、实时荧光定量PCR仪(ABI 7000,美国)。
1. 2 试验方法
1. 2. 1 样品采集及胁迫处理 对自然生长的南美蟛蜞菊带芽茎段进行扦插繁殖,采集成熟期植株的根、茎、叶和花等4种组织。此外,选取生长健康、长势一致的植株分别进行低温(4 ℃)和高温(42 ℃)胁迫处理,并于胁迫0、1、3、6、12和24 h时采集其叶片,以正常温度下生长的植株为对照。以上样品均设3次重复,采集后立即用液氮处理,于-80 ℃冰箱保存备用。
1. 2. 2 总RNA提取 采用植物总RNA提取试剂盒提取南美蟛蜞菊总RNA。使用核酸蛋白分析仪测定总RNA浓度和纯度,并利用1%琼脂糖凝胶电泳检测其提取质量和降解情况,将符合要求的总RNA保存于-80 ℃冰箱备用。
1. 2. 3 引物设计及合成 根据前期南美蟛蜞菊转录组数据,筛选出Actin基因的部分序列,设计中间片段引物(WAIF/WAIR)进行扩增,并进行序列比对,以确定目的基因的中间片段。根据基因中間片段序列,设计3条5'-RACE特异性引物和2条3'-RACE特异性引物(表1)用于基因克隆和实时荧光定量PCR检测。引物委托生工生物工程(上海)股份有限公司合成。
2. 4 WtActin1蛋白亚细胞定位和磷酸化位点预测结果
TargetP 1.1 Server预测结果显示,WtActin1蛋白主要分布于细胞质中,与PSORT Ⅱ预测结果一致,推测其定位于细胞质中。磷酸化位点预测结果显示,WtActin1蛋白共有35个磷酸化位点,包括17个丝氨酸激酶磷酸化位点、10个苏氨酸激酶磷酸化位点和8个酪氨酸激酶酸磷酸化位点(图4),磷酸化位点主要以丝氨酸的形式存在,故推测WtActin1蛋白是以丝氨酸为主、苏氨酸为辅的磷酸化修饰参与信号转导调控。
2. 5 WtActin1蛋白结构预测结果
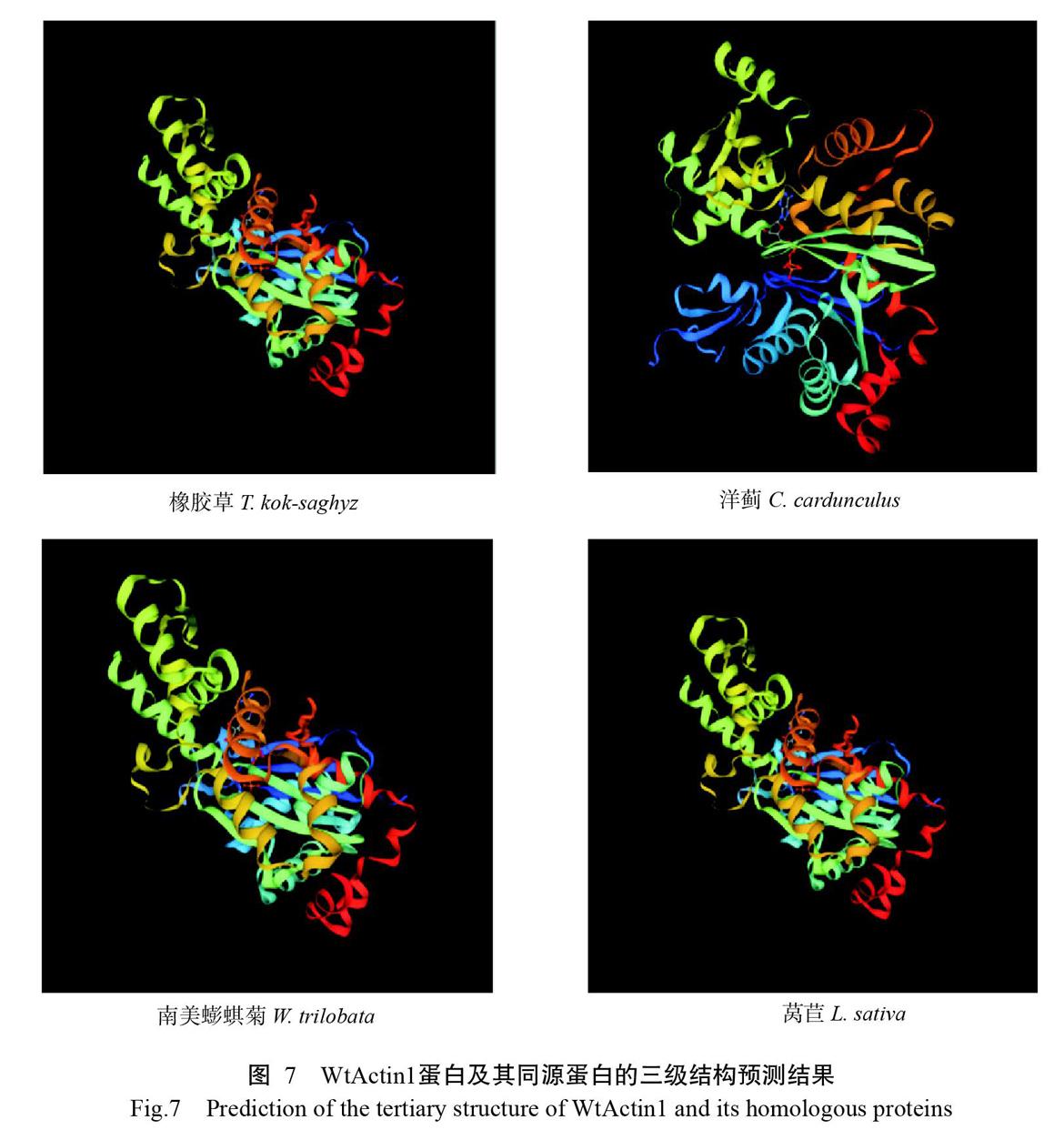
WtActin1蛋白含有多个Actin保守区域,且含有Actin家族典型的结构域NBD_sugar-kinase_HSP70_ actin(图5),说明其为Actin蛋白家族成员。WtActin1蛋白二级结构主要由α-螺旋、β-转角、延伸链和无规则卷曲组成,分别占36.07%、22.55%、6.90%和34.48%(图6)。WtActin1蛋白二级结构预测结果与其三级结构预测结果相互印证。该蛋白三级结构同源模型(图7)为嵌合肌动(3ci5.1.A),氨基酸序列相似性達90.9%,且与莴苣(Lactuca sativa)、橡胶草(Taraxacum kok-saghyz)和洋蓟(Cynara cardunculus)的同源蛋白三级结构高度相似。
2. 6 WtActin1基因序列同源性分析及系统发育进化树
将WtActin1基因核苷酸序列及其推导氨基酸序列在NCBI上进行同源比对分析,结果显示,WtActin1基因核苷酸序列与莴苣LsActin7基因相似性最高,为92.8%;其次是甜叶菊(Stevia rebaudiana)SrActin基因和向日葵(Helianthus annuus)HaActin基因,均达91.0%;与其他植物Actin基因核苷酸序列的相似性也在86.4%以上。WtActin1蛋白与莴苣Actin蛋白的氨基酸序列相似性最高,达100.0%;其次是洋蓟和薇甘菊(Mikania micrantha),分别为99.7%和99.4%;与其他植物Actin氨基酸序列的相似性也在94.0%以上。氨基酸序列多重比对分析结果显示,9种植物的Actin均有366个氨基酸位于保守区域,非保守氨基酸仅有11个(图8),说明植物Actin在进化过程中十分保守。
基于Actin氨基酸序列相似性构建的系统发育进化树(图9)显示,WtActin1与同为菊科的莴苣LsActin7亲缘关系最近,与传统分类学相吻合,其次是菊科的橡胶草TkActin1和锦葵科的棉花(Gossy-pium hirsutum)GhActin,亲缘关系最远的是茄科的番茄(Solanum lycopersicum)SlActin7和豆科的木豆(Cajanus cajan)CcActin7。
2. 7 WtActin1基因表达分析结果
从实时荧光定量PCR熔解曲线(图10-A~图10-C)可看出,WtActin1基因在正常温度、低温和高温处理下,实时荧光定量PCR熔解曲线均为单一的信号峰,无引物二聚体和非特异性扩增,表明引物设计特异性强。制作的标准曲线回归系数(R2)为0.99557(图10-D),表明稀释倍数与Ct值呈良好的线性关系,扩增效率为94.04%,说明引物设计合理,符合实时荧光定量PCR的要求,试验结果可靠。
实时荧光定量PCR检测结果(图11-A)显示,WtActin1基因在根、茎、叶和花中均有表达,且表达量均无显著差异(P>0.05,下同),说明该基因表达不具有组织特异性。在高温和低温胁迫处理下,WtActin1基因在叶片中的表达量略有波动,但均无显著差异(图11-B),表明WtActin1基因的表达受温度影响较小,可用作温度应答功能基因研究的内参基因。
3 讨论
Actin是真核细胞中普遍存在的一种古老蛋白,是细胞骨架微丝的主要成分,参与真核细胞内许多重要的生理化学活动,如细胞分裂、运动、迁移、形态维持、信号传导和物质运输等(Wen et al.,2014)。本研究从南美蟛蜞菊中克隆得到1个Actin家族基因(WtActin1),其cDNA全长为1682 bp,包含1个1134 bp的ORF,编码377个氨基酸残基,与GenBank已公布的其他植物Actin基因核苷酸序列相似性均在86.4%以上,推导氨基酸序列相似性均在94.0%以上,表明植物Actin基因无论核苷酸序列还是其推导氨基酸序列均具有高度的保守性(陈鹏飞等,2009;王舟等,2010)。此外,WtActin1蛋白含有Actin家族典型的结构域,且与莴苣、橡胶树和洋蓟Actin蛋白三级结构高度相似,进一步证明本研究克隆获得的WtActin1基因是Actin基因家族成员。从基于Actin氨基酸序列相似性构建的系统发育进化树也可看出,WtActin1与同为菊科的莴苣LsActin7亲缘关系最近,与传统分类学相吻合,其次是菊科的橡胶草TkActin1和锦葵科的棉花GhActin,故推测这些蛋白生物学功能相似。
南美蟛蜞菊作为一种外来入侵植物,短期内在我国华南地区泛滥成灾,可能蕴含着丰富的抗逆基因,在研究其抗逆基因的表达模式及调控机制时,选择合适的内参基因是实时荧光定量PCR检测数据准确性的必要条件。Actin基因同源性和保守性均较高,在高等植物中常被作为标准基因研究未知基因(Mccurdy et al.,2001)。虽然植物Actin基因在核苷酸序列上高度保守,但在不同组织中的表达存在一定差异。拟南芥(Arabidopsis thaliana)AtACT1基因在成熟花粉、生长中的的花粉管、胚珠等不同组织中的表达水平具有显著差异(Kandasamy et al.,2002)。本研究结果显示,WtActin1基因在南美蟛蜞菊的根、茎、叶和花中均能稳定表达,且表达水平基本一致,无明显变化,与太子参(Pseudostellaria heterophylla)PhACT2基因在不同组织中稳定表达的结果(丁铃等,2017)一致。基于本研究实时荧光定量PCR检测结果推测WtActin1为组成型表达基因,可作为南美蟛蜞菊功能基因组织特异性表达研究的可靠内参基因。大量研究表明,不同植物的Actin基因在不同胁迫条件下表达稳定性也不同。景宁木兰(Magnolia sinostellata)Actin基因在热胁迫下表达不稳定(王倩颖等,2019),但狗尾草(Setaria viridis)Actin基因在干旱和盐胁迫下表达均十分稳定(张丽丽等,2019)。本研究对不同温度胁迫条件下WtActin1基因的表达稳定性进行检测,结果显示,WtActin1基因表达受温度影响较小,表达较稳定,与花椰菜(Brassica oleracea)BobACT基因在温度胁迫下表达较稳定的研究结果(林珲等,2019)一致。可见,WtActin1基因在不同组织及温度胁迫下均能稳定表达,适合作为内参基因用于南美蟛蜞菊耐热耐冷功能基因功能研究。该结论填补了南美蟛蜞菊内参基因研究领域的空白,丰富了高等植物Actin基因数据库,为进一步研究南美蟛蜞菊对温度耐受性相关基因的表达模式及调控机理的研究提供可靠内参基因。今后还应深入研究南美蟛蜞菊GAPDH、ef1-α和18S RNA等内参基因在不同胁迫处理下的表达稳定性,以丰富南美蟛蜞菊的内参基因库,提高重要功能基因表达的稳定性、重复性和准确性。
4 结论
WtAtin1基因是Actin基因家族成员,在不同组织及受温度胁迫下均能稳定表达,可作为内参基因用于南美蟛蜞菊耐热耐冷功能基因研究。
参考文献:
陈鹏飞,刘雪梅,宋福南,刘兴舜,刘霓,金微微,刘威. 2009. 白桦肌动蛋白(Actin)基因全长cDNA克隆与序列分析[J]. 植物研究,29(3):339-345. [Chen P F,Liu X M,Song F N,Liu X S,Liu N,Jin W W,Liu W. 2009. Clo-ning and sequence analysis of full-length cDNA of Actin gene from birch(Betula platyphylla Suk.)[J]. Bulletin of Botanical Research,29(3):339-345.]
陈颖,王刚,赵俊霞. 2003. 高等植物体内的肌动蛋白[J]. 生物学通报,38(1):13-15. [Chen Y,Wang G,Zhao J X. 2003. Actin in higher plants[J]. Bulletin of Biology,38(1):13-15.]
丁铃,江维克,周涛,龙登凯,郑伟,李军,肖承鸿. 2017. 太子参肌动蛋白基因PhACT2的全长cDNA克隆与生物信息学分析[J]. 分子植物育种,15(2):460-467. [Ding L,Jiang W K,Zhou T,Long D K,Zheng W,Li J,Xiao C H. 2017. Cloning and bioinformatic analysis of full-length cDNA of PhACT2 from Pseudostellaria heterophylla[J]. Molecular Plant Breeding,15(2):460-467.]
龚明霞,周芸伊,王爱勤,罗海玲,何龙飞. 2016. 山药Actin基因片段的克隆及表达分析[J]. 生物技术通报,32(7):73-80. [Gong M X,Zhou Y Y,Wang A Q,Luo H L,He L F. 2016. Cloning and expression analysis of Actin gene fragment from Dioscorea opposite[J]. Biotechnology Bu-lletin,32(7):73-80.]
郭艳,张美,夏快飞,简曙光,陈建通. 2016. 厚藤Actin基因片段的克隆及序列分析[J]. 氨基酸和生物资源,38(3):59-62. [Guo Y,Zhang M,Xia K F,Jian S G,Chen J T. 2016. Cloning and sequence analysis of Actin gene fragment from Ipomoea pea-caprae L.[J]. Amino Acid and Biotic Resources,38(3):59-62.]
琚泽亮,赵桂琴,周向睿. 2016. 燕麦Actin基因片段的克隆及序列分析[J]. 甘肅农业大学学报,51(3):37-42. [Ju Z L,Zhao G Q,Zhou X R. 2016. Cloning and sequence analysis of Actin gene fragment from Avena sativa[J]. Journal of Gansu Agricultural University,51(3):37-42.]
柯展鸿,陈雁飞,惠苗,宋莉英. 2014. 南美蟛蜞菊和蟛蜞菊化感作用的比较研究[J]. 华南师范大学学报(自然科学版),46(1):83-88. [Ke Z H,Chen Y F,Hui M,Song L Y. 2014. Comparative study on allelopathic effects of Wedelia trilobata and Wedelia chinensis[J]. Journal of South China Normal University(Natural Science Edition),46(1):83-88.]
林珲,朱海生,温庆放,黄丽芳. 2019. 花椰菜BobACT基因的克隆及其作为内参基因的研究[J]. 植物遗传资源学报,20(3):781-789. [Lin H,Zhu H S,Wen Q F,Huang L F. 2019. Molecular cloning of Actin gene and study on this gene as reference gene in cauliflower(Brassica oleracea var. botrytis L.)[J]. Journal of Plant Genetic Resources,20(3):781-789.]
刘曦,张少斌,汪澈. 2010. 植物肌动蛋白功能的研究进展[J]. 生物技术通报,26(3):13-16. [Liu X,Zhang S B,Wang C. 2010. Research progress of plant actin function[J]. Biotechnology Bulletin,26(3):13-16.]
牛雨欣,宁磊,董必成,罗芳丽,李红丽,于飞海. 2019. 异质光照环境下克隆整合对南美蟛蜞菊和蟛蜞菊种间关系的影响[J]. 生态学报,39(22):8585-8594. [Niu Y X,Ning L,Dong B C,Luo F L,Li H L,Yu F H. 2019. Effects of clonal integration on interspecific interactions between Wedelia trilobata and W. chinensis in heterogeneous light environments[J]. Acta Ecologica Sinica,39(22):8585-8594.]
宋莉英,刘昭弟,李晓娜,肖雨沙,陈秀清,林益坤. 2017. 三裂叶蟛蜞菊、蟛蜞菊及其杂交种对模拟极端高温的生理生态响应[J]. 生态环境学报,26(2):183-188. [Song L Y,Liu Z D,Li X N,Xiao Y S,Chen X Q,Lin Y K. 2017. Eco-physiological responses of Wedelia trilobata,W. chinensis and their hybrid to simulated extreme high tempera-ture[J]. Ecology and Environmental Sciences,26(2):183-188.]
宋莉英,孙兰兰,舒展,李伟华,彭长连. 2009. 夏季高光下入侵植物三裂叶蟛蜞菊叶片变红的生理功能[J]. 生物多样性,17(2):188-194. [Song L Y,Sun L L,Shu Z,Li W H,Peng C L. 2009. Physiological functions of the red leaves of Wedelia trilobata induced by high irradiance in summer[J]. Biodiversity Science,17(2):188-194.]
孙威,林建,申欢,李欲轲,马玲,乙引. 2018. 马缨杜鹃Actin基因片段的克隆及序列分析[J]. 贵州师范大学学报(自然科学版),36(5):69-73. [Sun W,Lin J,Shen H,Li Y K,Ma L,Yi Y. 2018. Cloning and sequence analysis of Actin gene fragment from Rhododendron delavayi[J]. Journal of Guizhou Normal University(Natural Sciences),36(5):69-73.]
王倩颖,常鹏杰,申亚梅,张超,董彬,时宝柱. 2019. 景宁木兰热胁迫下实时荧光定量PCR内参基因的筛选[J]. 浙江农林大学学报,36(5):935-942. [Wang Q Y,Chang P J,Shen Y M,Zhang C,Dong B,Shi B Z. 2019. Reference genes for quantitative PCR in Magnolia sinostellata with heat stress[J]. Journal of Zhejiang A & F University,36(5):935-942.]
王舟,宗俊勤,宣繼萍,郭爱桂,刘建秀. 2010. 结缕草肌动蛋白基因全长cDNA的克隆及序列分析[J]. 草业学报,19(6):154-163. [Wang Z,Zong J Q,Xuan J P,Guo A G,Liu J X. 2010. Cloning and sequence analysis of full length cDNA of an Actin gene from Zoysia japonica[J]. Acta Prataculturae Sinica,19(6):154-163.]
吴彦琼,胡玉佳,廖富林. 2005. 从引进到潜在入侵的植物──南美蟛蜞菊[J]. 广西植物,25(5):413-418. [Wu Y Q,Hu Y J,Liao F L. 2005. Wedelia trilobata─A species from introduced to potential invasive[J]. Guihaia,25(5):413-418.]
许娟,罗兴录. 2011. 木薯Actin基因片段的克隆及序列分析[J]. 生物技术通报,27(6):65-70. [Xu J,Luo X L. 2011. Cloning and sequence analysis of Actin gene fragment from cassava[J]. Biotechnology Bulletin,27(6):65-70.]
杨东娟,朱慧. 2008. 入侵植物南美蟛蜞菊克隆繁殖特性初探[J]. 安徽农业科学,36(15):6469-6470. [Yang D J,Zhu H. 2018. Primary study on clonal reproductive characteristics of the invasive plant─Wedelia trilobata L.[J]. Journal of Anhui Agricultural Sciences,36(15):6469-6470.]
叶玉妍,梁海峰,杨礼香. 2018. 番杏Actin基因片段的克隆及生物信息学分析[J]. 生物资源,40(5):405-411. [Ye Y Y,Liang H F,Yang L X. 2018. Cloning and bioinforma-tics analysis of Actin gene fragment from Tetragonia tetragonioides[J]. Biotic Resources,40(5):405-411.]
张丽丽,赵辉,郭静,夏启玉,贺萍萍,霍姗姗,屈静,符冬妹,郭安平. 2019. 模式植物狗尾草响应不同干旱及盐胁迫表达的内参基因Actin及其应用[J]. 热带作物学报,40(12):2418-2425. [Zhang L L,Zhao H,Guo J,Xia Q Y,He P P,Huo S S,Qu J,Fu D M,Guo A P. 2019. The internal reference gene Actin of Setaria viridis and its application in response to different drought and salt stress[J]. Chinese Journal of Tropical Crops,40(12):2418-2425.]
International Union for Conservation of Nature. 2001. 100 of the worlds worst invasive alien species[M]. Auckland:Invasive Species Specialist Group.
Kandasamy,McKinney,Meagher R B. 2002. Functional nonequivalency of actin isovariants in Arabidopsis[J]. Molecular Biology of the Cell,13(1):251-261.
Mccurdy D W,Kovar D R,Staiger C J. 2001. Actin and actin-binding proteins in higher plants[J]. Protoplasma,215(1):89-104.
Qi S S,Dai Z C,Miao S L. 2014. Light limitation and litter of an invasive clonal plant,Wedelia trilobata,inhibit its seedling recruitment[J]. Annals of Botany,114(2):425-433.
Qiang Y,Du D L,Chen Y J. 2011. Ent-Kaurane diterpenes and further constituents from Wedelia trilobata[J]. Helvetica Chimica Acta,94(5):817-823.
Si C C,Dai Z C,Lin Y. 2014. Local adaptation and phenoty-pic plasticity both occurred in Wedelia trilobata invasion across a tropical island[J]. Biological Invasions,16(11):2323-2337.
Wen S S,He D W,Liao C M,Li J,Wen G Q,Liu X H. 2014. Cloning and sequence analysis of an Actin gene in aloe[J]. Genetics and Molecular Research,13(3):4949-4955.
Zhang L C,Liu L,Cheng P,Shen H G,Rong B,Liu W,Yu G H. 2017. Identification and validation of reference genes for RT-qPCR analysis in banana(Musa spp.) under Fusarium wilt resistance induction conditions[J]. Journal of Phytopathology,165(11-12):746-754.
(責任编辑 陈 燕)
收稿日期:2020-04-26
基金项目:广东省自然科学基金项目(2018A030313478);广州市科技计划项目(201707010257)
作者简介:*为通讯作者,宋莉英(1978-),博士,副研究员,主要从事入侵植物生理生态学研究工作,E-mail:liying_song@126.com。李红春(1995-),研究方向为植物资源保护,E-mail:18054216733@sina.cn
