叶面喷施外源ABA对胡椒抗寒生理生化及ABA信号转导相关基因的影响
2020-02-22伍宝朵崔鑫胡丽松范睿朱春梅杨建峰郝朝运
伍宝朵 崔鑫 胡丽松 范睿 朱春梅 杨建峰 郝朝运


摘要:【目的】篩选出能提高胡椒抗寒性的脱落酸(ABA)适宜浓度,明确低温胁迫条件下外施适宜浓度ABA对胡椒叶片ABA信号转导相关基因SnRK2和PYL表达的影响,为生产上提高胡椒抗寒技术及揭示ABA信号在胡椒抗寒中的作用机理提供依据。【方法】以热引1号胡椒为试验材料,通过叶面喷施0(CK)、25(T1)、50(T2)、75(T3)、100(T4)mg/L ABA及4 ℃低温胁迫处理,测定各处理胡椒叶片叶绿素荧光参数、抗氧化酶活性(POD、CAT和SOD)、H2O2和MDA含量。在筛选出适宜ABA喷施浓度的基础上,进一步运用实时荧光定量PCR分析ABA信号转导相关基因的表达情况。【结果】低温胁迫后,不同浓度ABA处理的胡椒POD、CAT和SOD活性与CK相比均显著上升(P<0.05,下同),其中T2处理的POD活性升高最显著,T3处理的CAT和SOD活性升高最显著;随着ABA处理浓度的升高,H2O2和MDA含量呈先下降后上升的变化趋势,以T3处理含量最低,即一定浓度外源ABA处理对胡椒抗寒生理发挥积极作用。低温胁迫0 d时,不同ABA浓度处理的胡椒Fv/Fm和Fv/Fo无显著变化;低温胁迫4d时,其Fv/Fm和Fv/Fo均显著降低,但T3处理缓解Fv/Fm和Fv/Fo下降效果显著,即ABA预处理能够在一定程度上缓解低温对胡椒光系统潜在活性的抑制。低温胁迫0 d时,不同ABA浓度处理胡椒的qP和Yield无显著变化,但qN随着ABA处理浓度的升高明显下降,即正常生长条件下,外施不同浓度ABA对胡椒叶片的qP和Yield无影响,但会减弱胡椒的光保护能力;低温胁迫4 d时,不同ABA浓度处理的胡椒叶片qP、qN和Yield均有不同程度的下降,随着ABA处理浓度的升高,qN呈现下降、上升再下降的变化趋势,qP呈先下降后上升的变化趋势,T3处理成为转折点,即在低温胁迫下外源ABA能够提高胡椒的光保护能力,其中T3处理效果相对较好。低温胁迫条件下,ABA预处理可诱导ABA信号转导相关基因SnRK2和PYL提前并高表达。【结论】外源ABA通过提高胡椒抗氧化酶活性、降低H2O2和MDA含量及缓解低温对其光系统活性的伤害,从而提高胡椒抵抗低温胁迫的能力。外源ABA还能诱导胡椒ABA信号转导相关基因表达,启动和引发植株固有抗冻性基因的表达,进而提高其耐冻性。
关键词: 胡椒;抗寒性;低温胁迫;ABA;生理生化;ABA信号转导相关基因
中图分类号: S311 文献标志码: A 文章编号:2095-1191(2020)11-2764-09
Effects of exogenous foliar spraying ABA on genes related to cold resistance physiology, biochemistry and ABA signal transduction of black pepper
WU Bao-duo1, 2, 3, CUI Xin4, HU Li-song1, 2, 3, FAN Rui1, 2, 3, ZHU Chun-mei4,
YANG Jian-feng1, 2, 3, HAO Chao-yun1, 2, 3*
(1Spice and Beverage Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wanning, Hainan 571533, China; 2Ministry of Agriculture and Rural Affairs Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Wanning, Hainan 571533, China; 3Hainan Provincial Key Laboratory of Genetic Improvement and Quality Regulation for Tropical Spice and Beverage Crops, Wanning, Hainan 571533, China; 4Tropical Crops College, Yunnan Agricultural University, Puer, Yunnan 665000, China)
Abstract:【Objective】The optimal abscisic acid(ABA) concentration to improve the cold resistance for black pepper was screened,and the expression changes of SnRK2 and PYL genes of ABA signal transduction related genes in black pepper leaves under low temperature stress were clarified, which could provide basis for further research on the cold resistance mechanism of black pepper and function of ABA signal in cold resistance of black pepper. 【Method】Piper nigrum cv. Reyin1 leaves were sprayed with 0(CK), 25(T1), 50(T2), 75(T3), 100(T4) mg/L ABA. After 4 ℃ low temperature stress, detected the chlorophyll fluorescence parameters, antioxidant enzyme activities(POD, CAT and SOD), H2O2 and MDA content. Base on the suitable ABA concentration, the expression of ABA transduction related genes was further analyzed by real-time fluorescence quantitative PCR. 【Result】The POD, CAT, SOD activities of black pepper were significantly increased under low temperature stress compared with CK(P<0.05, the same below). Furthermore, the POD activity increased the most in T2 treatment, and the CAT and SOD activities in T3 treatment increased the most. With the increase of ABA treatment concentration, the contents of H2O2 and MDA first decreased and then increased. And the value was the lowest in T3 treatment. The results declared that certain concentration of exogenous ABA treatment played a positive role in black pepper resistant to cold stress. Fv/Fm and Fv/Fo values treated by different ABA concentrations did not change significantly under low temperature stress of 0 d, while the values decreased significantly under low temperature stress of 4 d. However, T3 treatment had a significant effect in alleviating the decline of Fv/Fm and Fv/Fo values. The results indicated that ABA pretreated black pepper could alleviate the inhibition on the light system potential activity. Under low temperature stress of 0 d, the qP and yield values treated with different ABA concentrations did not change significantly, but the qN value decreased significantly with the increase of ABA concentration. It showed that different ABA concentrations had no effect on the qP and Yield values of black pepper under normal growth conditions, but the light protection ability was weakened. Under low temperature stress of 4 d, the qP, qN and Yield value were also decreased. With the increase of concentration of ABA treatment, qN value presented a trend of decreased, increased and then decreased, and qP value showed a trend of decreased and then increased. The turning point was T3 treatment. These results showed that exoge-nous ABA under low temperature could improve the light protection ability of black pepper, and T3 treatment performed the best. Under low temperature stress, ABA pretreatment could induce the early and high expression of SnRK2 and PYL genes. 【Conclusion】Exogenous ABA enhances pepper resistance to low-temperature stress moths by increasing pepper antioxidant enzyme activity, reducing H2O2 and MDA contents, and alleviating the damage of low temperature to its light system activity. The exogenous ABA can also induce the expression of pepper ABA signal transduction related genes, ini-tiate and trigger the expression of plant inherent antifreeze genes, and then improve its freezing resistance.
Key words: black pepper; cold resistance; low temperature stress; ABA; physiology and biochemistry; ABA signal transduction related genes
Foundation item: Hainan Natural Science Foundation(320QN346); Basic Scientific Research Project of Chinese Academy of Tropical Agricultural Sciences(1630142017010)
0 引言
【研究意义】胡椒(Piper nigrum L.)原产印度,是世界上最重要的香辛料作物之一,具有较高的经济价值。在我国,胡椒主要分布在海南、云南、广东、广西和福建等省(区)。据统计,2018年海南胡椒种植面积约2.63万ha,年产量超过4万t,占全国90%以上。随着食品加工业及医药工业的发展,胡椒的食用和药用价值不断被深化拓展,市场需求量也日益增长。我国胡椒长期依靠进口满足内需,供需矛盾突出,产业发展空间大。近年来,云南省大力发展胡椒产业,胡椒种植面积发展迅速(王灿等,2015;张春林等,2018)。我国主栽胡椒品种热引1号胡椒属于低温敏感品种,遭受寒害会出现掉叶、断枝现象,而热区频发的寒流等极端气候给胡椒生产造成严重影响(萧自位等,2017;伍宝朵等,2018b)。但胡椒是经济效益较高的热带经济作物,将种植面积扩大到高纬度和高海拔地区可促进农民脱贫致富。因此,加强胡椒抗寒研究对其高产稳产及产业规模扩大具有重要意义。【前人研究进展】脱落酸(Abscisic acid,ABA)是植物在逆境环境中生成的重要信号物质之一,被广泛称为胁迫激素或逆境激素,是诱导植物体内抗逆基因表达的第一信使,在调节植物体内物质平衡和诱导胁迫抗性方面发挥重要作用,在感受低温胁迫信号及提高植物抗寒性中也起着重要作用(李艳军,2005),即筛选适宜胡椒的ABA喷施浓度可为生产上提高胡椒抗寒性提供参考。田丹青等(2010)通过以50 mg/L ABA预处理低温胁迫的蝴蝶兰发现,外施ABA可提高蝴蝶兰叶片抗氧化酶活性,减少膜脂过氧化产物积累,降低细胞膜透性,从而减轻低温伤害。尹松松等(2016)筛选出适宜番茄抗冷性增强的ABA浓度为200 μL/mL,并指出ABA预处理可增加胁迫叶片内脯氨酸、可溶性糖和可溶性蛋白含量,促进冷胁迫相关基因(SLCMYB1和LENLP4)的表达。此外,叶绿素荧光参数被抑制程度与逆境胁迫间呈正相关,可作为植物的抗逆指标(冯建灿等,2002)。ABA受体PYR/PYL/RCAR蛋白、负调控因子2C类蛋白磷酸酶(PP2C)和正调控因子SnRK2s被认为是ABA信号途径的重要组件,其共同构成一个双向负调控系统来调控ABA信号转导及其下游反应。ABA信号诱发PYR/PYL/RCAR蛋白与PP2C相互作用,导致PP2C被抑制并激活SnRK2s,进而引发下游响应基因(ABF/AREB/ABI5和SLAC1等)被磷酸化或激活(Umezawa et al.,2010)。过量表达OsPYL3和OsPYL9可改善水稻的干旱和寒冷胁迫耐受性(Tian et al.,2015),而PYL-PP2C-SnRK2介导的ABA信号正向调控香蕉果实的成熟及耐寒、耐盐和渗透胁迫(Hu et al.,2017)。低温胁迫下,ABA可诱导、启动和引发植物固有抗冻性基因的表达,提高植物耐冻性。Rubio等(2018)研究发现低温和外施ABA均可诱导葡萄休眠芽CBF/DREB1转录因子表达增强,而ABA和低温联合处理致使CBF/DREB1转录因子表达量大于单独处理之和,并显著增强休眠芽抗寒性。综上所述,外施ABA能改善植物的胁迫生理,并诱导抗冻性基因表达,提高植物抗寒性。【本研究切入点】目前,我国胡椒产区主要采用越冬前增施有机肥、在椒头培土覆盖,寒害发生前设防霜棚、防风障、放熏烟堆等措施进行防寒,以及寒害过后采取病害防治、施肥、补种等措施恢复生产,但这些措施实施效果有限,灾后补救难以减少椒农损失。采用喷施ABA提高植物抗寒性已有相关报道,但外施ABA对胡椒抗寒性的影响及适宜喷施浓度等仍需深入探究。【拟解决的关键问题】研究不同浓度ABA对低温胁迫下胡椒叶片表型变化和抗寒生理变化的影响,明确ABA处理下胡椒抗寒能力变化,筛选出适宜外施ABA浓度并分析外施ABA对ABA信号转导相关基因表达的影响,以期为生产上提高胡椒抗寒性技术及揭示ABA信号在胡椒抗寒中的作用机理提供理论依据。
1 材料与方法
1. 1 试验材料
试验在中国热带农业科学院香料饮料研究所进行,试验胡椒品种为热引1号扦插苗,来源于农业农村部万宁胡椒种质资源圃。热引1号扦插苗按照农业行业标准NY/T 360—1999《胡椒 插条苗》执行。
1. 2 试验方法
1. 2. 1 试验设计 于2018年5月选取健康和无机械损伤的胡椒插条在温室沙床上培育,生根后选择生长一致的植株移栽至直径18 cm、高25 cm的育苗袋中,每袋2株,土壤为园土和枯枝落叶粉碎物以3∶1混匀配比而成。移栽成活3个月后移入人工培养室进行试验处理。于同年11月在人工培养室中30 ℃/24 ℃(12 h/12 h)培养1周,生长稳定后开始进行ABA处理。设5个梯度浓度处理,分别为0(CK)、25(T1)、50(T2)、75(T3)、100 mg/L(T4)ABA溶液,每处理4株,3次重复。接50 mL/株的剂量将ABA溶液喷施在相应处理植株叶片正反两面,直至滴水,多余溶液浇于盆内,每隔1 d喷施1次,共6 d。低温胁迫处理4 d,低温胁迫培养参数设置:温度15 ℃/5 ℃,光照强度200 μmol/(m2·s),时间为12 h/12 h,相对湿度保持在70%左右。处理完成后,测量叶绿素荧光参数并取样用于测定叶片生理生化指标。基因表达试验采用筛选出的75 mg/L ABA溶液处理胡椒,以纯水为对照,材料培養和ABA处理方法同上。ABA处理完成后,以5 ℃低温胁迫72 h,光照强度为200 μmol/(m2·s),时间为12 h/12 h,相对湿度保持在70%左右。并于低温胁迫0、4、8、24、48和72 h时分别取样抽取RNA,用于验证ABA信号传导途径中相关基因在低温胁迫ABA处理胡椒中的表达情况。
1. 2. 2 测定项目及方法 测定低温胁迫后各处理胡椒叶片的过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量及过氧化氢(H2O2)含量等生理生化指标,每处理3次重复,各指标采用南京建成生物技术有限公司试剂盒进行测定。采用Li-6400便携式光合测定仪于低温胁迫前和常温恢复2 h测定各处理胡椒叶绿素荧光参数,光照强度为900 μmol/(m2·s),CO2浓度为400 μmol/mol,流速为500 μmol/s,每处理3次重复。在叶片光化学反应达稳态时,测得PSII光化学猝灭系数(qP)、非光化学猝灭系数(qN)和实际光能转化效率(Yield)。用锡箔纸包被近枝头端第一完全稳定叶进行暗处理过夜,测定初始荧光(Fo)和最大荧光(Fm)。参照Rohá?ek(2002)的研究方法计算最大可变荧光Fv=Fm-Fo,并由此得到最大光化学量子产量(Fv/Fm)和最大光能转化潜力(Fv/Fo)
用于基因表达分析的样品在预冷研钵中用液氮研磨至粉末状,按试剂盒说明书提取RNA。采用TaKaRa试剂盒反转录合成cDNA。根据GenBank已公布的模式植物SnRK2和PYL基因序列,在胡椒EST数据库(SRX708503)中进行BLASTn搜索,获得与SnRK2和PYL基因序列同源的2个序列,即CL4161.Contig1_All和CL4292.Contig1_All。设计ORF特异性引物qABAs-F:5'-TTAGATGGAAGCAT GGCAC-3'、qABAs-R:5'-GAATGTAGCACGGAAG ACTG-3'和qABAp-F:5'-GTGAATGTGAAAACGG GTCT-3'、qABAp-R:5'-AGAAAAGGGAGGCAATA AAT-3',分别用于检测胡椒中SnRK2和PYL基因表達量。
实时荧光定量PCR检测以胡椒管家基因Polyubiquitin 1为内参,qABAs和qABAp为目标基因引物。采用荧光定量PCR仪(Life Technologies Quant Studio 6 Flex)进行PCR扩增,反应体系10.0 μL,其中cDNA模板1.5 μL,2×Taq PCR Master Mix 5.0 μL,10 μmol/L上、下游引物各0.4 μL,ddH2O补足至10.0 μL。每处理cDNA模板设3次重复,扩增程序为经典的2步法:95 ℃预变性2 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 40 s,进行40个循环。采用2-△△Ct法计算不同处理样品中目的基因的相对表达量。
1. 3 统计分析
使用Excel 2010整理试验数据;运用SPSS 16.0进行方差分析,并以Excel 2010制图。
2 结果与分析
2. 1 外源ABA处理对低温胁迫下胡椒叶片的影响
观察胡椒植株叶片表型(图1)可发现,低温胁迫下经ABA处理可提高热引1号胡椒抗寒性。其中,CK和T4处理植株受害较重,部分叶片脱落,部分稳定叶明显发黑,T1和T2处理植株部分叶片发黄,稳定叶边缘及叶尖发黑,植株受害较轻,T3处理植株寒害表型不明显。说明喷施一定浓度外源ABA可缓解胡椒寒害表型,且以75 mg/L ABA处理胡椒的寒害表型最轻。
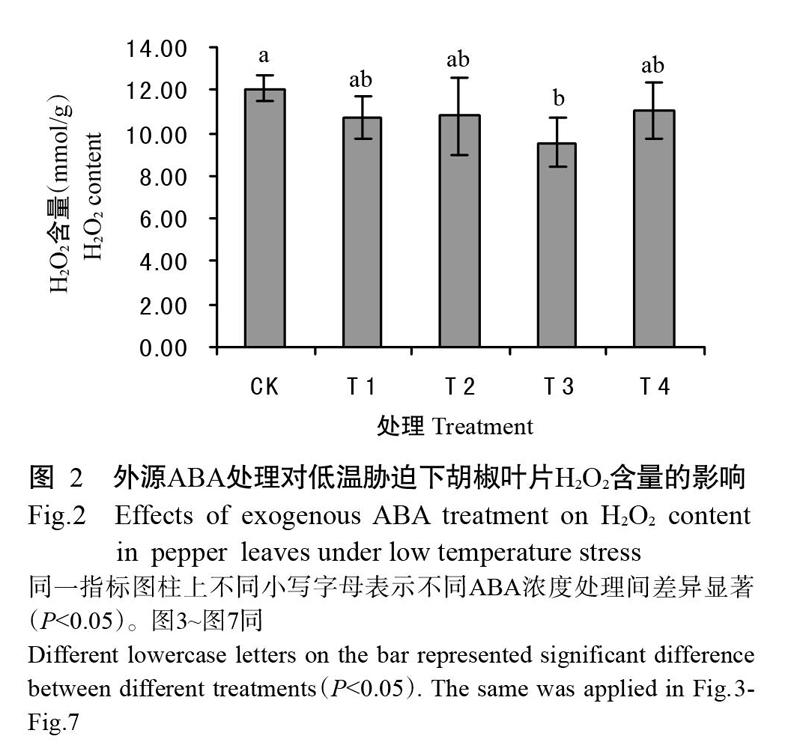
2. 2 外源ABA处理对低温胁迫下胡椒叶片H2O2含量的影响
低温胁迫能造成细胞内活性氧积累,而活性氧积累是引起质膜损伤的重要因素。如图2所示,低温胁迫下,随ABA浓度的增加胡椒叶片H2O2含量呈现先减少后增加的趋势。其中,T3处理H2O2含量较CK显著下降20.67%(P<0.05,下同);T1、T2和T4处理的H2O2含量与CK相比有下降变化趋势,分别下降10.98%、10.54%和8.11%,但无显著差异(P>0.05,下同);T1、T2和T4各处理间的H2O2含量也无显著差异;T3处理H2O2含量低于T1、T2和T4处理,但无显著差异,分别下降12.21%、11.33%和15.84%。以上结果说明低温胁迫下,喷施低于100 mg/L的外源ABA可不同程度降低胡椒叶片中H2O2含量,保护质膜免受伤害,其中以75 mg/L ABA处理降低H2O2含量效果最显著。
2. 3 外源ABA处理对低温胁迫下胡椒叶片抗氧化酶活性的影响
POD、CAT和SOD是植物体内清除自由基的3种重要保护酶,其活性增强可作为植物抗寒性鉴定的标准(He et al.,2016)。由图3可知,低温胁迫后,适宜浓度ABA处理可提高胡椒叶片中POD、CAT和SOD活性。从图3-A可看出,与CK相比,POD活性在T1处理无显著变化,T2、T3和T4处理均显著升高,分别升高162.78%、120.45%和17.40%,说明低温胁迫下喷施25 mg/L ABA对胡椒叶片POD活性无显著影响,当ABA处理浓度超过50 mg/L后POD显著升高,但随处理浓度升高对提高POD活性效果减弱。从图3-A还可看出,与CK相比,CAT活性在T1、T2和T4处理无显著性变化,T3处理显著升高40.06%,即低温胁迫下,喷施25、50和100 mg/L ABA对胡椒叶片CAT活性无显著影响,而75 mg/L ABA处理能显著提高胡椒叶片CAT活性。从图3-B可看出,与CK相比,各处理的胡椒叶片SOD活性均显著升高,分别升高28.61%、15.85%、42.64%和33.67%,其中,SOD活性在T3处理中最高,在T1与T4处理间无显著差异,T3处理与其他处理均存在显著差异,说明低温胁迫下喷施低于100 mg/L的ABA能提高胡椒叶片SOD活性,以75 mg/L ABA处理效果最佳。综上所述,低温胁迫条件下,外源ABA处理可提高胡椒叶片中抗氧化酶活性,且不同抗氧化酶的活性提高效果不同,其中以提高POD活性效果最好,而提高CAT活性效果最差;保护酶POD、CAT和SOD活性的提高,增强了清除自由基和活性氧的能力,降低了膜脂过氧化作用,其中喷施75 mg/L ABA的效果最佳。
2. 4 外源ABA处理对低温胁迫下胡椒叶片MDA含量的影响
逆境条件下植物膜脂常发生过氧化作用,MDA积累量是衡量植物遭受逆境伤害程度的指标(Car-valho et al.,2013;Grimaud et al.,2013)。低温胁迫后植物体内MDA积累越多,表明植物膜结构和功能的受冻害程度越严重,抗寒能力越弱。由图4可知,与CK相比,T1、T2、T3和T4处理的MDA含量均显著下降,分别下降27.33%、29.21%、37.95%和23.86%,且随ABA处理浓度的增加MDA含量呈先下降后上升的变化趋势,其中T3处理的MDA含量最低,但其与T1、T2和T4处理未达显著差异。表明低温胁迫下喷施低于100 mg/L的ABA能显著降低胡椒叶片细胞膜受损伤程度,不同浓度处理间无显著差异,但以外源喷施75 mg/L ABA的效果最佳。
2. 5 外源ABA处理对低温胁迫下胡椒叶片Fv/Fm和Fv/Fo的影响
从图5可看出,低温胁迫0 d时,不同浓度ABA处理的胡椒Fv/Fm和Fv/Fo无显著差异,说明正常生长条件下,喷施不同浓度ABA对胡椒叶片的Fv/Fm和Fv/Fo没有影响。低温胁迫4 d时,不同浓度ABA处理的胡椒Fv/Fm和Fv/Fo均有不同程度的下降趋势。从图5-A可知,与低温胁迫0 d相比,CK、T1、T2、T3和T4处理的Fv/Fm分别下降21.59%、24.63%、20.13%、13.72%和22.17%,说明低温胁迫导致胡椒叶片Fv/Fm下降;随着ABA处理浓度的升高,各处理的Fv/Fm呈现先上升后下降的变化趋势,其中T3处理的Fv/Fm最高,比CK升高10.14%,且与其余处理均存在显著差异。说明75 mg/L ABA处理能在一定程度上缓解低温对胡椒的光抑制,提高PSII中心利用光能的效率,從而缓解光能对细胞的损伤,增强抗寒能力。从图5-B可知,与低温胁迫0 d相比,低温胁迫4 d后CK、T1、T2、T3和T4处理的Fv/Fo分别下降54.58%、59.00%、53.26%、41.31%和56.72%,说明低温胁迫导致胡椒叶片Fv/Fo下降;随着ABA处理浓度的升高,各处理Fv/Fo呈现下降—上升—下降的变化趋势,其中T3处理显著高于CK和T1处理,T1、T2和T4处理与CK无显著差异。说明50~100 mg/L ABA处理能在一定程度上缓解低温对胡椒光系统潜在活性的抑制,其中以75 mg/L ABA处理的效果最佳。
2. 6 外源ABA处理对低温胁迫下胡椒叶片qP、qN和Yield的影响
由图6可知,低温胁迫0 d时,不同浓度ABA处理胡椒的qP和Yield无显著差异,说明正常生长条件下,喷施不同浓度ABA对胡椒叶片的qP和Yield影响不明显;qN随ABA处理浓度的升高,出现明显下降趋势,说明外源ABA处理会减弱胡椒的光保护能力。低温胁迫4 d时,不同浓度ABA处理的胡椒叶片qP、qN和Yield均有不同程度的下降趋势。随着ABA处理浓度的升高,低温胁迫下,qN呈现下降、上升再下降的趋势,qP呈现先下降后上升的趋势,75 mg/L ABA处理成为转折点;与CK相比,T3处理胡椒叶片qN提高23.55%,qP下降36.47%,说明在低温胁迫下,喷施外源ABA能提高植物的光保护能力,其中75 mg/L ABA处理的效果相对较好。低温胁迫4 d时,Yield随ABA处理浓度的升高呈先上升后下降的趋势,在75 mg/L ABA处理时Yield最高。在低温胁迫下,相同ABA浓度处理的胡椒Yield均明显下降,CK、T1、T2、T3和T4处理分别下降45.37%、37.36%、22.07%、2.78%和10.24%。说明喷施外源ABA能在一定程度上缓解低温胁迫对胡椒的影响,其中75 mg/L ABA处理的效果较明显。
2. 7 低温胁迫下外源ABA处理对胡椒抗寒性相关基因表达的影响
低温胁迫下胡椒ABA信号转导相关基因SnRK2和PYL的表达如图7所示。喷施水处理中,SnRK2和PYL基因在低温胁迫后的相对表达量出现上调,且分别在胁迫48和72 h时达最高值,说明SnRK2和PYL基因受低温胁迫诱导表达。低温胁迫0 h时,与喷施水处理相比,喷施ABA处理的SnRK2和PYL基因相对表达量也出现明显上调,分别上调2.93和1.37倍,说明这些基因也受ABA诱导表达。在喷施ABA处理中,SnRK2和PYL基因在低温胁迫后多个时期出现显著上调,且在胁迫48 h时达最高值;在同一胁迫时期喷施ABA处理2个基因的相对表达量大多数明显高于喷施水处理,且高表达时期的出现早于喷施水处理。说明在低温胁迫条件下,喷施ABA可诱导SnRK2和PYL基因提前并高表达,促进低温胁迫下胡椒ABA信号的转导。
3 讨论
3. 1 叶面喷施外源ABA对低温胁迫下胡椒生理特性的影响
前期研究发现,低温胁迫后,胡椒叶片的POD、CAT和SOD等3种抗氧化酶活性呈显著升高,证明低温胁迫后胡椒为减缓寒害伤害产生了积极的防御反应。同时,不同低温胁迫下胡椒表现不同的寒害表型,说明胡椒虽然表现积极防御低温的能力,但能力有限(伍宝朵等,2018a)。ABA作为一种胁迫激素在植物干旱、低温及盐渍等逆境胁迫中起重要作用,外施ABA可代替低温锻炼,提高植物抗寒性(Guy,1990)。刘艳菊等(2016)研究表明,在10 ℃胁迫下喷施50~200 μmol/L ABA处理可提高油棕幼苗抗寒能力,油棕幼苗的质膜透性和SOD活性下降,渗透物质含量和POD活性提高,MDA和H2O2含量被抑制,其中以200 μmol/L ABA抗寒性效果最好。尹松松等(2016)研究表明200 μg/L ABA处理番茄幼苗提高抗寒性效果最佳。陈燕等(2019)通过测定喷施外源ABA对番木瓜幼苗叶片SOD活性、POD活性和MDA含量的影响,发现以5 mg/L ABA处理对提高抗寒性番木瓜幼苗效果最佳。因此,不同植物对施用ABA浓度敏感性各不相同,喷施外源ABA对胡椒抗寒性作用尚未清楚。
本研究结果表明,低温胁迫后,外施不同浓度ABA可显著降低胡椒叶片的MDA含量,其中喷施75 mg/L ABA的叶片MDA含量下降显著,说明外施ABA可减少低温对胡椒叶片膜结构的伤害,与方仁等(2014)对香蕉幼苗、刘艳菊等(2016)对油棕幼苗的研究结果一致。在植物受到逆境胁迫时,POD、CAT和SOD酶活性会增强,植物的抗逆能力提高。SOD可催化超氧阴离子自由基发生歧化反应生成H2O2和O2,是一类重要的清除自由基抗氧化酶;H2O2能在CAT和POD的作用下生成无毒的H2O和O2。本研究发现,低温胁迫后外施ABA能显著提高各处理胡椒叶片SOD活性,其中喷施75 mg/L ABA的效果最佳,说明外施ABA能促使胡椒叶片中超氧阴离子自由基向H2O2的转化,减少脂质过氧化;25、50和100 mg/L ABA处理对胡椒叶片CAT活性無显著影响,而外施75 mg/L ABA处理显著提高胡椒叶片的CAT活性,同时喷施25 mg/L ABA对胡椒叶片POD活性无显著影响,当ABA处理浓度超过50 mg/L能显著提高POD活性。综合分析CAT和POD的变化趋势发现,与CK相比,外施75 mg/L ABA胡椒叶片中CAT和POD能催化更多的H2O2生成无毒的H2O和O2。
3. 2 叶面喷施外源ABA对低温胁迫下胡椒光合特性的影响
叶绿素荧光是一种快速、灵敏无损伤评价植物光合器官损伤情况的探测手段,常用于逆境对光合作用影响的研究,是植物抗逆性鉴定的理想指标。Fv/Fm反映PSII反应中心的最大光能转化效率,其值下降越多,表明PSII光化学效率越低,是抗寒性鉴定主要敏感指标(张守仁,1999)。C3植物在正常生长条件下Fv/Fm维持在0.8左右,但在逆境条件下会出现明显下降趋势(朱傅赟,2007)。本研究中,在低温胁迫前各处理Fv/Fm介于0.77~0.78,符合前人研究的正常生长条件下Fv/Fm的变化范围;在低温胁迫后CK的Fv/Fm出现明显下降(21.59%),说明低温造成胡椒PSII光化学效率降低,影响胡椒的光合作用。李静等(2016)研究发现,喷施外源生长调节物质可缓解低温条件下杨树Fv/Fm的下降趋势;本研究中外源ABA处理可在一定程度上提高胡椒叶片Fv/Fm,与CK相比,50、75和100 mg/L ABA处理分别提高2.59%、10.14%和0.61%,说明外施ABA可缓解低温胁迫下胡椒PSII光化学效率的下降,其中75 mg/L ABA的效果最佳。低温胁迫条件下,Fv/Fm下降的同时若伴随Fo的上升,表明是PSⅡ反应中心的光化学伤害引起Fv/Fm下降;若伴随Fo的下降,表明是PSⅡ反应中心的热耗散增加所致(李平等,2000)。本研究结果表明,在低温胁迫下,Fv/Fm下降,并伴随Fo的上升,各处理上升幅度为15.86%~32.48%,反映低温胁迫已造成胡椒PSⅡ反应中心的光化学伤害,高浓度ABA处理(100 mg/L)会加剧PSⅡ反应中心的光化学伤害。王可玢等(1996)、Lootens等(2004)认为Fv/Fo是鉴定番茄和玉米品种抗寒性的可靠方法,低温可导致植物Fv/Fo降低,抗寒性强的品种Fv/Fo下降幅度较小。本研究中,低温胁迫后各处理Fv/Fo均明显下降,但75 mg/L ABA处理的Fv/Fo下降幅度显著低于CK,说明该浓度处理可缓解低温对胡椒的伤害。
3. 3 叶面喷施75 mg/L ABA对低温胁迫下胡椒ABA信号转导基因表达的影响
植物耐冷性是受多个基因控制的复杂性状(潘宝贵等,2019)。在拟南芥中PYL作为直接受体参与ABA信号转导(Kobayashi et al.,2004)。SnRK2是一种丝氨酸/苏氨酸类蛋白激酶,在ABA信号转导中发挥重要作用(Asano et al.,2012)。Tian等(2013)研究发现在ABA作用和低温胁迫条件下,TaSnRK2.3基因在普通小麦叶片中强烈表达,说明TaSnRK2.3基因受ABA和低温诱导表达。本研究中,SnRK2和PYL基因在低温胁迫条件下的相对表达量显著高于低温胁迫前,且在同一胁迫时期喷施ABA处理的相对表达量多数明显高于喷施水处理,同时高表达时期出现也较早,说明这些基因在胡椒中可被低温和ABA诱导高量表达,ABA处理可提前高效诱导ABA信号转导相关基因表达,启动和引发植物固有抗冻性基因的表达,提高植物耐冻性。在低温胁迫条件下,ABA诱导胡椒中相关功能基因表达发生变化的原因还需进一步探究。
4 结论
外源ABA通过提高胡椒抗氧化酶活性、降低H2O2和MDA含量及缓解低温对其光系统活性的伤害,而提高胡椒抵抗低温胁迫的能力。外源ABA还能诱导胡椒ABA信号转导相关基因表达,启动和引发植株固有抗冻性基因的表达,进而提高其耐冻性。
参考文献:
陈燕,潘祖建,甘卫堂,欧景莉,朱杨帆,陈豪军,宁琳,何江,李穆. 2019. 外源ABA对低温胁迫下番木瓜幼苗抗寒性的影响[J]. 农业研究与应用,32(2): 5-8. [Chen Y,Pan Z J,Gan W T,Ou J L,Zhu Y F,Chen H J,Ning L,He J,Li M. 2019. Effects of exogenous abscisic acid on chilling resistance of papaya seedling under cold stress[J]. Agricultural Research and Application,32(2): 5-8.]
方仁,龙兴,邓彪,张继,唐娟,黄伟雄,唐文忠,黄宏明,尧金燕. 2014. 脱落酸对低温胁迫后香蕉幼苗恢复生长的影响[J]. 湖北农业科学,53(20):4878-4881. [Fang R,Long X,Deng B,Zhang J,Tang J,Huang W X,Tang W Z,Huang H M,Yao J Y. 2014. Effects of abscisic acid on the recovery growth of banana seedlings under low temperature stress[J]. Hubei Agricultural Sciences,53(20): 4878-4881.]
冯建灿,胡秀丽,毛训甲. 2002. 叶绿素荧光动力学在研究植物逆境生理中的应用[J]. 经济林研究,20(4): 14-18. [Feng J C,Hu X L,Mao X J. 2002. Application of chlorophyll fluorescence dynamics to plant physiology in adverse circumstance[J]. Economic Forest Researches,20(4): 14-18.]
李静,郭成博,李正华,李春明. 2016. 外源植物生长调节物质对杨树叶绿素荧光特性的影响[J]. 林业科技,41(1): 24-27. [Li J,Guo C B,Li Z H,Li C M. 2016. Effects of foreign plant growth regulating substances on chlorophyll fluorescence of Populus[J]. Forestry Science & Techno-logy,41(1): 24-27.]
李平,李曉萍,陈贻竹,刘鸿先. 2000. 低温光抑制胁迫对不同抗冷性的籼稻抽穗期剑叶叶绿素荧光的影响[J]. 中国水稻科学,14(2): 88-92. [Li P,Li X P,Chen Y Z,Liu H X. 2000. Effect of chilling induced photoinhibition stress on chlorophyll fluorescence in flag leaves at heading stage in indica rice varieties with different cold tolerance[J]. Chinese Journal of Rice Science,14(2): 88-92.]
李艳军. 2005. 外源化学物质诱导对番茄苗期抗冷性的影响[D]. 哈尔滨: 东北农业大学: 7-8. [Li Y J. 2005. Effects induced by exogenous chemical on resistance of seeding of tomato to chilling injurg[D]. Harbin: Northeast Agricultural University: 7-8.]
刘艳菊,林以运,曹红星,李静,雷新涛. 2016. 外源ABA对低温胁迫油棕幼苗生理的影响[J]. 南方农业学报,47(7): 1171-1175. [Liu Y J,Lin Y Y,Cao H X,Li J,Lei X T. 2016. Effects of exogenous ABA on physiology of oil palm seedlings under cold stress[J]. Journal of Southern Agriculture,47(7): 1171-1175.]
潘宝贵,钱恒彦,戈伟,刘金兵,郭广君,刁卫平,王述彬. 2019. 辣椒应答冷信号转导机制研究进展[J]. 江苏农业学报,35(3): 743-748. [Pan B G,Qian H Y,Ge W,Liu J B,Guo G J,Diao W P,Wang S B. 2019. Research progress of cold signal transduction mechanisms in pe-pper[J]. Jiangsu Journal of Agricultural Sciences,35(3): 743-748.]
田丹青,刘晓静,葛亚英,潘敏刚,曹群阳. 2010. 叶面喷施ABA对蝴蝶兰抗寒性影响的初探[J]. 浙江农业科学,(6): 1252-1253. [Tian D Q,Liu X J,Ge Y Y,Pan M G,Cao Q Y. 2010. Effects of foliar application of ABA on cold-resistance of Phalaenopsis amabilis[J]. Journal of Zhejiang Agricultural Sciences,(6): 1252-1253.]
王灿,杨建峰,陈小敏,祖超,李志刚,鱼欢,邬华松. 2015. 基于因子分析的胡椒寒害气象等级研究[J]. 热带作物学报,36(12): 2171-2178. [Wang C,Yang J F,Chen X M,Zu C,Li Z G,Yu H,Wu H S. 2015. Classification of black pepper chilling injury based on factor analysis[J]. Chinese Journal of Tropical Crops,36(12): 2171-2178.]
王可玢,赵福洪,王孝宣,李树德. 1996. 用体内叶绿素a荧光动力学鉴定番茄的抗冷性[J]. 植物学报,13(2): 29-33. [Wang K B,Zhao F H,Wang X X,Li S D. 1996. In vivo chlorophyll a fluorescence induction kinetics as a tool for chilling-tolerance detection in tomato[J]. Chinese Bulletin of Botany,13(2): 29-33.]
伍宝朵,范睿,胡丽松,杨建峰,郝朝运. 2018a. 不同低温胁迫条件下胡椒叶片生理生化及结构分析[J]. 热带作物学报,39(1): 61-66. [Wu B D,Fan R,Hu L S,Yang J F,Hao C Y. 2018a. The leaf physiological,biochemical varia-tion and structural analysis of Piper nigrum cv. Reyin-1 under cold stress[J]. Chinese Journal of Tropical Crops,39(1): 61-66.]
伍宝朵,范睿,胡丽松,杨建峰,郝朝运. 2018b. 低温胁迫对胡椒叶片生理生化及显微结构的影响[J]. 热带作物学报,39(8): 1519-1525. [Wu B D,Fan R,Hu L S,Yang J F,Hao C Y. 2018b. Effect of cold stress on the leaf physiological,biochemical variation and anatomical structure in Piper L.[J]. Chinese Journal of Tropical Crops,39(8): 1519-1525.]
萧自位,张洪波,田素梅,白学慧,李锦红,周华,郭铁英,夏红云,马关润,赵明珠. 2017. 云南德宏地区两种胡椒栽培模式寒害研究[J]. 热带农业科技,40(2):15-17. [Xiao Z W,Zhang H B,Tian S M,Bai X H,Li J H,Zhou H,Guo T Y,Xia H Y,Ma G R,Zhao M Z. 2017. Studies on cropping systems against chilling damage of pepper in Dehong of Yunnan Province[J]. Tropical Agricultural Science & Technology,40(2):15-17.]
尹松松,赵婷婷,李景富,姜景彬,张贺,陈秀玲,许向阳. 2016. 外源ABA对番茄幼苗抗冷性差异的研究[J]. 东北农业科学,41(4): 94-99. [Yin S S,Zhao T T,Li J F,Jiang J B,Zhang H,Chen X L,Xu X Y. 2016. Studies on exo-genous ABA on chilling resistance of tomato seedling[J]. Journal of Northeast Agricultural Sciences,41(4): 94-99.]
张春林,严文伟,朱权. 2018. 绿春县三猛乡胡椒种植技术[J]. 云南农业科技,(2): 34-35. [Zhang C L,Yan W W,Zhu Q. 2018. The planting technology of black pepper in Sanmeng Town,Lüchun County[J]. Yunnan Agricultural Science and Technology,(2): 34-35.]
张守仁. 1999. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学报,16(4): 444-448. [Zhang S R. 1999. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J]. Chinese Bulletin of Botany,16(4): 444-448.]
朱傅赟. 2007. 高溫下水稻PSⅡ和光合关键酶的动态研究[D]. 杭州: 浙江大学. [Zhu F Y. 2007. Dynamic study on PSⅡ and photosynthetic key enzyme in rice under high-temperature stress[D]. Hangzhou: Zhejiang University.]
Asano T, Hayashi N, Kikuchi S, Ohsugi R. 2012. CDPK-mediated abiotic stress signaling[J]. Plant Signal and Behavior,7(7): 817-821.
Carvalho C P,Hayashi A H,Braga M R,Nievola C C. 2013. Biochemical and anatomical responses related to the in vitro survival of the tropical bromeliad Nidularium minutum to low temperatures[J]. Plant Physiology and Biochemistry,71:144-154.
Grimaud F,Renaut J,Dumont E,Sergeant K,Lucau-Danila A,Blervacq A S,Sellier H,Bahrman N,Lejeune-Hénaut I,Delbreil B,Goulas E. 2013. Exploring chloroplastic chan-ges related to chilling and freezing tolerance during cold acclimation of pea(Pisum sativum L.)[J]. Journal Proteomic,80(1): 145-159.
Guy C L. 1990. Cold acclimation and freezing stress tole-rance: Role of protein metabolism[J]. Annual Review of Plant Physiology and Plant Molecular Biology,41:187-223.
He S L,Zhao K T,Ma L F,Yang J J,Chang Y W,Muhammad A A. 2016. Comparison of cold resistance physiological and biochemical features of four Herba rhodiola seedlings under low temperature[J]. Saudi Journal of Biolo-gical Sciences,23(2):198-204.
Hu W,Yan Y,Shi H T,Liu J H,Miao H X,Tie W W,Ding Z H,Ding X P,Wu C L,Liu Y,Wang J S,Xu B Y,Jin Z Q. 2017. The core regulatory network of the abscisic acid pathway in banana: Genome-wide identification and expression analyses during development,ripening,and abiotic stress[J]. BMC Plant Biology,17(1): 145.
Kobayashi Y,Yamamoto S,Minami H,Kagaya Y,Hattori T. 2004. Differential activation of the rice sucrose nonfermenting1-related protein kinase2 family by hyperosmotic stress and abscisic acid[J]. The Plant Cell,16: 1163-1177.
Lootens P,Van Waes J,Carlier L. 2004. Effect of a short photo inhibition stress on photosynthesis,chlorophyll a fluorescence,and pigment contents of different maize cultivars. Can a rapid and objective stress indicator be found?[J]. Photosynthetica,42:187-192.
Rohá?ek K. 2002. Chlorophyll fluorescence parameters: The definitions,photosynthetic meaning and mutual relationships[J]. Photosynthetica,40: 13-29.
Rubio S G,Noriega X,Pérez F J. 2018. Abscisic acid(ABA) and low temperatures synergistically increase the expression of CBF/DREB1 transcription factors and cold-hardiness in grapevine dormant buds[J]. Annals of Botany,123(4): 681-689.
Tian S J,Mao X G,Zhang H Y,Chen S S,Zhai C C,Yang S M,Jing R L. 2013. Cloning and characterization of Ta-SnRK2.3,a novel SnRK2 gene in common wheat[J]. Journal of Experimental Botany,64(7): 2063-2080.
Tian X J,Wang Z Y,Li X F,Lü T X,Liu H Z,Wang L Z,Niu H B,Bu Q Y. 2015. Characterization and functional analysis of pyrabactin resistance-like abscisic acid receptor family in rice[J]. Rice, 8(1): 1-13.
Umezawa T,Nakashima K,Miyakawa T,Kuromori T,Tanokura M,Shinozaki K,Yamaguchi-Shinozaki K. 2010. Molecular basis of the core regulatory network in ABA responses: Sensing,signaling and transport[J]. Plant and Cell Physiology,51(11): 1821-1839.
(責任编辑 邓慧灵)
收稿日期:2019-12-24
基金项目:海南省自然科学基金项目(320QN346);中国热带农业科学院基本科研业务费专项(1630142017010)
作者简介:*为通讯作者,郝朝运(1979-),研究员,主要从事胡椒种质资源研究工作,E-mail:haochy79@163.com。伍宝朵(1984-),主要从事胡椒抗逆研究工作,E-mail:0204114089@163.com
