蒲公英酚酸综合提取技术优化及质量评价
2020-02-22吴哲李赵嘉冯薇孟然王秀萍
吴哲 李赵嘉 冯薇 孟然 王秀萍


摘要:为获得快速和准确检测蒲公英成分的提取工艺,以甲醇为提取剂,通过超声波和酶解辅助提取,采用响应面设计方法,结合指纹图谱综合质量评价方法,筛选最佳提取工艺。结果表明,纤维素酶有利于提升提取和检测结果的稳定性,液料比对提高提取率具有促进作用,甲醇与提取时间或甲醇与液料比对提取率的提升表现出了协同作用。高效液相色谱(HPLC)指纹图谱分析结果显示,在所有的处理中,绿原酸和咖啡酸与对照图谱匹配度均为100%,以二者含量为综合评价指标,获得的最佳提取条件为纤维素酶0.1%,pH值为4,液料比为300 ∶ 1(mL ∶ g),甲醇体积分数为40%,超声提取时间120 min。本提取技术降低了操作成本,检测结果稳定,可直接用于实验室蒲公英酚酸类成分检测;同时,本研究中的提取优化方法也为其他植物成分提取技术优化提供了参考。
关键词:蒲公英;指纹图谱;咖啡酸;绿原酸;优化及质量评价
中图分类号:R284.2 文献标志码: A 文章编号:1002-1302(2020)23-0190-06
蒲公英是一种常见的中草药,富含多糖、绿原酸、咖啡酸、总黄酮等多种活性成分。近年来随着人们健康意识的提高,蒲公英逐渐成为一种药食兼用植物。现代药理研究表明,蒲公英具有广谱抑菌、抗氧化、抗肿瘤和免疫促进等作用,而这些作用与酚酸类物质有一定的关系[1-2]。因此蒲公英不仅在医药卫生领域备受关注,在食品特别是功能性食品的研究开发上也成为热点。而酚酸类化合物的提取以及检测则成为蒲公英应用开发的重要基础。
咖啡酸和绿原酸均为蒲公英的主要活性物质[3],且《中华人民共和国药典》2015年版规定蒲公英咖啡酸含量不应低于0.02%。蒲公英成分含量变化除了与种类和栽培条件有关之外[4],也与提取技术有关[1]。蒲公英成分提取方法按提取剂可分为水提和醇提,原理是酚酸物质易溶于水和醇类溶剂。因此可将原料溶于提取剂,同时辅以物理方法或酶解方法破碎细胞壁,可提高酚酸成分提取率。提取工艺通常有热水浸提、超声波辅助提取、回流浸提等方法。影响提取率的因素还包括料液比、提取时间、提取温度、溶剂浓度等,不同的提取条件有可能导致蒲公英成分结构变化[1,3,5],进而影响成分功效。因此如何平衡最大的提取率及提取质量成为本研究的重点内容。
1 材料与方法
1.1 材料与试剂
丹东蒲公英(Taraxacum antungense)叶片干粉为河北省农林科学院滨海农业研究所选育的滨蒲1号叶片加工获得。60 ℃烘干至恒质量,粉碎后过80目筛,粉末置干燥器中干燥保存、備用。
咖啡酸、绿原酸、阿魏酸及木樨草素标准品购自中国药品生物制品检定所;无水甲醇为国产分析纯;纤维素酶酶活性为10 000 U/g;纯化水由河北省农林科学院滨海农业研究所制备。
1.2 提取工艺及优化
称取一定量蒲公英样品,放入50 mL具塞离心管中,加入5 mL纤维素酶溶液(质量浓度为0.1%,pH值为4),置于60 ℃水浴加热30 min[1,6];随后离心管中加入甲醇溶液20 mL,进行超声提取,超声波功率120 W,提取结束后离心取上清液,待测。优化的参数为甲醇浓度、料液比以及提取时间,具体提取参数及蒲公英样品质量按响应面优化设计表进行(表1)。
1.3 检测方法
利用注射器辅以0.45 μm滤膜将提取液注入进样瓶,准备液相检测。液相检测条件为安捷伦 1 200 HPLC,钻石1代C18色谱柱(4.6 mm ×250 mm,5 μm);流动相:A(0.02% 磷酸水溶液) ∶ B(甲醇)=50 ∶ 50;检测波长:350 nm;柱温:30 ℃;流速:1 mL/min;进样量:10 μL。
配制不同浓度的绿原酸和咖啡酸标品,与对应的HPLC峰面积建立标准曲线,经拟合后,标准曲线分别为y1=16.835x1-16.971、y2 =22.173x2-13.042。其中,y1、y2为绿原酸和咖啡酸峰面积;x1和x2为绿原酸和咖啡酸含量,μg/mL。有效检测范围为0~100 μg/mL。
1.4 数据分析
为了更好地评价提取工艺,将不同提取条件下的绿原酸和咖啡酸得率加权,以总咖啡酸得率为优化目标[11],利用Design Expert 8.0.6软件综合评价提取工艺。加权方法:以绿原酸和咖啡酸得率的算术平均值比值为系数(k),将绿原酸转换为咖啡酸,可得总咖啡酸得率,经计算k=0.544(表1),即:总咖啡酸得率=绿原酸得率(%)×0.544+咖啡酸得率(%)。最后将HPLC数据导入中药色谱指纹图谱相似度评价系统,进行相似度分析。试验每个处理重复4次,结果以平均数±标准误形式呈现,采用SPSS 16.0软件Duncans新复极差法进行差异显著性检验。
2 结果与分析
2.1 咖啡酸提取工艺优化
试验结果表明,Cubic模型拟合结果呈显著性(F=6.855,P=0.039),但是部分交叉项超出可信范围,调整后模型变为y=5.710-0.410x1+0.740x2-0.190x3+0.078x1x2-0.480x1x3+0.048x2x3-0.140x21-0.800x22+0.260x23-0.660x21x2+1.170x21x3+1.880x1x22,R2=0.95,其中y为咖啡酸含量,x1、x2、x3为甲醇含量,液料比和时间。根据模型的方差分析(表2),从单因子影响结果看,液料比显著促进提取率(F=9.416,P=0.037),其他2个因素对提取率没有显著影响,影响力大小为液料比>甲醇含量>时间。从影响因子协同效果看,甲醇含量与时间(A2C,F=11.536,P=0.027),甲醇含量与液料比(AB2,F=29.85,P=0.006)协同作用均对提取率有显著促进作用。根据实际数值,拟合函数为 y= 0.884 28x1+ 0.221 73x2+ 0.361 80x3-0.001 71x1x2-0.013 38x1x3+0.000 01x2x3-0.003 35x21-0.000 77x22+0.000 13x23-0.000 03x21x2+0.000 12x21x3+ 0.000 01x1x22-36.276 06。据此,可获得10个最高提取率的方案(表3),其中优化后的甲醇浓度主要围绕在40%和70%,提取时间主要围绕在120 min,液料比主要围绕在200 ∶ 1(mL ∶ g)和300 ∶ 1(mL ∶ g)。由表3可知,最高提取率的方案为甲醇浓度40%,液料比200.7 ∶ 1(mL ∶ g),提取时间 120 min,预期咖啡酸含量7.7 mg/g。
2.2 绿原酸提取工艺优化
利用同样的分析及处理方法,对绿原酸提取工艺进行优化,可得到拟合模型,即y=3.059-0.107x1+0.255x2+0.005x3+0.055x1x2-0.075x1x3+0.004x2x3-0.055x21-0.196x22-0.019x23-0.122x21x2+0.228x21x3+0.356x1x22,R2=0.98,其中y为咖啡酸含量,x1、x2、x3为甲醇浓度,液料比和时间。根据模型结果和方差分析(表4)可知,甲醇浓度(F=9.660,P=0.036 0)和液料比(F=54.960,P=0.002 0)均对绿原酸提取率有显著促进作用,甲醇浓度与时间(A2C,F=22.010,P=0.009 0),甲醇浓度与液料比(x1x22,F=53.550,P=0.002 0)协同作用均对提取率有显著促进作用。根据优化模型,可获得10个最高提取率的方案(表5),其中优化后的甲醇浓度主要为40%、70%,提取时间约为 120 min,而液料比约为200 ∶ 1(mL ∶ g)和300 ∶ 1(mL ∶ g),最高提取率的方案为甲醇浓度40%,液料比 203.7 ∶ 1(mL ∶ g),提取时间120.0 min,预期绿原酸含量为3.40 mg/g。
2.3 总酚酸提取工艺优化
对咖啡酸和绿原酸加权处理后 利用同样的分析方法,对总酚酸提取工艺进行优化,可得到拟合模型,即y=7.374 0-0.472 5x1+0.885 0x2-0.190 0x3+0.107 5x1x2-0.522 5x1x3+0.050 0x2x3-0.167 0x21-0.909 5x22+0.250 5x23-0.732 5x21x2+1.287 5x21x3+2.065 0x1x22,R2=0.96,其中y为咖啡酸含量,x1、x2、x3为甲醇浓度,液料比和时间。根据模型结果和方差分析可知,液料比(F=11.610,P=0.027 1)对总酚酸提取率有显著性促进作用,甲醇浓度与时间(A2C,F=12.290,P =0.025 0),甲醇浓度与液料比(AC,F=31.620,P =0.005 0)协同作用均对提取率有显著促进作用(表6)。根据模型可得到10个最高提取率的方案,其中优化后的甲醇浓度约为40%、70%,提取时间约为120.0 min,液料比约为200.0 ∶ 1、300.0 ∶ 1(mL ∶ g)。由表7可知,最高提取率方案为甲醇浓度40%,液料比202.7 ∶ 1(mL ∶ g),提取时间 120.0 min,预期总酚酸含量为9.55 mg/g。
2.4 总成分提取工艺指纹图谱分析与聚类分析
将所有提取液的HPLC数据导入中药色谱指纹图谱相似度评价系统中,经数据匹配,以中位数法建立对照指纹图谱(图1、表8)。结果显示所有峰的保留时间RSD均小于1%,说明所有的提取工艺一致性较好。蒲公英样品共检测出10种成分,其中所有提取方法均检测出绿原酸(4号)和咖啡酸(8号),二者为共有成分,与对照图谱匹配度为100%。其他成分1号、5号、9号匹配度也较高,经标准品检测和文献查阅,这3种成分为七叶内酯[3,7]、木樨草素-7-O-β-D葡萄糖苷[3,7]和阿魏酸。通过指纹图谱相似度分析,所有的提取工艺之间相似度均在0.98以上,说明所有的提取工艺在质量上具有高度相似性。为了更好地筛选提取工艺,笔者以咖啡酸和绿原酸峰面积为聚类指标,应用SPSS分析软件,采用组间联结、欧氏聚类法,所有提取工艺的聚类分析结果见图2。
当阈值为10时,所有的提取工艺被划分为两大类,其中10号处理被单列为一类,其他16种处理被划为一大类。随着阈值的减小,所有提取工艺可分为5类,其中处理5为单独一类。结合响应面优化模型给出的方案可知,处理5提取率最高,其次为处理2、处理3、处理4、处理6、处理8、处理9、处理12、处理17。
2.5 提取工艺筛选与验证
根据响应面优化模型,本研究获得3个最高提取率的条件,这3个条件非常相近,因此可确定优选条件(Ⅰ)为甲醇浓度40%,液料比200 ∶ 1(mL ∶ g),提取时间 120 min。同时结合聚类分析结果,笔者选择提取率相对中等(Ⅱ)和低水平(Ⅲ)的2个条件,分别为甲醇浓度70%,液料比300 ∶ 1(mL ∶ g),提取时间120 min;甲醇浓度60%,液料比300 ∶ 1(mL ∶ g),提取时间30 min;提取结果见图3。结果显示试验结果与软件模拟计算结果差异不显著,说明优化模型預测结果可信。另外,优选条件Ⅰ的咖啡酸提取率显著高于条件Ⅲ,但与条件Ⅱ差异不显著(P=0.785),说明优选条件Ⅰ和Ⅱ均可作为最佳提取工艺。
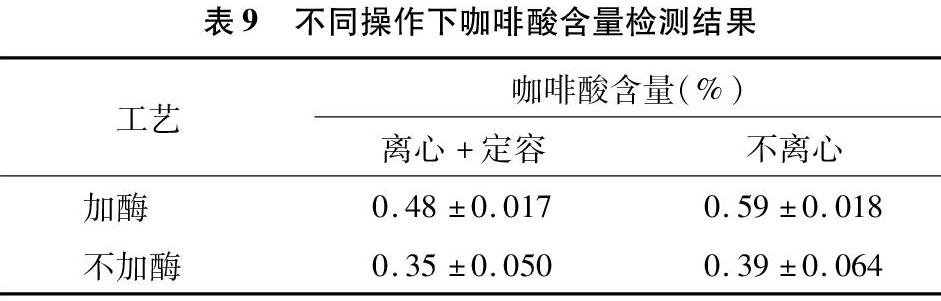
2.6 纤维素酶及离心操作对提取及检测结果的影响
本试验优化工艺筛选是基于加酶辅以超声波提取,由于水浴过程中可能存在酶解不完全或水分损失问题,因此笔者考察纤维素酶以及离心操作后二次定容对检测结果的影响。由于咖啡酸是《中华人民共和国药典》2015版规定的参考标准,因此笔者在优选条件Ⅱ下比较了不同操作咖啡酸检测结果(表9)。结果发现无论是否离心,加酶偏差最小,说明加酶后可提高该工艺的稳定性。离心定容后咖啡酸含量均降低,说明二次定容带来的绝对误差加大,因此本研究中的提取及检测不需要二次定容,须注意水浴过程中尽可能避免水分损失。
3 结论与讨论
目前商业生产中蒲公英成分提取多采用水提法,是因为考虑到提取剂成本以及提取设备复杂程度相对较低[1],而小规模提取多采用乙醇溶剂提取[5-6,8],是因为酚酸物质更易溶于醇类溶剂。本研究采用甲醇为溶剂,是因为酚酸物质检测多用HPLC检测方法,如GB/T 22250—2008《保健食品中绿原酸的测定》以及《中华人民共和国药典》2015年版等。甲醇由于极性好,常用于HPLC流动相。因此本研究直接用甲醇提取,省略了乙醇提取物旋蒸发+甲醇二次溶解步骤[4,8-10],不仅降低了液相进样的前处理时间,提高了检测效率,也减少了试验操作误差,提高了检测准确率。
已发表文献中蒲公英样品质量多在1 g左右,液料比常见于(10~30) ∶ 1(mL ∶ g)之间[1,2,9-10]。本研究发现,液料比过低容易使溶解不充分,影响提取效果。本研究中干样品质量约为0.1 g,甲醇 25 mL,降低材料成本。另外从指纹图谱可知,蒲公英主要物质在15 min内即可检出,因此在用液相色譜检测蒲公英咖啡酸和绿原酸时,可将检测时间控制在 15 min 内,从而降低了检测时间成本。根据优化结果,在酶解+超声波辅助提取条件下,如果从节约成本的角度,本研究推荐优化条件 Ⅰ,即甲醇40%、液料比200 ∶ 1(mL ∶ g),提取时间120 min;如果考虑提取率和综合质量,则选择优化条件 Ⅱ,即甲醇70%,液料比300 ∶ 1(mL ∶ g),提取时间120 min。
目前关于蒲公英有效成分提取技术优化研究主要集中在提高某一种成分提取率或浸出物总提取率方面;在用于提取质量评价的指标筛选过程中,笔者利用指纹图谱分析,采用多指标评价了提取质量,这对评价成分复杂的中药材,具有一定的科学合理性[11]。本研究为综合评价中药材质量提供了一种思路,即可根据各成分在药效中所起的作用赋予不同的权重系数综合评分进行评价,避免了对多指标单独评价时相互间的冲突。同时本研究的提取优化方法也为其他植物成分提取技术优化提供了参考。
参考文献:
[1]王秋亚. 蒲公英有效成分的提取及应用研究进展[J]. 江苏农业科学,2016,44(8):21-24.
[2]何婷婷,柴军红,钟读波,等. 蒲公英活性成分提取工艺的优化、多糖红外表征及其抗氧化性[J]. 江苏农业科学,2018,46(11):163-166.
[3]王亚茹,李雅萌,杨 娜,等. 蒲公英属植物的化学成分和药理作用研究进展[J]. 特产研究,2017(4):71-79.
[4]宁 伟,贾庆飞,朱 丹,等. 东北地区11种蒲公英咖啡酸和绿原酸的含量测定[J]. 沈阳农业大学学报,2012,43(5):595-598.
[5]李喜凤,郝 哲,邱天宝,等. 蒲公英中有机酸类成分的提取工艺研究[J]. 中成药,2011,33(2):262-265.
[6]张桂芳,郭希娟,王瑞琦. 响应面法优化超声波辅助萃取蒲公英多酚的研究[J]. 中国医院药学杂志,2017,37(5):421-426.
[7]姚 巍,林文艳,周长新,等. 蒙古蒲公英化学成分研究[J]. 中国中药杂志,2007,32(10):926-929.
[8]王 鹏,郭 丽. 响应面法优选蒲公英中绿原酸的提取工艺研究[J]. 北方园艺,2010(23):44-46.
[9]张 玲,李继昌,许 薇,等. 响应曲面法优化蒲公英中咖啡酸的提取工艺[J]. 饲料研究,2013(5):83-86.
[10]尹 青,张 华. 超声波法提取蒲公英中的绿原酸[J]. 食品研究与开发,2009,30(5):23-27.
[11]李景华,钟佳佳,刘玉芹,等. 吉林12种蒲公英HPLC指纹图谱研究[J]. 植物研究,2014,34(3):423-427.江 伟,张 晓,李 曼,等. 江苏省仓储小麦品质性状分析[J]. 江苏农业科学,2020,48(23):196-199.
