LAP+CD4+T细胞在胃癌外周血中的分布情况及临床意义
2020-02-22钟武刘传渊张磊刘红权易建中方传发张磊昌
钟武 刘传渊 张磊 刘红权 易建中 方传发 张磊昌
[摘要] 目的 檢测胃癌患者外周血中LAP+CD4+T细胞和CD4+CD25+ Treg细胞的分布比例,初步研究LAP+CD4+ T细胞与病理因素的相关性及在胃癌发生、进展中的作用。 方法 收集2018年1月~2019年6月我院胃肠疝外科收治的50例胃癌患者术前及术后临床病理资料,收集术前患者的外周血标本,收集同期50例健康志愿者外周血作为对照组。流式细胞技术检测LAP+CD4+T细胞和CD4+CD25+ Treg的分布比例,比较外周血中胃癌患者和健康志愿者LAP+CD4+T细胞的分布比例差异;Pearson法分析LAP+CD4+T细胞与临床病理因素及CD4+CD25+ Treg细胞的相关性。 结果 外周血LAP+CD4+T细胞占CD4+T细胞的比例,胃癌患者为[7.58(6.23,8.22)%]高于健康志愿者的[1.76(0.79,2.35)%](P<0.001);Pearson相关性分析结果显示,外周血中LAP+CD4+T细胞与CD4+CD25+Treg细胞分布比例呈正相关(r=0.629,P<0.001);肿瘤TNM分期越晚,LAP+CD4+ T细胞占CD4+T细胞比例越高(P<0.001);有远处转移患者LAP+CD4+ T细胞占CD4+T细胞比例高于无转移者(P<0.001)。结论 LAP+CD4+T细胞在胃癌患者外周血中比例升高,可能参与了胃癌的发生、进展,起到促进肿瘤生长、转移的作用。
[关键词] LAP+CD4+T细胞;调节性T细胞;胃癌;肿瘤微环境
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-9701(2020)35-0016-04
[Abstract] Objective To detect the distribution ratio of LAP+CD4+ T cells and CD4+CD25+ Treg cells in peripheral blood of patients with gastric cancer and preliminarily investigate the correlation between LAP+CD4+ T cells and clinicopathological factors as well as their roles in the occurrence and development of gastric cancer. Methods Preoperative and postoperative clinicopathological data of 50 patients with gastric cancer admitted to the Department of Gastrointestinal Surgery in our hospital from January 2018 to June 2019 were collected. Peripheral blood samples of preoperative patients were collected, and peripheral blood samples of 50 healthy volunteers with matching clinical features were collected as the control group. Flow cytometry was used to detect the distribution ratio of LAP+CD4+T cells and CD4+CD25+ Treg. The difference in the distribution ratio of LAP+ CD4+T cells in peripheral blood between gastric cancer patients and healthy volunteers was compared. Pearson assay was used to analyze the correlation between LAP+CD4+ T cells and clinicopathological factors as well as CD4+CD25+ Treg cells. Results The proportion of peripheral blood LAP+ CD4+T cells in CD4+T cells of patients with gastric cancer accounted for(7.58[6.23, 8.22]%), which was higher than that of healthy volunteers(1.76[0.79, 2.35]%) (P<0.001). Pearson correlation analysis showed that the LAP+CD4+T cells in the peripheral blood were positively related to CD4+ CD25+ Treg cells(r=0.629, P<0.001). The later TNM staging, the higher the proportion of LAP+CD4+ T cells in CD4+T cells(P<0.001), The percentage of CD4+T cells in patients with distant metastasis was higher than that in patients without metastasis(P<0.001). Conclusion The increased proportion of LAP+CD4+ T cells in peripheral blood of patients with gastric cancer may be involved in the occurrence and development of gastric cancer and play a role in promoting tumor growth and metastasis.
[Key words] LAP+CD4+ T cells; Regulatory T cells; Gastric cancer; Tumor microenvironment
CD4+CD25+调节性T细胞(Regulatory T,Treg)在维持机体免疫稳态和抑制免疫反应中具有重要作用,可以抑制效应T细胞的活化和分化,从而抑制机体对自体抗原和肿瘤相关抗原产生反应,促进肿瘤的发生、发展。已有实验结果显示,肿瘤组织中Treg细胞数量越多,则意味着肿瘤患者的预后越差[1]。
潜态相关多肽(Latency-associated peptide,LAP)是一种前肽,能与TGF-氨基末端非共价结合,从而形成潜态的 TGF-β复合物。现有研究认为,LAP+CD4+T细胞是一种新型的调节性T细胞,其免疫抑制作用要强于以往发现的传统CD4+CD25+Treg[2],可抑制自身免疫性疾病、心血管疾病的进展和器官移植排斥反应[3-4]。现有研究结果显示,在肝癌、胃癌和结直肠癌组织中LAP+CD4+T细胞的数量增多,可能使肿瘤细胞逃脱了机体的免疫系统监视,促进肿瘤的发生和进展[5-7]。胃癌患者LAP+CD4+T细胞与CD4+CD25+Treg细胞及临床病理因素的相关性,尚未见报道。因此,本研究将从这两方面初步研究LAP+CD4+T细胞在胃癌患者肿瘤微环境中的临床意义,现报道如下。
1 资料与方法
1.1 一般资料
采集2018年1月~2019年6月在我院胃腸疝外科住院治疗的胃癌患者临床资料。所有患者均行手术治疗(D3术式),术后病理诊断明确为腺癌,术后标本送检淋巴结数≥12枚,并进行TNM分期。排除标准:(1)胃癌术后复发,家族性息肉病恶变者;(2)肿瘤穿孔或出血行急诊手术者;(3)合并急慢性感染、系统性红斑狼疮、类风湿性关节炎等自身免疫系统性疾病者;(4)术前行放化疗、免疫治疗、靶向治疗或口服激素治疗者。共50例患者纳入研究作为试验组,年龄26~77岁,平均(58.4±10.8)岁,其中男33例,女17例,直肠癌31例,结肠癌19例,Ⅰ+Ⅱ期15例,Ⅲ+Ⅳ期35例。抽取50例胃癌患者术前外周血标本,另抽取50例健康志愿者(Healthy donor,HD)外周血标本为对照组,健康志愿者均行胃镜检查,排除胃恶性肿瘤。两组患者性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院医学伦理委员会批准,患者均签署知情同意书。
1.2 方法
1.2.1 主要试剂 PE Anti-Human LAP、FITC Anti-Human CD4、APC Anti-Human CD25及同型抗体购自美国eBioscience公司,10%浓度的淋巴细胞分离液(Ficoll-hypaque)、1%多聚甲醛、两性霉素B、L-谷胺酰氨、DNA酶、RPMI1640购自上海索莱宝生物科技有限公司;胎牛血清(FBS)购自美国Gibico公司。
1.2.2 流式细胞检测步骤 吸取3 mL 10%淋巴细胞分离液于15 mL离心管中,抽取胃癌患者外周血3 mL,沿管壁缓慢加入,淋巴细胞液位于下层,2500 rpm离心20 min,中间云雾状层则为淋巴细胞,吸取加入10 mL离心管中,PBS液洗涤,1500 rpm离心10 min,洗涤2次,沉淀则为淋巴细胞,弃上水清,RPMI1640重悬细胞,调整浓度为2×106/mL。每份标本分出试验管和同型对照管,各400 μL,试验管加入PE Anti-Human LAP、FITC Anti-Human CD4、APC Anti-Human CD25抗体各5 μL,对照管加入相应的同型抗体各5 μL,室温下,避光、孵育15 min,PBS液洗涤,2100 rpm离心5 min,弃上清,加1%多聚甲醛,400 μL重悬,上流式仪检测。
1.3 统计学方法
采用SPSS19.0统计学软件进行分析,流式细胞检测结果采用Flowjo7.6.1软件进行分析,符合正态分布的计量资料以(x±s)表示,组间比较采用独立样本t检验,如不符合正态分布则以[M(P25,P75)]表示,组间比较采用秩和检验,相关性检验采用Pearson相关分析,检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 LAP+CD4+T细胞占CD4+T细胞的百分比差异
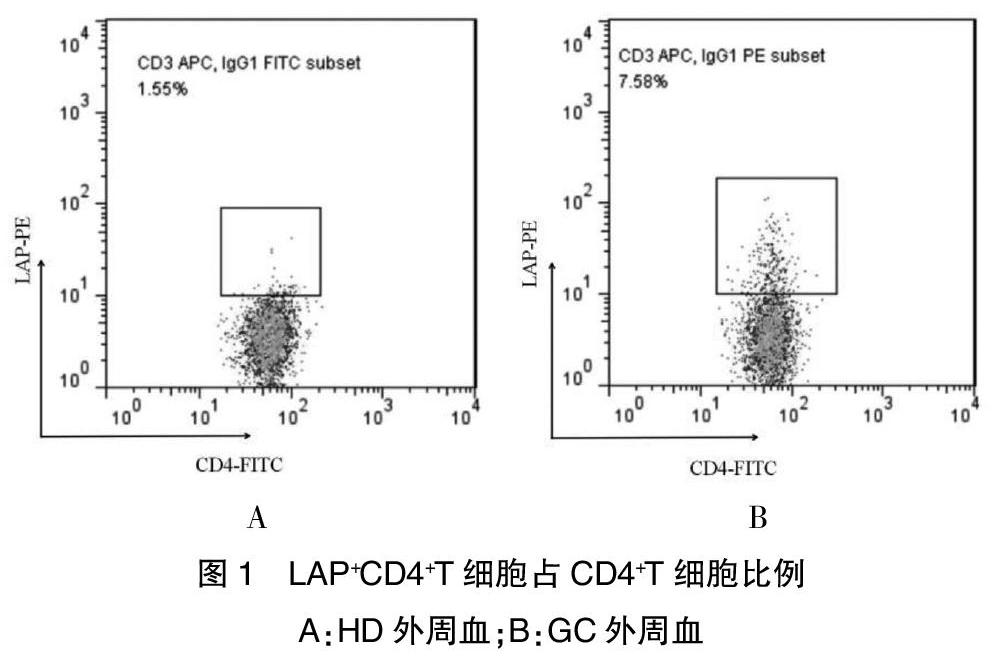
健康志愿者外周血中LAP+CD4+T细胞占CD4+T细胞的比例为1.76(0.79,2.35)%,见图1A;胃癌患者外周血中LAP+CD4+T细胞占CD4+T细胞的比例为7.58(6.23,8.22)%,组间比较,差异有统计学意义(Z=6.923,P<0.001)。见图2B。
2.2 LAP+CD4+ T细胞与CD4+CD25+ Treg细胞表达相关性
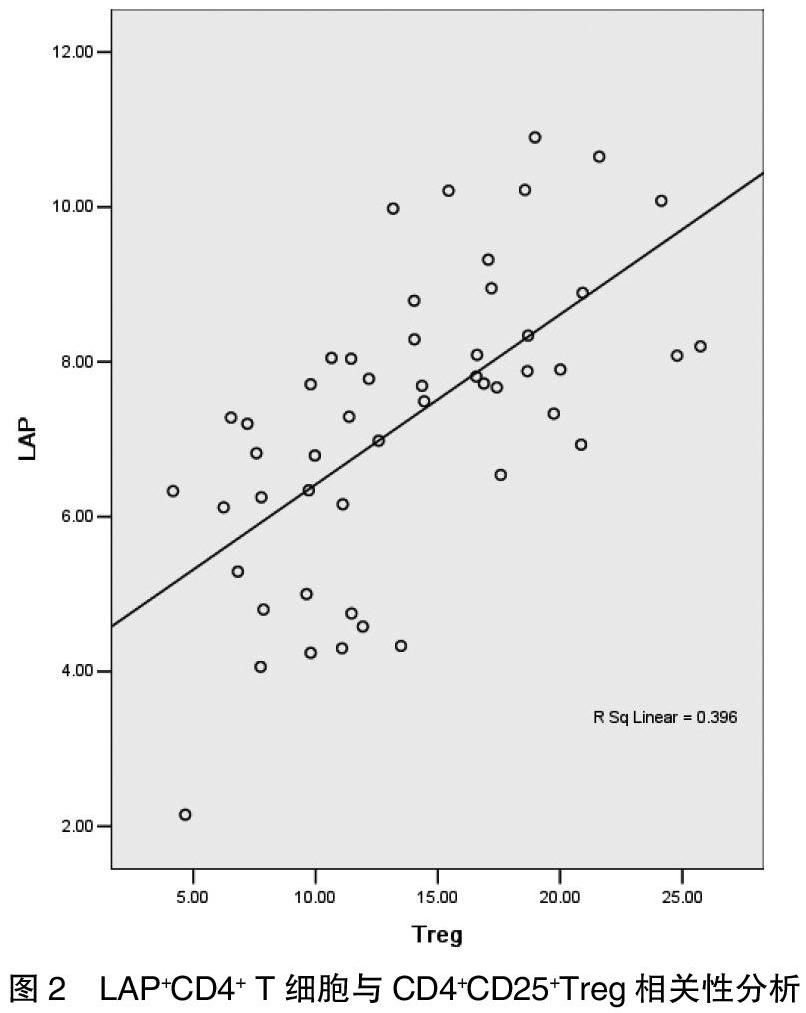
外周血中CD4+CD25+ Treg细胞占CD4+T细胞的比例为13.33(9.78,17.82)%,相关性分析结果显示,胃癌患者外周血中LAP+CD4+ T细胞与CD4+CD25+ Treg细胞占CD4+T细胞比例呈正相关(r=0.629,P<0.001)。见图2。
2.3 LAP+CD4+ T细胞分布情况与胃癌患者临床病理因素的关系
肿瘤TNM分期越晚,LAP+CD4+ T细胞占CD4+T细胞比例越高(P<0.001);有远处转移患者LAP+CD4+ T细胞占CD4+T细胞比例高于无转移者(P<0.001)。见表2。
3 讨论
机体的免疫系统可以识别肿瘤并产生相应的免疫应答,清除突变的肿瘤细胞。免疫系统功能的发挥由精确而复杂的调节网络所控制,任何环节发生改变均会影响免疫功能的正常发挥,使免疫调节失去平衡。人体内Treg细胞在肿瘤免疫逃逸机制中发挥了关键的作用。已有研究结果显示,乳腺癌、卵巢癌、肺癌、肝癌等多种恶性肿瘤患者外周血及肿瘤组织中的Treg比例升高,并与肿瘤的进展程度、预后呈负相关,这些升高的Treg细胞能抑制机体的抗肿瘤免疫,降低肿瘤免疫治疗的效果[8-9]。LAP+CD4+T细胞是一种新发现的Treg细胞,目前研究多见于风湿性关节炎、系统性红斑狼疮、急性冠状动脉综合征、器官移植排斥反应、炎症性肠病等自身免疫系统疾病[4,10-12],LAP+CD4+T细胞能够抑制免疫反应,从而缓解了自身免疫性疾病的进展。而关于LAP+CD4+T细胞与恶性肿瘤间的关系,现仍较少见报道。
本研究结果显示,胃癌患者外周血LAP+CD4+T细胞的分布比例要高于与健康志愿者,且与肿瘤的TNM分期、远处转移密切相关,肿瘤分期越晚,LAP+CD4+T细胞比例越高,特别是有远处转的患者外周血LAP+CD4+ T细胞比例要明显高于无转移者(P<0.001),这进一步证明了LAP+CD4+T细胞在胃癌患者体内起着抑制免疫功能、促进肿瘤生长的作用。Lee等[2]的研究显示,LAP+CD4+T细胞高表达TGF-β1和IL-10均为免疫负性调控因子,可以抑制免疫细胞的活化和增殖,降低机体免疫细胞的抗肿瘤免疫反应[13],从而使肿瘤细胞发生、进展和转移。因此,外周血LAP+CD4+T细胞分布情况可能成为判断胃癌患者肿瘤分期及预后的标志物之一。
相关性分析结果显示,胃癌患者外周血中LAP+CD4+T细胞与CD4+CD25+Treg细胞的表达比例呈正相关。CD4+CD25+Treg细胞是传统的调节性T细胞,在以往的研究中胃癌患者外周血及肿瘤组织中CD4+CD25+Treg细胞比例升高,与预后密切相关,起着促进肿瘤生长的作用[14]。Zhang等[15]的研究显示,LAP+CD4+T细胞可以分泌大量的TGF-β1,而LAP+CD4+T细胞膜表面结合的LAP也可与无活性的TGF-β1前体作用,转化成具有活力的 TGF-β1。TGF-β1是诱导CD4+CD25+Treg分化的一种关键细胞因子,Marie等[16]的研究发现MFC胃癌细胞可以通过分泌 TGF-β1诱导CD4+CD25+Treg的分化,进而抑制淋巴细胞的免疫活性,逃脱免疫监视。Liu等[17]发现在胃癌患者体内的TGF-β1和Treg的表达呈正相关,胃癌细胞培养上清中的TGF-β1能够刺激诱导 CD4+CD25+初始T细胞转化为有免疫抑制功能的CD4+Foxp3+Treg。因此,LAP+CD4+T细胞可能与CD4+CD25+Treg相互聯系,相互影响,共同促进胃癌的进展、转移。
综上所述,胃癌患者外周血中LAP+CD4+T细胞比例的增加可能抑制了机体对肿瘤的免疫应答反应,使肿瘤细胞发生“免疫逃逸”,从而促进了肿瘤的发生、发展和转移。因此,在今后的免疫治疗策略中,可以考虑通过抑制LAP+CD4+T细胞的活性或封闭其部分功能,以提高机体的抗肿瘤免疫反应,为肿瘤的免疫治疗提供一种新的策略,但LAP+CD4+T细胞在胃癌患者机体内如何发挥其免疫抑制功能尚不明确,还需要更加深入的研究。
[参考文献]
[1] 曹雪涛,何维.医学免疫学[M]. 3版. 北京:人民卫生出版社,2015:207.
[2] Lee JS,Won HS,Sun DS,et al. Prognostic role of tumor-infiltrating lymphocytes in gastric cancer:A systematic review and meta-analysis[J]. Medicine,2018,97(32):e11769.
[3] Liu X,Zhang ZZ,Zhao G. Recent advances in the study of regulatory T cells in gastric cancer[J]. International Immunopharmacology,2019,73:560-567.
[4] 严展鹏,徐婷婷,朱方石.调节性T细胞促进胃癌发生的研究进展[J].细胞与分子免疫学杂志,2016,32(8):1140-1143.
[5] Gandhi R,Farez MF,Wang Y,et al. Cutting edge:Human latency-associated peptide+ T cells:A novel regulatory T cell subset[J]. J Immunol,2010,184(9):4620-4624.
[6] Wang HH,Song H,Pham A,et al. Human LAP+GARP+FOXP3+ regulatory T cells attenuate xenogeneic graft versus host disease[J]. Theranostics,2019,9(8):2315-2324.
[7] 钟武. LAP+CD4+T细胞在结直肠癌肿瘤微环境中的作用机制[D].南宁:广西医科大学,2015.
[8] 肖文璐,蒋敬庭,卢斌峰.调节性T细胞在肿瘤免疫中作用机制及治疗新策略的研究进展[J].中国肿瘤生物治疗杂志,2019,26(12):1387-1391.
[9] 孙德彬,熊雪芳,周家峰,等.哮喘患者外周血调节性T细胞和Th1/Th2的变化及其与哮喘病情的关系[J].中国现代医生,2016,54(16):6-9.
[10] 唐婷婷,赵曼曼.CIN及宫颈癌患者外周血调节性T细胞的表达及意义[J].中国现代医生,2019,57(31):15-17.
[11] Whiteside TL. What are regulatory T cells(Treg) regulating in cancer and why?[J]. Semin Cancer Biol,2012,22(4):327-334.
[12] 林秀清,黄智铭,陈新,等.胃癌患者外周血中CD4+CD25+调节性T细胞和Th17细胞的表达和临床意义[J].中国现代医生,2018,56(13):21-24.
[13] Scurr M,Ladell K,Besneux M,et al. Highly prevalent colorectal cancer-infiltrating LAP+Foxp3-T cells exhibit more potent immunosuppressive activity than Foxp3+regulatory T cells[J]. Mucosal Immunol,2014,7(2):428-439.
[14] Chen ML,Yan BS,Bando Y,et al. Latency-associated peptide identifies a novel CD4+CD25+ regulatory T cell subset with TGFbeta-mediated function and enhanced suppression of experimental autoimmune encephalomyelitis[J]. J Immunol, 2008, 180(11): 7327-7337.
[15] Zhang X, Reddy J, Ochi H, et al. Recovery from experimental allergic encephalomyelitis is TGF-beta dependent and associated with increases in CD4+LAP+ and CD4+CD25+T cells[J]. Int Immunol,2006,18(4):495-503.
[16] Marie JC,Letterio JJ,Gavin M,et al. TGF-beta1 maintains suppressor function and Foxp3 expression in CD4+CD25+ regulatory T cells[J]. J Exp Med,2005,201(7):1061-1067.
[17] Liu VC,Wong LY,Jang T,et al. Tumor evasion of the immune system by converting CD4+CD25- T cells into CD4+CD25+ T regulatory cells:Role of tumor-derived TGF-beta[J]. J Immunol,2007,178(5):2883-2892.
(收稿日期:2020-05-25)
